9.8: Alcaluros y Electricos
- Page ID
- 72196
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Otra consecuencia interesante de las energías reticulares implica la formación de ciertas sales que contienen aniones Na y e. Estos compuestos se conocen como alcalidos y electridos, respectivamente. [9] La mayoría de estos compuestos han sido descubiertos por el profesor James Dye en la Universidad Estatal de Michigan.
Los metales alcalinos tienen un electrón en su caparazón de valencia. Por ejemplo, las configuraciones electrónicas de Na y K son [Ar] 3s 1 y [Kr] 4s 1, respectivamente. Si bien estamos acostumbrados a ver estos elementos muy electropositivos renunciar a sus electrones cuando hacen compuestos con elementos electronegativos, también pueden ganar un electrón para lograr una configuración [gas noble] ns 2. Esto es posible con donadores de electrones fuertes como los metales alcalinos, especialmente cuando el catión que se forma se estabiliza por coordinación a un éter corona. Típicamente, estos compuestos se sintetizan combinando el metal alcalino y el éter corona apropiado en amoníaco líquido, y luego evaporando el amoníaco.
|
Cavidades y canales en un eléctrico |
Las sales electridas se forman bajo condiciones similares, excepto en este caso el anión es simplemente un electrón que existe en una “cavidad” aniónica en el cristal. Las estructuras cristalinas son claramente similares a sales, alternando los cationes (cationes alcalinos estabilizados por ligandos corona o criptand) alternando en la estructura con electrones.
Sal alcalinida
\[\ce{2Na ->[NH_{3}] Na^{+}(NH3)+ e^{-}(NH3) ->[18C6] [Na(18C6)]^{+} Na^{-}}\]
Sal Electrica
\[\ce{2Cs ->[NH_{3}][18C6] [Cs(18C6)]^{+} e^{-}}\]
La complejación de Na + (K +, Rb +, Cs +) con ligandos de éter corona estabiliza la forma M + del metal (forma “sal”). Debido a que el catión metálico con su cubierta de ligando es bastante grande, la energía reticular de estas sales es bastante baja.
|
18-Corona-6, un éter corona que compleja fuertemente cationes Na + |
Las soluciones de sales eléctricas son potentes agentes reductores, como lo demuestra su uso en la reducción de Abedul, en la que se hidrogenan compuestos aromáticos para producir dienos. Los electridos también son útiles para reducir iones metálicos a metales. La evaporación de las soluciones de electrido azul en amoníaco anhidro proporciona un espejo de Na. Tales soluciones pierden lentamente su color a medida que los electrones reducen el amoníaco al anión amida:
\(\ce{[Na(NH3)6]^{+}e^{-} + NH3 -> NaNH2 + H2}\)
Es interesante considerar, en el contexto de las energías reticulares y los ciclos Born-Haber, lo que podría suceder sin que estos ligandos estén presentes. Es decir, podemos preguntarnos si el metal de sodio preferiría existir en la forma metálica como Na (s), o formar la sal sódica Na + Na -, o la sal eléctrica Na + e -. Por supuesto, ya sabemos la respuesta a esta pregunta. El sodio elemental es claramente un metal (es brillante, conduce electricidad y tiene una estructura cristalina de bcc) y nunca se ha observado en ninguna de las formas de “sal”. Pero, ¿a qué distancia están estas formas energéticamente?
Podemos calcular la energética asumiendo que el ion Na tiene aproximadamente el mismo tamaño que Br -, y que el anión e es aproximadamente del mismo tamaño que Cl -. Entonces las energías reticulares en los ciclos se vuelven las mismas que las del NaBr y el NaCl:
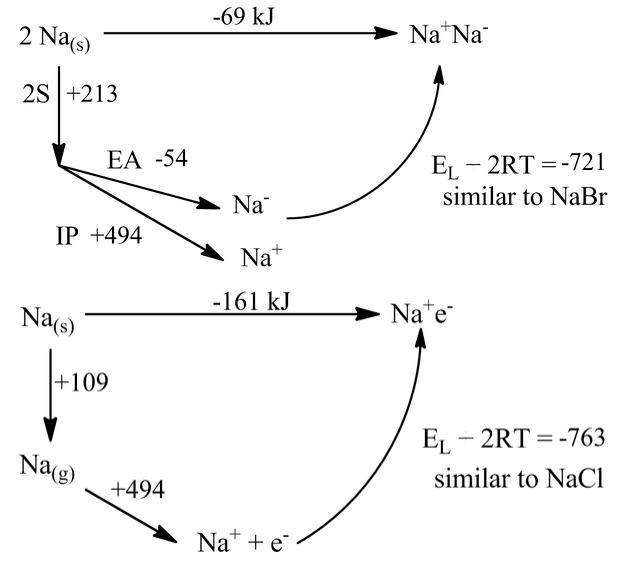
El resultado bastante sorprendente de estos cálculos es que el sodio sería marginalmente estable como una sal sódica y muy estable (en 161 kJ) como un eléctrico. Todos los términos en estos ciclos simples son conocidos con precisión. Pero hay que estar haciendo algo mal aquí, porque Na (s) es claramente metálico.
El punto clave y sutil aquí es que los ciclos de Born-Haber consideran solo la energía potencial (en lugar de la energía total) de las sustancias en el ciclo. Normalmente podemos ignorar la parte de energía cinética de la energía total, pero en este caso no podemos por el efecto mecánico cuántico de la resonancia.