9.11: El extraño caso de los óxidos alcalinos
- Page ID
- 72224
Los óxidos alcalinos, hechos por reacción de metales alcalinos (Li, Na, K, Rb, Cs) con oxígeno, muestran una tendencia inusual. Cuando el litio reacciona con oxígeno obtenemos el óxido binario Li 2 O, como se esperaba de combinar un elemento en el grupo I con uno en el grupo VI. Curiosamente, el óxido que se forma más fácilmente cuando se oxida sodio metal no es Na 2 O, sino que es el peróxido Na 2 O 2, que podemos formular como (Na +) 2 (O 2 2-). Con potasio, rubidio y cesio obtenemos los superóxidos MO 2, los cuales contienen el anión radical superóxido (O 2 -. ) y debe formularse como (M +) (O 2 -). Si bien es posible hacer Na 2 O, K 2 O, Rb 2 O y Cs 2 O por reacción del nitrato metálico apropiado (MNO 3) con M de metal alcalino elemental, [16] es curioso que estos compuestos “valentes normales” no se formen por reacción directa del metal con oxígeno.
|
El metal de sodio se oxida en el aire a peróxido de sodio, Na 2 O 2 |
Debido a que los metales alcalinos son todos muy electropositivos (χ = 0.8-1.0), y el oxígeno es muy electronegativo (χ = 3.5), esperamos que todos los compuestos que elaboramos combinándolos sean fiablemente iónicos. Consistente con esta imagen encontramos que Li 2 O (junto con Na 2 O, K 2 O y Rb 2 O) adopta la estructura antifluorita (coordinación 8:4 - ver problema 8.8.2), que esperamos encontrar con compuestos M 2 X relativamente iónicos. Sin embargo, extrañamente, Cs 2 O cristaliza en la estructura anti-CDCl 2. Esto es extraño porque CdCl 2 tiene una estructura en capas que normalmente asociamos con compuestos MX 2 covalentes polares (ver sección 8.4). En Cs 2 O, seis cationes Cs + rodean cada anión O 2- en un octaedro. Cada Cs + se coordina a tres iones O 2-, y los iones Cs + entran en contacto entre sí a través de una brecha de van der Waals. La yuxtaposición de iones Cs + cerca uno del otro es claramente desfavorable electrostáticamente, entonces ¿por qué Cs 2 O prefiere la estructura anti-CDCl 2 a antifluorita?
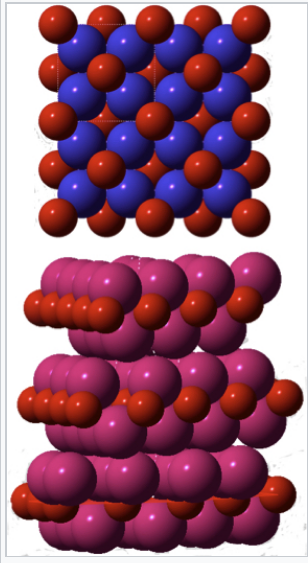
La respuesta tiene que ver con el hacinamiento de iones alcalinos alrededor del oxígeno, como se ilustra para K 2 O a la derecha. Debido a que ocho grandes iones K + rodean cada ion O 2- en la estructura, los cationes están esencialmente en contacto. De hecho, los enlaces metal-oxígeno se “estiran” en Na 2 O, K 2 O y Rb 2 O con relación a los enlaces M-O con el mismo orden de enlace en otras estructuras. [17] La situación es tan extrema para Cs 2 O que encuentra una estructura (electrostáticamente desfavorable) en la que la coordinación se baja a 6:3. Este problema de empaquetamiento se alivia algo en los peróxidos, donde la coordinación sigue siendo 8:4 pero el anión es mayor, y especialmente en los superóxidos donde la relación catión:anión es 1:1 y la coordinación es 6:6. Así, los iones alcalinos más grandes (K +, Rb +, Cs +) tienden a formar superóxidos.
|
Modelos de relleno de espacio de las estructuras cristalinas de K 2 O (arriba) y Cs 2 O (abajo). Los átomos de oxígeno son rojos, los iones de potasio son azules y los iones de cesio son magenta |
Otra manera de racionalizar esta tendencia es a través de la energía de formar los óxidos, peróxidos y superóxidos.
Calculemos el cambio de entalpía (por mol de metal) para formar un óxido metálico M 2 O a partir del metal y oxígeno:
\(\ce{M_{(s)} + \frac{1}{4} O2 _{(g)} -> \frac{1}{2} M2O_{(s)}}\)
Podemos usar la ley de Hess's para escribir esto como una suma de reacciones:
| Reacción | ΔH |
|---|---|
| \(\ce{M_{(s)}-> M_{(g)} -> M^{+}_{(g)}}\) | \(\Delta_{s} + IE = \Delta_{f, M^{+} (g)}\) |
| \(\ce{\frac{1}{4} O2_{(g)} -> \frac{1}{2}O_{(g)} -> \frac{1}{2} O^{2-}}\) | \(\frac{1}{4} \Delta H_{d} + \frac{1}{2} EA_{1} + \frac{1}{2}EA_{2} = \frac{1}{2} \Delta H_{f, O^{2-} (g)}\) |
| \(\ce{M^{+}_{(g)} + \frac{1}{2}O^{2-}_{(g)} -> \frac{1}{2}M2O_{(s)}}\) | \(\frac{1}{2} E_{L, M_{2}O} - \frac{3}{2}RT\) |
| En general: | |
| \(\ce{M_{(s)} + \frac{1}{4}O2_{(g)} -> \frac{1}{2}M2O_{(s)}}\) | \(\Delta H_{f, M^{+}(g)} + \frac{1}{2} \Delta H_{f, O^{2-} (g)} + \frac{1}{2} E_{L, M_{2}O} -\frac{3}{2} RT\) |
Para obtener el cambio de entalpía para la reacción general (el calor de formación de 1/2 mol de M 2 O) necesitaremos los calores de formación de M + (g) y O 2- (g), que están disponibles a partir de valores tabulados, y E L, que podemos calcular a partir de la ecuación de Kapustinskii.
Del mismo modo, podemos escribir para la formación de los peróxidos alcalinos:
\(\ce{M_{(s)} + \frac{1}{2}O2_{(g)} -> \frac{1}{2}M2O2_{(s)}}\)
Reacción
| Reacción | ΔH |
|---|---|
| \(\ce{M_{(s)} -> M_{(g)} -> M^{+}_{(g)}}\) | \(\Delta H _{(f, M^{+} (g)}\) |
| \(\ce{\frac{1}{2} O2_{(g)} -> \frac{1}{2}O2^{2-}_{(g)}}\) | \(\frac{1}{2} \Delta H_{f, O_{2}^{2-} (g)}\) |
| \(\ce{M^{+}_{(g)} + \frac{1}{2} O2^{2-}_{(g)} -> \frac{1}{2} M2O2_{(s)}}\) | \(\frac{1}{2} E_{L, M_{2}O_{2}} - \frac{3}{2} RT\) |
| En general: | |
| \(\ce{M_{(s)} + \frac{1}{2}O2_{(g)} ->\frac{1}{2}M2O2_{(s)}}\) | \(\Delta H_{f, M^{+} (g)} + \frac{1}{2} \Delta H_{f, O_{2}^{2-} (g)} + \frac{1}{2} E_{L, M_{2}O_{2}} - \frac{3}{2} RT\) |
y para los superóxidos:
\(\ce{M_{(s)} + O2_{(g)} -> MO2_{(s)}}\)
| Reacción | ΔH |
|---|---|
| \(\ce{M_{(s)} -> M_{(g)} -> M^{+}_{(g)}}\) | \(\Delta H_{f, M^{+} (g)} \) |
| \(\ce{O2_{(g)} -> O2^{-}_{(g)}}\) | \(\Delta H_{f, O_{2}^{-} (g)}\) |
| \(\ce{M^{+}_{(g)} + O2^{-}_{(g)} -> MO2_{(s)}}\) | \(E_{L, MO_{2}} - 2RT\) |
| En general: | |
| \(\ce{M_{(s)} + O2_{(g)} -> MO2_{(s)} }\) | \(\Delta H_{f, M^{+} (g)} + \Delta H_{(f, O_{2}^{-}(g)} + E_{L, MO_{2}} - 2RT\) |
Para los aniones y cationes gaseosos, tenemos los siguientes calores de formación y radios iónicos (CN=6):
| Ion | ΔH f, kJ | radio iónico, Å |
|---|---|---|
| Li + | 678 | 0.76 |
| Na + | 602 | 1.02 |
| K + | 506 | 1.38 |
| Rb + | 485 | 1.52 |
| Cs + | 473 | 1.67 |
| O 2- | 500 | 1.20 |
| O 2 - | 519 | 1.59 |
| O 2 - | -88 | 1.49 |
Ahora usando la ecuación de Kapustinskii, podemos calcular las energías de celosía para cada compuesto; estas se han convertido en entalpías reticulares restando 2 RT o 3 RT según corresponda:
\[\mathbf{E}_{L} = \frac{1213.8z_{+}z_{-}n}{r_{+}+r_{-}}(1 - \frac{0.345}{r_{+}+r_{-}})\]
| Metal | ΔH L, M 2 O | ΔH L, M 2 O 2 | ΔH L, MO 2 |
|---|---|---|---|
| Li | -3,065 kJ | -2,651 kJ | -918 kJ |
| Na | -2,776 | -2,433 | -838 |
| K | -2,454 | -2,178 | -751 |
| Rb | -2,345 | -2,090 | -721 |
| Cs | -2,241 | -2,007 | -678 |
Como era de esperar, las energías reticulares para M 2 O y M 2 O 2 son comparables, siendo estas últimas algo menores en magnitud debido al mayor tamaño del anión O 2 -. Las energías reticulares de los superóxidos, MO 2, son aproximadamente 1/3 de las de los peróxidos correspondientes porque tanto el anión como el catión están cargados individualmente, y solo hay dos iones por unidad de fórmula.
Ahora, juntándolo todo, podemos usar las energías reticulares y los calores de formación de los iones individuales para comparar los calores de formación (por mol de metal) de cada uno de los óxidos:
| Metal | 1/2 ΔH f, M 2 O | 1/2 ΔH f, M 2 O 2 | ΔH f, MO 2 |
|---|---|---|---|
| Li | -404 kJ | -388 kJ | -328 kJ |
| Na | -338 | -354 | -324 |
| K | -271 | -321 | -328 |
| Rb | -241 | -300 | -324 |
| Cs | -53 | -70 | -81 |
Podemos ver que para Li, la formación de Li 2 O se ve favorecida sobre Li 2 O 2 o LiO 2 debido a la energía reticular muy favorable de Li 2 O. A medida que la energía de la red se vuelve menos negativa con el aumento del tamaño del catión, el peróxido se vuelve el más estable en Na. Para los álcalis más pesados, M 2 O se vuelve bastante inestable y los superóxidos MO 2 son los más estables. Esto concuerda con nuestras observaciones de la química de los óxidos del grupo I.
Baterías Metal-aire
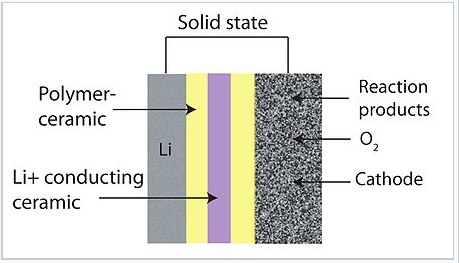
Los óxidos alcalinos son bastante interesantes en el contexto de las baterías de metal-aire debido a su potencial de almacenamiento de energía extremadamente alto sobre una base de masa. Dichas baterías tienen ánodos de metal alcalino (típicamente Li) o Zn y utilizan oxígeno del aire en el cátodo. Aunque el litio es el metal alcalino más ligero y por lo tanto el más denso en energía, existen problemas de materiales asociados con la formación de dendritas de Li cuando se recarga la batería, y también con la lenta cinética de la interconversión de cuatro electrones entre O 2 (g) y 2 O 2- at el cátodo. Por esta razón, actualmente se están estudiando baterías de superóxido como alternativas. La reacción catódica de un electrón O 2 + e - = O 2 - es cinéticamente rápida, y el potasio [18] y el sodio [19] representan alternativas potencialmente viables al litio para el ánodo de estas baterías que respiran aire. Recientemente, se ha demostrado que LiO 2 puede estabilizarse cinéticamente mediante el crecimiento de plantillas en nanopartículas de iridio, abriendo potencialmente la puerta a baterías de litio-aire de muy alta densidad de energía. [20]
|
Esquema de una batería de litio que respira aire |