9.12: Energías de celosía y solubilidad
- Page ID
- 72166
Las energías de celosía también pueden ayudar a predecir las solubilidades compuestas. Consideremos un ciclo de Born-Haber para disolver una sal en agua. Podemos imaginarlo como la suma de dos procesos: (1) la vaporización de la sal para producir iones gaseosos, caracterizados por la entalpía reticular, y (2) la hidratación de esos iones para producir la solución. El cambio de entalpía para el proceso general es la suma de esos dos pasos. Sabemos que el cambio de entropía para la disolución de un sólido es positivo, por lo que la solubilidad depende del cambio de entalpía para el proceso general.

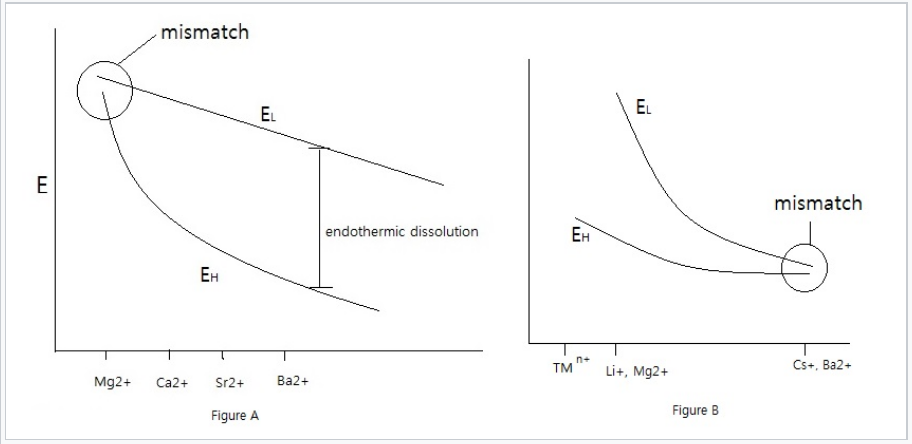
Aquí hay que considerar las tendencias tanto en la energía reticular E L como en la energía de hidratación E H. La energía reticular depende de la suma de los radios anión y catión (r + + r -), mientras que la energía de hidratación tiene términos aniones y cationes separados. Generalmente la solvatación de iones pequeños (típicamente cationes) domina la energía de hidratación debido a la dependencia de 1/r 2.
\[E_{L} \alpha \frac{1}{r_{+}+ r_{-}}\]
\[E_{H} \alpha \frac{1}{r_{+}^{2}} + \frac{1}{r_{-}^{2}}\]
Para las sales que contienen aniones grandes, E L no cambia mucho a medida que cambia r +. Esto se debe a que el anión domina el término r + + r - en el denominador de la fórmula para E L. Por otro lado, E H cambia sustancialmente con r +, especialmente para cationes pequeños.
Como resultado, las sales de sulfato de pequeños cationes divalentes, como MgSO 4 (sales de epsom), son solubles, mientras que la menor energía de hidratación de Ba 2+ en BaSO 4 hace que esa sal sea insoluble (K sp = 10 -10).
|
Izquierda: Diagrama E L para sales de sulfato. El gran ion SO 4 2- no coincide en tamaño con cationes pequeños como Mg 2+, que tienen grandes energías de hidratación, resultando sales solubles. Con cationes más grandes como Ba 2+, que tienen menor E H, la energía reticular excede la entalpía de solvatación y las sales son insolubles. Derecha: En el caso de aniones pequeños como F - y OH -, la energía reticular domina con pequeños cationes como iones de metales de transición (TM n+), Mg 2+ y Li +. El desajuste de tamaño anión-catión ocurre con cationes más grandes, como Cs + y Ba 2+, que producen sales de fluoruro solubles. |
Para aniones pequeños, E L es más sensible a r +, mientras que E H no depende de r + con tanta fuerza. Para fluoruros e hidróxidos, LiF es ligeramente soluble mientras que CsF es muy soluble y Mg (OH) 2 es insoluble mientras que Ba (OH) 2 es muy soluble.
Al juntar ambas tendencias, vemos que la baja solubilidad se encuentra con mayor frecuencia cuando el anión y el catión coinciden bien en sus tamaños, especialmente cuando uno o ambos tienen carga múltiple.
|
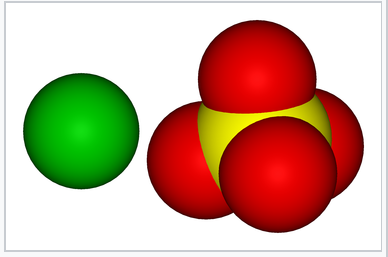
Modelos de relleno de espacio que muestran las superficies van der Waals de Ba 2+ y SO 4 2-. La similitud en el tamaño de los dos iones contribuye a la baja solubilidad de BaSO 4 en agua. |
Combinando todas nuestras conclusiones sobre la solubilidad, observamos las siguientes tendencias:
1) Aumentar el desajuste de tamaño entre el anión y el catión conduce a una mayor solubilidad, por lo que CsF y LiI son los haluros alcalinos más solubles.
2) El aumento de la covalencia conduce a una menor solubilidad en las sales (debido al mayor E L. Por ejemplo, AgF, AgCl, AgBr y AgI muestran una solubilidad progresivamente menor debido al aumento de la covalencia.
\(\ce{AgF > AgCl > AgBr > AgI}\)
3) El aumento de la carga sobre el anión disminuye la solubilidad debido a que el aumento en E L es grande en relación con el aumento de E H.
4) Los cationes polivalentes pequeños (que tienen E H grande) hacen sales solubles con aniones grandes y univalentes como I -, NO 3 -, ClO 4 -, PF 6 - y acetato.
Ejemplos: Sales de metales de transición e iones lantánidos
- Ln 3+: Las sales de nitrato son solubles, pero los óxidos e hidróxidos son insolubles.
- Fe 3+: El perclorato es soluble, pero el sulfato es insoluble.
5) Los aniones de carga múltiple como O 2-, S 2-, PO 4 3- y SO 4 2- hacen sales insolubles con la mayoría de los metales M 2+, M 3+ y M 4+.