1.3: Estructura Electrónica de los Elementos
- Page ID
- 71726
Las funciones de onda de los electrones en un átomo se llaman orbitales atómicos. Un orbital atómico se expresa utilizando tres números cuánticos; el número cuántico principal, n; el número cuántico acimutal, l; y el número cuántico magnético, m \(ell\). Para un número cuántico principal n, hay n números cuánticos azimutales l que van de 0 a n-1, y cada uno corresponde a los siguientes orbitales.
\[\begin{split} \ell & : 0, 1, 2, 3, 4, \ldots \\ & \; \; \; s, p, d, f, g, \ldots \end{split}\]
Un orbital atómico se expresa por la combinación de n y l. Por ejemplo, n es 3 y l es 2 para un orbital 3d. Hay \(ell\)valores de 2l+1 m, es decir l, l-1, l-2,..., -l. En consecuencia hay orbitales uno s, tres orbitales p, cinco orbitales d y siete orbitales f. Los tres números cuánticos mencionados se utilizan para expresar la distribución de los electrones en átomos de tipo hidrógeno, y otro número cuántico m s (1/2, -1/2) que describe la dirección de un espín electrónico es necesario para describir completamente un estado electrónico. Por lo tanto, un estado electrónico se define por cuatro números cuánticos (n, l, m \(ell\), m s).
La función de onda\(\psi\) que determina la forma orbital se puede expresar como el producto de una función de onda radial R y una función de onda angular Y de la siguiente manera.
\[\psi_{n, l, m_{l}} = R_{n, l} (r) Y_{l, m_{l}} (\theta, \phi)\]
R es una función de la distancia desde el núcleo, e Y expresa la componente angular de la órbita. Las formas orbitales se muestran en la Figura\(\PageIndex{1}\). Dado que la probabilidad de la existencia del electrón es proporcional al cuadrado de la función de onda, un mapa de densidad de electrones se asemeja al de una función de onda. Deben cumplirse las siguientes condiciones cuando cada orbital esté lleno de electrones.
[Las condiciones de llenado de electrones]
Principio de Pauli
El número de electrones a los que se les permite ocupar un orbital debe limitarse a uno o dos, y, para este último caso, sus espines deben ser antiparalelos (dirección diferente).
Regla del perro
Cuando hay orbitales de igual energía, los electrones ocupan orbitales separados y sus espines son paralelos (misma dirección).
El orden de la energía orbital de un átomo neutro es
\[1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p \ldots\]
y la configuración electrónica se determina a medida que los electrones ocupan orbitales en este orden según el principio Pauli y la regla de Hund. Un orbital s con un m \(ell\)puede acomodar 2 electrones, un orbital p con tres electrones m \(ell\)6 y un orbital d con cinco electrones m \(ell\)0.
Ejercicio\(\PageIndex{1}\)
Describir la configuración electrónica de un átomo de C, un átomo de Fe y un átomo de Au.
- Contestar
-
Los electrones iguales al número atómico están dispuestos en el orden de las energías orbitales. Dado que los electrones dentro de la capa de valencia toman la configuración de gas raro, pueden ser denotados por el símbolo de un elemento de gas raro entre paréntesis.
\[\begin{split} C & : 1s^{2} 2s^{2} 2p^{2} \quad or \quad [He] 2s^{2} 2p^{2} \\ Fe & : 1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{6} 4s^{2} \quad or \quad [Ar] 3d^{6} 4s^{2} \\ Au & : 1s^{2} 2s^{2} 2p^{6} 3s^{2} 3p^{6} 3d^{10} 4s^{2} 4p^{6} 4d^{10} 4f^{14} 5s^{2} 5p^{6} 5d^{10} 6s^{1} \quad or \quad [Xe] 4f^{14} 5d^{10} 6s^{1} \end{split}\]
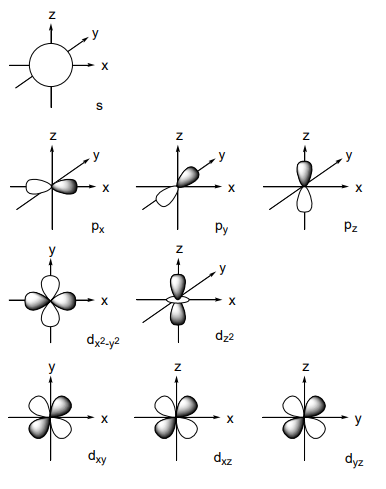
Figura\(\PageIndex{1}\): - Formas de orbitales s, p y d. Tabla Tabla\(\PageIndex{1}\) periódica de elementos. Los valores son pesos atómicos 1 2 3 4 5 6 7 8 9 1 1.008
1 H2 6.941
3 Li9.012
4 Ser3 22.99
11 Na24.31
12 Mg4 39.10
19 K40.08
20 Ca44.96
21 Sc47.87
22 Ti50.94
23 V52.00
24 Cr54.94
25 Mn55.85
26 Fe58.93
27 Co5 85.47
37 Rb87.62
38 Sr88.91
39 Y91.22
40 Z92.91
41 Nb95.94
42 Mo(99)
43 Tc101.1
44 Ru102.9
45 Rh6 132.9
55 Cs137.3
56 BaLantanoide 178.5
72 Hf180.9
73 Ta183.8
74 W186.2
75 Re190.2
76 Os192.2
77 Ir7 (223)
87 Fr(226)
88 RaActinoide Lanthan-oid 138.9
57 La140.1
58 Ce140.9
59 Pr144.2
60 Nd(145)
61 Pm150.4
62 Sm152.0
63 EuActinoide (227)
89 Ac232.0
90 Th231.0
91 Pa238.0
92 U(237)
93 Np(239)
94 Pu(243)
95 Am10 11 12 13 14 15 16 17 18 4.003
2 Él10.81
5 B12.01
6 C14.01
7 N16.00
8 O19.00
9 F20.18
10 Ne26.98
13 Al28.09
14 Si30.97
15 P32.07
16 S35.45
17 Cl39.95
18 Ar58.69
28 Ni63.55
29 Cu65.39
30 Zn69.72
31 Ga72.61
32 Ge74.92
33 As78.96
34 Se79.90
35 Br83.80
36 Kr106.4
46 Pd107.9
47 Ag112.4
48 Cd114.8
49 En118.7
50 Sn121.8
51 Sb127.6
52 Te126.9
53 I131,3
54 Xe195.1
78 Pt197.0
79 Au200.3
80 Hg204.4
81 Tl207.2
82 Pb209.0
83 Bi(210)
84 Po(210)
85 At(222)
86 Rn157.3
64 Gd158.9
65 Tb162.5
66 Dy164.9
67 Ho167.3
68 Er168.9
69 Tm173.0
70 Yb175.0
71 Lu(247)
96 Cm(247)
97 Bk(252)
98 Cf(252)
99 Es(257)
100 Fm(258)
101 Md(259)
102 No(262)
103 Lr

