6.1: Estructuras de Complejos Metálicos
- Page ID
- 71737
Los elementos de transición son elementos metálicos que tienen cubiertas d o f incompletas en los estados neutros o catiónicos. Se les llama también metales de transición y conforman 56 de los 103 elementos. Estos metales de transición se clasifican en los metales del bloque d, que consisten en elementos 3d de Sc a Cu, 4d elementos de Y a Ag, y 5d elementos de Hf a Au, y metales del bloque f, que consisten en elementos lantanoides de La a Lu y elementos actinoides de Ac a Lr. Aunque Sc e Y pertenecen al bloque d, sus propiedades son similares a las de los lantanoides. La química de los elementos del bloque d y del bloque f difiere considerablemente. En este capítulo se describen las propiedades y la química de los metales de transición principalmente del bloque d.
Metales Centrales
Las propiedades de los metales de transición del bloque d difieren considerablemente entre los metales de la primera (3d) y la segunda serie (4d), aunque las diferencias en las propiedades entre los metales de la segunda y tercera serie (5d) no son pronunciadas. Los radios metálicos de elementos desde el escandio, Sc, hasta el cobre, Cu, (166 a 128pm) son significativamente menores que los del itrio, Y, a la plata, Ag, (178 a 144pm) o los del lantano, La, al oro, Au, (188 a 146pm). Además, los compuestos metálicos de la primera serie de metales de transición rara vez tienen 7 coordenadas, mientras que los metales de transición de la segunda y tercera serie pueden ser de 7 a 9 coordenadas. El cerio, Ce, (radio 182pm) ~ lutecio, Lu, (radio 175pm) caen entre La y Hf y, debido a la contracción de lantánidos, los radios metálicos de la segunda y tercera serie de metales de transición muestran poca variación.
Los estados de oxidación más altos en los metales de transición de la segunda y tercera serie son considerablemente más estables que los de los metales de transición de la primera serie. Los ejemplos incluyen hexacloruro de tungsteno, WCl 6, tetróxido de osmio, OsO 4 y hexafluoruro de platino, PtF 6. Los compuestos de la primera serie de metales de transición en estados de oxidación superiores son oxidantes fuertes y, por lo tanto, se reducen fácilmente. Por otro lado, mientras que los compuestos M (II) y M (III) son comunes entre los metales de transición de la primera serie, estos estados de oxidación son generalmente poco comunes en compuestos de metales de segunda y tercera serie. Por ejemplo, hay relativamente pocos compuestos de Mo (III) o W (III) en comparación con muchos compuestos de Cr (III). Los iones aqua (iones con ligandos de agua) son muy comunes entre los compuestos de metales de la primera serie, pero pocos se conocen entre el segundo y tercer compuestos metálicos.
Existen compuestos de conglomerados carbonílicos metálicos de primera serie de metales de transición con enlaces M-M en estados de baja oxidación, pero los compuestos de haluro o sulfuro son raros. En general, los enlaces metal-metal se forman mucho más fácilmente en los metales 4d y 5d que en los 3d. Los momentos magnéticos de los compuestos de metales de transición de la primera serie pueden explicarse en términos de valores de solo espín (cf. Capítulo 6.2 (d)) pero es difícil dar cuenta de los momentos magnéticos de los compuestos de la segunda y tercera serie a menos que se tomen en cuenta factores complejos como las interacciones espín-orbitales.
Por lo tanto, es necesario reconocer y comprender las diferencias significativas en las propiedades químicas que existen entre los metales de los compuestos metálicos de la primera y posterior serie, incluso para elementos del mismo grupo.
Las propiedades de los metales de transición del bloque d son diferentes no solo en las posiciones superior e inferior en la tabla periódica sino también en los grupos izquierdo y derecho. Los metales del Grupo 3 a 5 se conocen ahora a menudo como metales de transición temprana y generalmente son oxófilos y halófilos. El menor número de electrones d y la dureza de estos elementos explican su afinidad hacia el oxígeno duro y los halógenos. En ausencia de ligandos puente, la formación de enlaces metal-metal es difícil para estos elementos. Se sabe que los compuestos organometálicos de estos metales activan fuertemente los enlaces C-H en hidrocarburos. Los metales de transición tardíos en los grupos a la derecha de la tabla periódica son blandos y tienen una alta afinidad hacia el azufre o selenio.
Los metales de transición del bloque d tienen orbitales s, p y d y aquellos con n electrones en los orbitales d se denominan iones con una configuración dn. Por ejemplo, Ti 3+ es un ion d 1, y Co 3 + un ion d 6. El número de electrones que ocupan los orbitales divididos por el campo ligando (cf. 6.2 (a)) se denota por un superíndice en el símbolo orbital. Por ejemplo, un ion con 3 electrones en t 2g y 2 electrones en e g se describe como t 2g 3 e g 1.
Ligandos
Los compuestos de iones metálicos coordinados por ligandos se denominan complejos metálicos. La mayoría de los ligandos son sustancias neutras o aniónicas, pero también se conocen los catiónicos, como el catión tropilio. Los ligandos neutros, como el amoníaco, NH 3, o el monóxido de carbono, CO, son moléculas independientemente estables en sus estados libres, mientras que los ligandos aniónicos, como Cl - o C 5 H 5 -, se estabilizan solo cuando están coordinados con metales centrales. Los ligandos representativos se listan en la Tabla de\(\PageIndex{1}\) acuerdo con los elementos ligantes. Los ligandos comunes o aquellos con fórmula química complicada se expresan en formas abreviadas.
Aquellos ligandos con un solo átomo ligante se denominan ligandos monodentados, y aquellos con más de un átomo ligante se denominan ligandos polidentados, que también se denominan ligandos quelatos. El número de átomos unidos a un metal central es el número de coordinación.
| Nombre | Abreviatura | Fórmula |
|---|---|---|
| hydrido | H - | |
| carbonilo | CO | |
| ciano | CN - | |
| metilo | Yo | CH 3 - |
| ciclopentadienilo | Cp | C 5 H 5 - |
| carbonato | CO 3 2- | |
| ammine | NH 3 | |
| piridina | py | C 5 H 5 N |
| bipiridina | bipy | C 10 H 8 N 2 |
| trifenilfosfina | PPh 3 | P (C 6 H 5) 3 |
| aqua | aq | H 2 O |
| acetilacetonato | acac | CH 3 C (O) CH 2 C (O) CH 3 - |
| tiocianato | SCN - | |
| cloro | Cl - | |
| etilendiaminotetraacetato | edta | (OOCCH 2) 2 NCH 2 CH 2 N (CH 2 COO) 2 4- |
Número de coordinación y estructuras
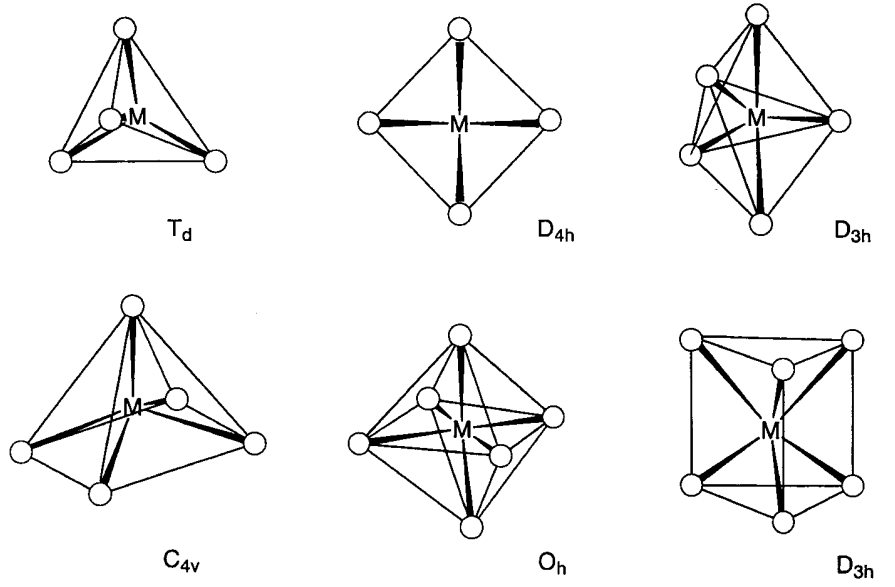
Los compuestos moleculares que consisten en metales de transición del bloque d y ligandos se denominan complejos o compuestos de coordinación. El número de coordinación está determinado por el tamaño del metal central, el número de electrones d o los efectos estéricos derivados de los ligandos. Se conocen complejos con números de coordinación entre 2 y 9. En particular, las coordinaciones de 4 a 6 son las más estables electrónica y geométricamente y los complejos con estos números de coordinación son los más numerosos (Figura\(\PageIndex{1}\)). A continuación se describen complejos con los respectivos números de coordinación.
Dos complejos de coordenadas
Muchos iones d 10 ricos en electrones, a saber: Cu +, Ag + y Au +, forman complejos lineales como [Cl-Ag-Cl] - o [H 3 N-Au-Nh 3] -. También se conoce un complejo de valencia cero [Pd (PCy 3) 2] con ligandos triciclohexilfosfina muy voluminosos. Generalmente, los complejos estables de 2 coordenadas son conocidos para los metales de transición tardía.
Tres complejos de coordenadas
Aunque [Fe {N (SiMe 3) 3} 3] es un ejemplo, se conocen muy pocos complejos de 3 coordenadas.
Cuatro complejos de coordenadas
Cuando cuatro ligandos se coordinan con un metal, la coordinación tetraédrica (T d) es la geometría menos congestionada, aunque se conocen varios complejos planos cuadrados (D 4h). [CobR 4] 2-, Ni (CO) 4, [Cu (py) 4] +, [AUCl 4] - son todos ejemplos de complejos tetraédricos. Existen algunos ejemplos conocidos de complejos planos cuadrados con ligandos idénticos, como [Ni (CN) 4] 2-, o [PdCl 4] 2-. En el caso de los complejos de ligandos mixtos, se han reportado varios complejos planos cuadrados de iones d 8, Rh +, Ir +, Pd 2+, Pt 2 + y Au 3 +. Los ejemplos incluyen [rHCl (PMe 3) 3], [IrCl (CO) (PMe 3) 2], [NiCl 2 (pET 3) 2] y [PtcL 2 (NH 3) 2] (Et = C 2 H 5).
Los isómeros geométricos cis y trans son posibles para complejos con dos tipos diferentes de ligandos, y se observaron por primera vez cuando A. Werner sintetizó 4 coordenadas [pTCL 2 (NH 3) 2]. Como los complejos tetraédricos no dan isómeros geométricos, Werner pudo concluir que sus complejos de 4 coordenadas eran planos cuadrados. Recientemente se ha utilizado cis - [PtcL 2 (NH 3) 2] (Cisplatino) para el tratamiento de tumores y es de destacar que solo el isómero cis está activo.
Ejercicio\(\PageIndex{1}\)
Escriba el nombre formal de cis - [PtcL 2 (NH 3) 2].
- Contestar
-
cis-diamminodicloroplatino
Cinco complejos de coordenadas
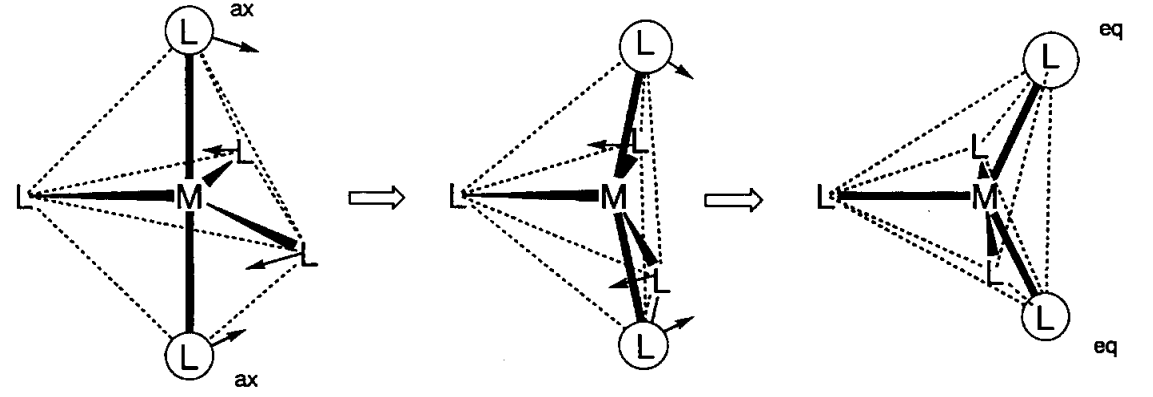
Trigonal bipiramidal (D 3h) Fe (CO) 5 o pirámide cuadrada (C 4v) VO (OH 2) 4 son ejemplos de complejos de 5 coordenadas. Anteriormente, los complejos de 5 coordenadas eran raros pero el número de nuevos complejos con esta coordinación va en aumento. La diferencia de energía entre los dos modos de coordinación no es grande y la transformación estructural ocurre fácilmente. Por ejemplo, la estructura molecular y el espectro infrarrojo del Fe (CO) 5 son consistentes con una estructura bipiramidal trigonal, pero el espectro de RMN de 13 C muestra solo una señal a la temperatura más baja posible, lo que indica que los ligandos carbonilo axial y ecuatorial son fluxionales en la escala de tiempo de RMN (10 -1 ~10 -9 s). La transformación estructural se realiza a través de una estructura piramidal cuadrada y el mecanismo es bien conocido como pseudorrotación de Berry.
Seis complejos de coordenadas
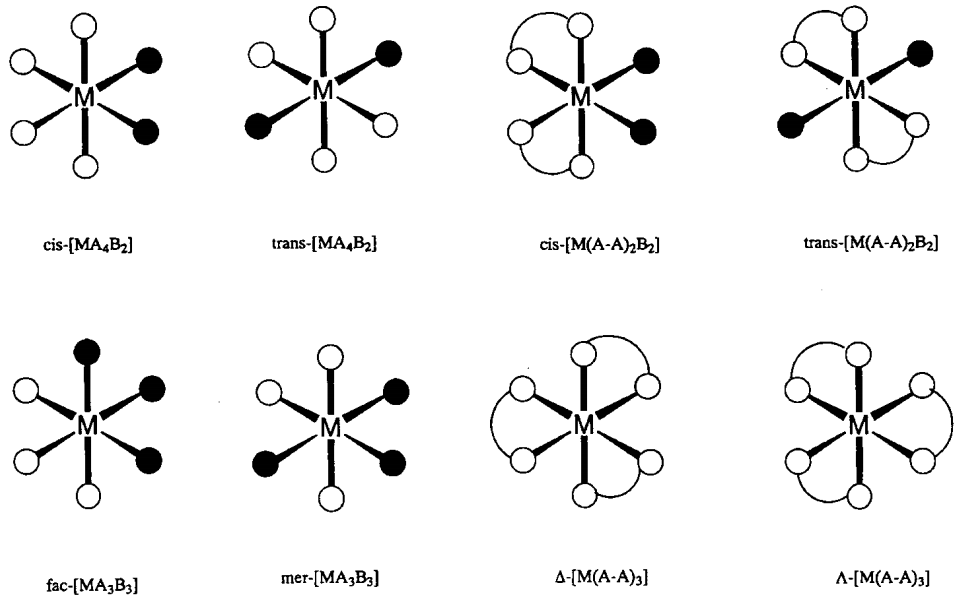
Cuando seis ligandos se coordinan con un metal central, la coordinación octaédrica (O h) es la geometría más estable y la mayoría de dichos complejos asumen esta estructura. En particular, hay una serie de complejos de Cr 3 + y Co 3 + que son inertes a las reacciones de intercambio de ligandos, representados por [Cr (NH 3) 6] 3+ o [Co (NH 3) 6] 3+. Han sido particularmente importantes en la historia del desarrollo de la química de coordinación. [Mo (CO) 6], [rHCl 6] 3-, etc. también son complejos octaédricos. En el caso de ligandos mixtos, cis - y trans - [MA 4 B 2] y mer - y fac - [MA 3 B 3] isómeros geométricos, y para ligandos quelatos,\(\Delta\) - [M (A-A) 3] y\(\Lambda\) - [M (A-A) 3] Los isómeros ópticos (Figura\(\PageIndex{3}\)) son posibles. La estructura octaédrica muestra distorsiones tetragonales (D 4h), rómbicas (D 2h) o trigonales (D 3h) causadas por efectos electrónicos o estéricos. La distorsión tetragonal de [Cu (NH 3) 6] 2+ por un factor electrónico es un ejemplo típico del efecto Jahn-Teller (consulte 6.2 (a)).
Seis átomos ligantes pueden asumir la coordinación del prisma trigonal. Aunque esta coordinación se observa en [Zr (CH 3) 6] 2- o [Re {S 2 C 2 (CF 3) 2} 3], pocos complejos metálicos con esta estructura de coordinación son conocidos porque la coordinación octaédrica es estéricamente menos tensa. A pesar de esto, desde hace tiempo se sabe que el modo de unión de los átomos de azufre alrededor de un metal es el prisma trigonal en MoS 2 y WS 2 en estado sólido.
Ejercicio\(\PageIndex{2}\)
Escribir la fórmula química del diamminetetra (isotiocianato) cromato de potasio (III).
- Contestar
-
K [Cr (NCS) 4 (NH 3) 2]
Complejos de coordenadas superiores
Los iones metálicos de la segunda y tercera serie de metales de transición a veces pueden enlazarse con más de siete átomos ligantes y ejemplos son [Mo (CN) 8] 3- o [ReH 9] 2-. En estos casos, los ligandos más pequeños son favorables para reducir la congestión estérica.

