6.5: Química Organometálica de Metales en Bloque d (Parte 2)
- Page ID
- 71754
Complejos de moléculas pequeñas
Dos o tres moléculas atómicas, como H 2, N 2, CO, NO, CO 2, NO 2, y H 2 O, SO 2, etc., se llaman moléculas pequeñas y la química de sus complejos es muy importante no solo para la química inorgánica básica sino también para la química de catalizadores, química bioinorgánica, química industrial y química ambiental. Los complejos de moléculas pequeñas distintas del agua y el monóxido de carbono se sintetizaron comparativamente recientemente. Los complejos de dihidrógeno en particular se reportaron solo en 1984.
Complejos de dihidrógeno
La reacción de adición oxidativa de una molécula de hidrógeno, H 2, es uno de los métodos utilizados para generar el enlace M-H de un complejo de hidruro. Esquemáticamente, la reacción anterior se escribe como
\[ \ce{M + H2 \rightarrow H-M-H}\]
pero se creía que debía existir un complejo intermedio que contuviera un dihidrógeno coordinado. El primer ejemplo de un complejo estable de este tipo, [W (CO) 3 (H 2) (P i Pr 3) 2], fue reportado por G. Kubas en 1984 (Figura\(\PageIndex{18}\)). Se comprobó por la difracción de neutrones que el\(\ce{H2}\) se coordina como\(\eta^{2}\) ligando manteniendo el enlace entre los átomos de hidrógeno con una distancia interatómica de 84 pm.
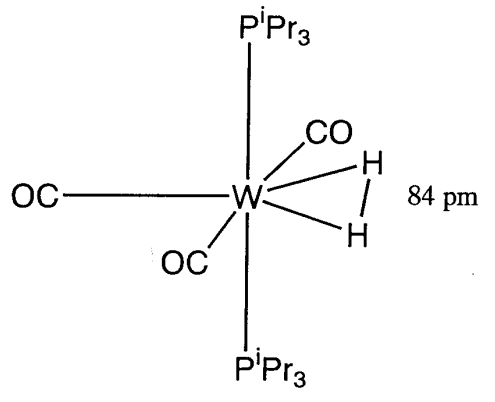
Una vez que se estableció este nuevo modo de coordinación, se han preparado nuevos complejos de dihidrógeno uno tras otro, y ahora se conocen docenas de complejos de dihidrógeno. Los complejos de dihidrógeno son interesantes no solo desde el punto de vista de la teoría de los enlaces, sino que también han contribuido en gran medida al estudio del proceso de activación de la molécula de hidrógeno.
Complejos de Dinitrogen
Dado que el N 2 es isoelectrónico con CO, la posible estabilidad de los complejos de dinitrógeno análogos en estructura a los complejos carbonílicos fue objeto de especulación durante muchos años. Estos compuestos generaron gran interés debido a los paralelismos con la interacción y activación de moléculas de nitrógeno sobre el catalizador de hierro utilizado en la síntesis de amoníaco y la enzima fijadora de nitrógeno nitrogenasa. Sin embargo, el primer complejo de dinitrógeno, [Ru (N 2) (NH 3) 5] X 2, fue preparado inesperadamente por A. D. Allen (1965) a partir de la reacción de un complejo de rutenio e hidrazina. Posteriormente, se descubrió por casualidad que el gas nitrógeno se coordina con el cobalto, y en 1967 se preparó [CoH (N 2) (PPh 3) 3] (Figura\(\PageIndex{19}\)). Muchos complejos de dinitrógeno se han preparado desde estos inicios tempranos.
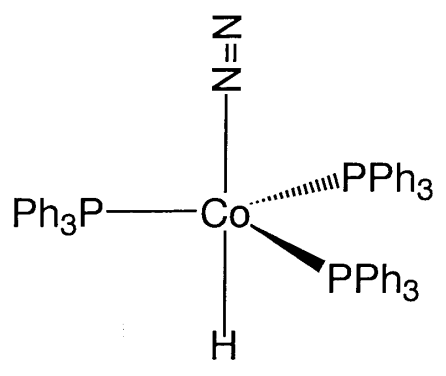
En la mayoría de los complejos de dinitrógeno, N 2 está coordinado con el metal por un átomo de nitrógeno. Es decir, el enlace M-N\(\equiv\) N es común y existen pocos complejos en los que ambos átomos de nitrógeno se unan al metal en el modo de\(\eta^{2}\) coordinación. En 1975, se descubrió que el dinitrógeno coordinado en un complejo de molibdeno estaba protonado por ácidos minerales para formar amoníaco, como se describe en la siguiente reacción. Los electrones requeridos para la reducción son suministrados por el molibdeno en un estado de baja oxidación como muestra esta reacción.
\[[Mo(PMe_{2}Ph)_{4}(N_{2})_{2}] + 6 H^{+} \rightarrow 2 NH_{3} + N_{2} + Mo(V) + \ldots\]
A pesar de los intentos de preparar compuestos de amoníaco y nitrógeno orgánico a partir de diversos complejos de dinitrógeno, aún no se ha descubierto ningún sistema de fijación de nitrógeno que sea igual a los sistemas biológicos. La síntesis de amoníaco es un proceso industrial de larga data, y sus parámetros han sido ampliamente estudiados y queda poco margen de mejora. Sin embargo, dilucidar el mecanismo de la reacción biológica de fijación de nitrógeno a temperaturas y presiones ordinarias sigue siendo uno de los principales desafíos de la química bio-inorgánica.
Complejos de dioxígeno
Aunque desde hace tiempo se ha reconocido que los complejos base de esquiff de cobalto absorben oxígeno, el descubrimiento de que el complejo de Vaska, [IrCl (CO) (PPh 3) 2], coordina el dioxígeno de manera reversible para formar [IrCl (CO) (PPh 3) 2 (O 2)] fue muy significativo. En este complejo, dos átomos de oxígeno se unen al iridio (de lado), y el dioxígeno tiene un carácter de peróxido (O 2 2-). Sin embargo, se conocen muchos complejos de superóxido (O 2 -) en los que solo un átomo de oxígeno está unido al metal. También hay complejos binucleares de dioxígeno en los que O 2 une dos metales. La relación entre la coordinación reversible del dioxígeno y su reactividad es importante en relación con el comportamiento del dioxígeno en los sistemas vivos (consultar la Sección 8.2 (a)).
e) Enganches metalmetálicos
El concepto de la formación de un enlace coordinado entre ligandos y un metal central propuesto por A. Werner fue la base para el desarrollo de la química de los complejos. El modo de unión y las estructuras de los complejos conocidos se han convertido en la guía de la preparación de un número mucho mayor de nuevos complejos. Para la mayoría de los complejos dinucleares o polinucleares que contienen dos o más metales en un complejo, fue suficiente tomar en consideración únicamente los enlaces entre el metal y los ligandos.
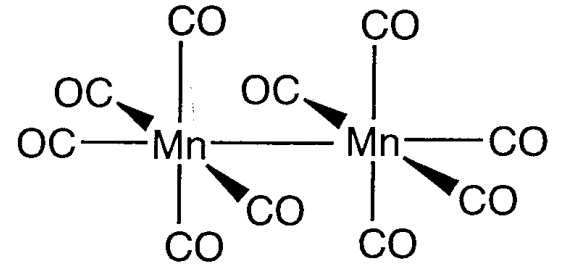
El concepto de enlaces directos entre metales nació de la necesidad de explicar la química estructural de los carbonilos metálicos dinucleares que tienen una estructura parcial con un número impar de electrones. Dos unidades Mn (CO) 5 en Mn 2 (CO) 10 están conectadas por un enlace directo Mn-Mn (Figura\(\PageIndex{20}\)) sin la ayuda de ligandos puente. De acuerdo con el análisis estructural de rayos X (1963), la distancia Mn-Mn de 292pm fue significativamente mayor que el doble de la del radio metálico de 127pm pero se contempló un enlace directo Mn-Mn en ausencia de un ligando carbonilo puente. El diamagnetismo de este compuesto indica una estructura con un número par de electrones (18 electrones) al compartir electrones entre dos restos d 7 -Mn (17 electrones), cada uno con cinco ligandos carbonilo.
De igual manera, se puede concluir que el Co 2 (CO) 8, con dos ligandos carbonílicos puente, debe tener un enlace Co-Co directo para ser compatible con su diamagnetismo.
El concepto del enlace sencillo entre los metales introducido para los compuestos carbonílicos metálicos dinucleares también es muy útil para explicar la estructura de los compuestos carbonílicos agrupados que contienen dos o más metales. El enlace metal-metal se ha establecido hoy como uno de los modos de unión comunes, junto con el enlace metal-ligando, presente en los complejos de coordinación. Sin embargo, no siempre está claro hasta qué punto existe la interacción entre metales en los complejos polinucleares que tienen ligandos puente. Como criterio, el orden de unión puede evaluarse a partir de la distancia de unión en metales estándar (por ejemplo, en metales a granel). Sin embargo, aunque la distancia de unión entre los metales analizados por rayos X sea suficientemente corta, esto no prueba la existencia de un enlace entre los metales a menos que también se cumplan las condiciones orbitales para dar cuenta de dichos enlaces.
Bonos múltiples M-M
Existen muchos compuestos dinucleares en los que los átomos metálicos están unidos por múltiples enlaces con órdenes de enlace de 2 a 4. El enlace cuadrupolo M-M se propuso primero para Re 2 Cl 8 2-, y este sigue siendo el ejemplo más conocido (Figura\(\PageIndex{21}\)). La distancia Re-Re en este compuesto es de solo 224pm, lo cual es inusualmente corto comparado con la distancia Re-Re de 275pm en metal renio. Otra característica inusual es que las unidades RecL 4 asumen una configuración eclipsada (los átomos de cloro se superponen a lo largo de la dirección del enlace Re-Re) aunque la configuración escalonada (en la que los átomos de cloro no se superponen a lo largo de la dirección del enlace Re-Re) debería ser más estable porque la distancia entre las unidades RecL 4 es muy corta, resultando en que las distancias entre los átomos de cloro sean muy cortas (valor experimental de 332pm). Como resultado, la interacción repulsiva entre los átomos de cloro se vuelve fuerte.
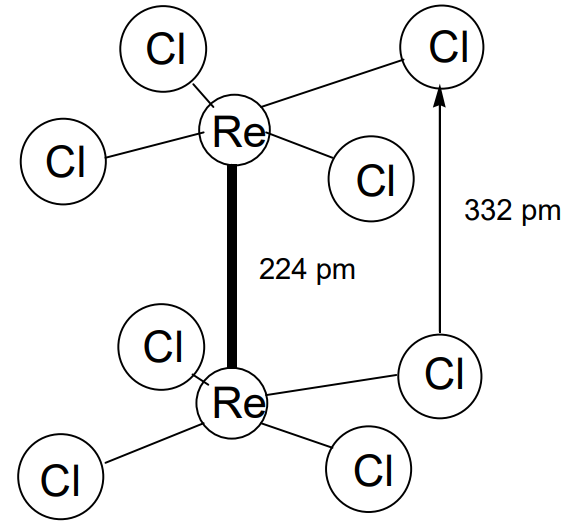
F. A. Cotton explicó esta anomalía al introducir el concepto del enlace delta entre metales en 1964. Es decir, si se toma el eje z en la dirección del enlace Re-Re, se forma un\(\sigma\) enlace entre los orbitales d z 2, los\(\pi\) enlaces entre los orbitales d yz y d xz y el\(\delta\) enlace entre los orbitales d xy entre los cinco orbitales d. x 2 -y 2 se utiliza principalmente para el enlace Re-Cl. El enlace delta está formado por un débil solapamiento lateral de orbitales d xy, cuando se ubican perpendiculares a la dirección del eje de enlace metal-metal y quedan eclipsados (Figura\(\PageIndex{22}\)). Por lo tanto, aunque el\(\delta\) enlace es relativamente débil entre las interacciones de enlace, es suficiente para mantener los ligandos de cloro en sus posiciones eclipsadas.
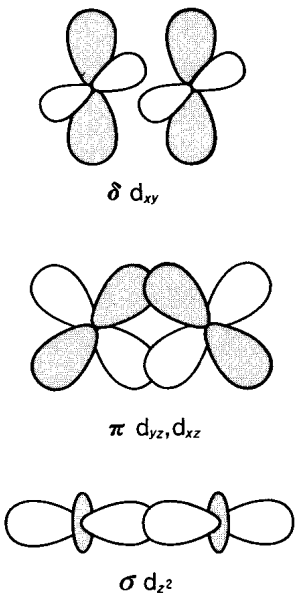
Los niveles de energía de los orbitales moleculares de\(\sigma\)\(\pi\), y los\(\delta\) enlaces disminuyen en este orden, y la diferencia de energía entre los orbitales delta ligantes y antiadherentes es pequeña. Por lo tanto, aunque se elimine (oxidación) un electrón de Re 2 Cl 8 2-, que tiene un enlace cuádruple, o se le agrega (reducción) un electrón, la distancia Re-Re difícilmente debería cambiar.
El compuesto Mo (II) [Mo 2 (CH 3 COO) 4] que es isoelectrónico con Re (III) tiene un enlace cuádruple Mo-Mo. [W 2 Cl 9] 3- y [W 2 (NMe 2) 6] son ejemplos de compuestos que tienen los triples enlaces metal-metal. Si bien la cuestión de si tales enlaces múltiples metal-metal realmente existen se ha argumentado muchas veces, el concepto ya se ha establecido y en la actualidad se conocen cientos de compuestos dinucleares con enlaces múltiples metal-metal. Las distancias metal-metal determinadas por el análisis de rayos X son más útiles para determinar si un enlace metal-metal es múltiple, pero como en el caso de los enlaces simples metal-metal, la distancia de unión por sí sola no puede ser el determinante absoluto y es necesario sacar conclusiones a partir de cálculos orbitales moleculares.
f) Compuestos de conglomerados metálicos
El análisis de las estructuras de complejos polinucleares recién preparados que contienen dos o más metales era, hasta hace poco, muy difícil. Sin embargo, con el avance del análisis estructural de rayos X monocristalinos, nuestra comprensión de la química de los complejos polinucleares progresa rápidamente. Los complejos metal-cluster son complejos polinucleares construidos por tres o más átomos de metal de transición con enlaces entre los metales coordinados por ligandos para formar marcos poliédricos, como un triángulo, un tetraedro regular, un octaedro regular y un icosaedro. Incluso si no hay un enlace fuerte entre los metales, siempre y cuando haya alguna interacción de unión, pueden incluirse como compuestos de conglomerados.
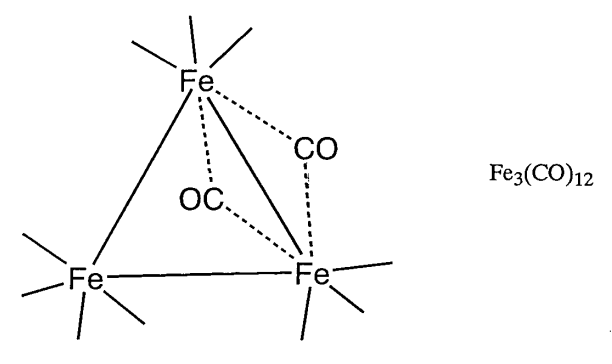
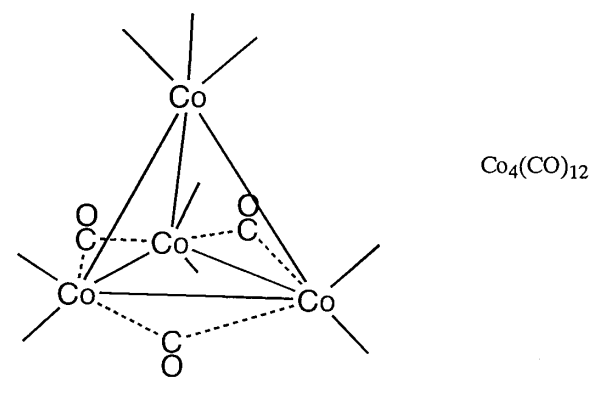
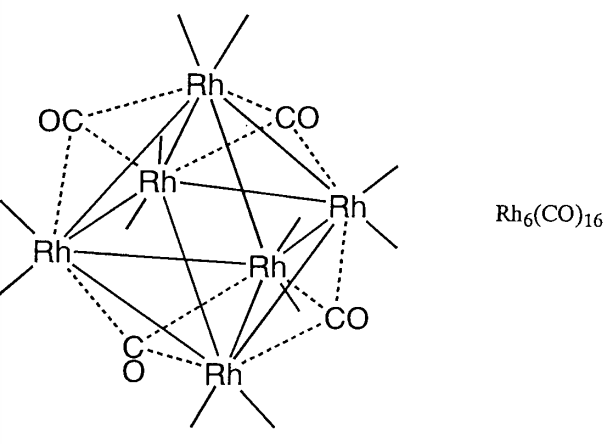
Los complejos de conglomerados metálicos pueden clasificarse ampliamente en grupos de acuerdo con el carácter general de los ligandos asociados. Son grupos metálicos de bajo estado de oxidación con ligandos\(\pi\) aceptores como carbonilos (CO), isonitrilos (RNC) o fosfinas (PR 3) y con ligandos\(\pi\) donantes como oxígeno (O), azufre (S), cloro (Cl) o alcóxidos (OR). Se han sintetizado muchos compuestos de conglomerados de carbonilo y de azufre. Los compuestos de conglomerados de carbonilo se obtienen calentando o irradiando compuestos de carbonilo mononucleares. Se han estudiado las propiedades químicas de compuestos de conglomerados como Fe 3 (CO) 12, Ru 3 (CO) 12, Os 3 (CO) 12, Co 4 (CO) 12, Ir 4 (CO) 12 o Rh 6 (CO) 16 en detalle (Figura\(\PageIndex{23}\)).
Dado que el Os 3 (CO) 12 forma muchos tipos de compuestos de conglomerados por pirólisis, se ha utilizado para estudiar las estructuras esqueléticas de los compuestos de cúmulos de osmio y su relación con los números de electrones esqueléticos. Un enlace M-M es descrito satisfactoriamente por el enlace 2 central de 2 electrones y la regla de 18 electrones también es aplicable a cada metal para pequeños conglomerados como un triángulo y un tetraedro regular. Cuando los cúmulos se hacen grandes, la regla de Wade que describe la relación entre las estructuras de los boranos y los números de electrones esqueléticos, o la regla Lauher que dibuja el número de los orbitales de unión metal-metal para diversas estructuras poliédricas metálicas a partir de los cálculos orbitales moleculares del rodio desnudo agrupaciones sin ligandos, son más aplicables. La relación entre el número de electrones de valencia de racimo y la forma poliédrica del cúmulo, como se muestra en la Tabla,\(\PageIndex{8}\) ha contribuido mucho a la teoría de la química de conglomerados.
| Marco de metal | Electrón de valencia de racimo | Ejemplo |
|---|---|---|
| Triángulo | 48 | Fe 3 (CO) 12 |
| Tetraedro | 60 | Co 4 (CO) 12 |
| Mariposa | 62 | [Fe 4 (CO) 12 C] 2- |
| Bipirámide trigonal | 72 | Os 5 (CO) 16 |
| Pirámide cuadrada | 74 | Fe 5 C (CO) 15 |
| Octaedro | 86 | Rh 6 (CO) 16 |
| Prisma Trigonal | 90 | [Rh 6 C (CO) 15] 2- |
Los aniones monovalentes como halógenos, alcóxidos, iones carboxilato y aniones divalentes como el oxígeno y el azufre estabilizan los marcos de conglomerados ayudando a los metales a asumir estados de oxidación adecuados para la formación de conglomerados y conectar fragmentos metálicos mediante puentes. Dado que los ligandos neutros tales como fosfinas, carbonilo o aminas también pueden coordinarse con metales, se han preparado una variedad de complejos de conglomerados.
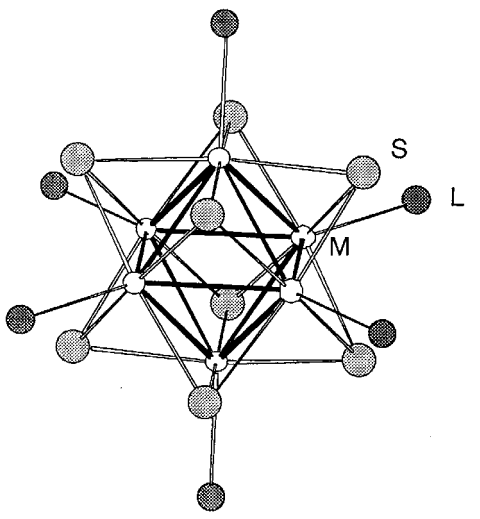
Los racimos de halogenuros de molibdeno, Mo 6 X 12, tungsteno, W 6 X 12, niobio, Nb 6 X 14, y tantalio, Ta 6 X 14, son compuestos de conglomerados sólidos que se conocen desde hace muchos años. Los marcos metálicos octaédricos se mostraron mediante análisis de estructura de rayos X hace más de 50 años. Los complejos de conglomerados moleculares se prepararon en la década de 1960 a partir de agregados de haluros en estado sólido mediante la reacción de ligandos como aminas y fosfinas, y estos compuestos de conglomerados generaron un interés considerable durante algún tiempo. Recientemente se han preparado nuevos compuestos de conglomerados de halogenuros con estructuras octaédricas y se están estudiando desde nuevas perspectivas. El complejo de conglomerados moleculares [Mo 6 S 8 L 6] (donde L es pET 3, py, etc.), que tiene marcos de Mo 6 similares a los de los compuestos superconductores de la fase Chevrel MxMo 6 S 6 y sus análogos de tungsteno y cromo se han preparado y las relaciones entre sus estructuras y propiedades físicas atraen gran interés (Figura\(\PageIndex{24}\)).
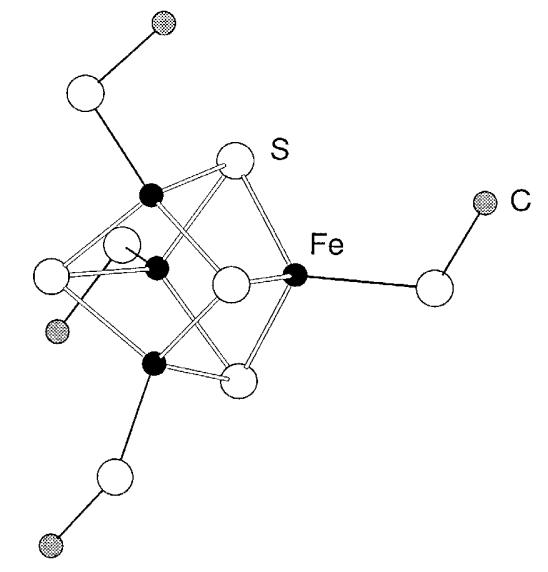
Como se describirá en el Capítulo sobre química bioinorgánica, los racimos como el Fe 4 S 4 están contenidos en la nitrogenasa, la enzima fijadora de nitrógeno, y también en el centro activo de las ferredoxinas, y desempeñan un papel importante en la activación de dinitrógeno o transferencia multielectrónica reacciones. Desde que R. H. Holm sintetizó el grupo Fe 4 S 4 (SR) 4 (Figura\(\PageIndex{25}\)), nuestra comprensión de la química del grupo hierro-azufre se ha desarrollado considerablemente.
Como las especies metálicas de los carbonilos de conglomerados metálicos se encuentran en estados de oxidación de valencia cercanos a cero, se esperaba que jugaran un papel en catálisis específica. Aunque se han intentado muchas síntesis orgánicas que utilizan compuestos de conglomerados metálicos como catalizadores y se descubrieron algunas reacciones interesantes, en la mayoría de los casos la los conglomerados se descompusieron durante las reacciones y resultaron ser falsos catalizadores de conglomerados. A pesar de ello, ha habido algunos ejemplos de reacciones que pasan por varias etapas elementales de reacción sobre el metal del cúmulo. Por lo tanto, es probable que en el futuro se desarrollen reacciones catalíticas que emplean la coordinación multicéntrica y las capacidades de transferencia multielectrónica de los compuestos de conglomerados.
Los conglomerados metálicos han sido útiles como modelos de las superficies de metales a granel, óxidos metálicos o sulfuros metálicos, y han sido útiles en el estudio de quimisorción y reacciones sucesivas sobre superficies sólidas. Los granos metálicos finos que mantienen los marcos básicos del conglomerado se depositan mediante la pirólisis de compuestos de conglomerados carbonílicos metálicos unidos químicamente a portadores como sílice y alúmina. Si se usa en catálisis sólida, se espera que sea posible el análisis de la reacción catalítica en una estructura de conglomerado metálico.

