6.6: Reacciones de Complejos
- Page ID
- 71746
Las reacciones de los complejos se clasifican en la reacción de sustitución de ligandos, la reacción de conversión de ligandos y la reacción redox del metal central. Las reacciones de sustitución y redox en particular han sido estudiadas en detalle.
(a) Reacción de sustitución de ligando
Reacciones de sustitución de ligandos de complejos
\[L_{n} MX + Y \rightarrow L_{n} MY + X\]
son muy importantes para la elaboración de diversos tipos de derivados. Las condiciones detalladas que cumplen los complejos y ligandos han sido estudiadas para comprender su estereoquímica y alcanzar tasas prácticas de reacciones de sustitución. Al igual que con otros tipos de reacciones químicas, requerimos una comprensión tanto del equilibrio como de las velocidades de reacción.
Constante de formación
La constante de equilibrio de una reacción de sustitución de ligando se denomina constante de formación o estabilidad. El concepto y el método de cálculo de constantes de formación sucesivas fueron propuestos por N. Bjerrum (1941). Las constantes de equilibrio para la sustitución de un ion M hidratado por otros ligandos L en una solución acuosa son
| $$M + L\ fila derecha ML\ qquad\ qquad K_ {1} =\ frac {[ML]} {[M] [L]} $$ |
| $$ML + L\ fila derecha ML_ {2}\ qquad\ qquad K_ {2} =\ frac {[ML_ {2}]} {[ML] [L]} $$ |
| $$ML_ {2} + L\ fila derecha ML_ {3}\ qquad\ qquad K_ {3} =\ frac {[ML_ {3}]} {[ML_ {2}] [L]} $$ |
| ... |
| $$ML_ {n-1} + L\ fila derecha ML_ {n}\ qquad\ qquad K_ {n} =\ frac {[ML_ {n}]} {[ML_ {n-1}] [L]} $$ |
y la constante de formación global\(beta_{n}\) es
\[\beta_{n} = \frac{[ML_{n}]}{[M][L]^{n}} = K_{1}K_{2}K_{3} \cdots K_{n}\]
La estabilidad termodinámica de un producto de sustitución se hace mayor a medida que aumenta la constante de formación.
Por otro lado, una comprensión del efecto del ligando saliente, X, y el ligando entrante, Y, sobre la tasa de sustitución y sobre las especies intermedias formadas son esenciales para dilucidar la química de reacción de los complejos metálicos. Es especialmente útil resumir la estructura electrónica de los metales centrales, la estereoquímica de los complejos y la correlación entre los parámetros que representan sus propiedades estéricas y la velocidad de reacción. Generalmente, los mecanismos de reacción pueden clasificarse en mecanismos asociativos, de intercambio y disociativos de acuerdo con las diferencias en el estado intermedio (Figura\(\PageIndex{26}\)).
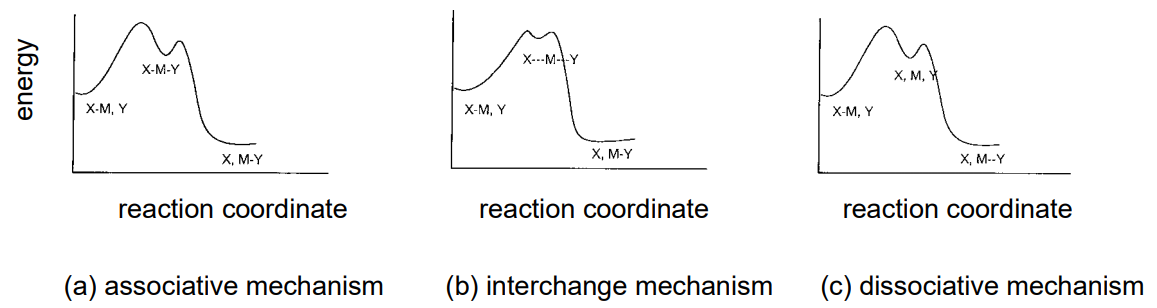
Mecanismo asociativo
Si la tasa de sustitución de un ligando, la sustitución de un complejo depende del ligando entrante, Y, coordinándose con el metal central y es insensible al ligando de salida, X, se presume que toma el mecanismo asociativo que aumenta el número de coordinación. Tal reacción de sustitución se observa a menudo en complejos tetra-coordinados planos de Pt (II), y las especies intermedias son complejos triangulares bipiramidales pentacoordinados. La reacción es de primer orden tanto con respecto al complejo tetra-coordinado como a Y, y es de segundo orden en su conjunto. Dado que se acompaña de una reducción de especies moleculares en la etapa intermedia, las mediciones termodinámicas de la reacción indican que la entropía de activación,\(Delta\) S, es negativa. Las especies intermedias en el caso del mecanismo asociativo en complejos hexa-coordinados son complejos hepta-coordinados.
Mecanismo de intercambio
Cuando la vida de un estado intermedio es muy corta, la reacción procede por el mecanismo de intercambio, ya que se considera que la coordinación de Y y la eliminación de X ocurren simultáneamente.
Mecanismo disociativo
Una reacción de sustitución que es altamente sensible a la identidad del ligando de salida, X, y prácticamente insensible a la identidad del ligando entrante, Y, asume el mecanismo disociativo en el que el número de coordinación disminuye en el estado intermedio. Esto se observa frecuentemente en complejos hexa-coordinados octaédricos, y los estados intermedios son complejos pentacoordinados que se forman por la eliminación de X. Como la eliminación va acompañada de un aumento de especies moleculares en la etapa intermedia, la entropía de activación,\(\Delta\) S, se vuelve positiva.
Ejercicio\(\PageIndex{6}\)
El orden de la tasa de sustitución de ligandos de los complejos de Pt (II) es H 2 O < Cl - < I - < PR 3 < CN - para la entrada de ligandos. ¿Qué mecanismo, asociativo o disociativo, toman las sustituciones?
- Contestar
-
Al ser dependientes de los ligandos que entran, el mecanismo asociativo es más probable.
Efecto Trans
En los complejos tetra-coordinados cuadrado-planares típicamente de Pt (II), el ligando trans al ligando de salida X gobierna la tasa de sustitución. A esto se le llama el efecto trans. La tasa de sustitución aumenta a medida que la capacidad del donante σ o aceptor π del ligando trans se hace mayor en el orden de NH 3 < Cl - < Br - < I - < NCS - < PR 3 < CN - < CO. También se puede observar un efecto análogo en los complejos hexacoordinados octaédricos, aunque el efecto suele ser relativamente pequeño.
El tipo de cambio H 2 O en iones aqua
Inerte, intermedio y lábil son la clasificación del tipo de cambio propuesto por H. Taube (1952). La tasa de intercambio de iones aqua (iones coordinados por moléculas de agua) del grupo principal y los metales de transición difieren mucho dependiendo de la identidad de las especies metálicas. Dado que la tasa de intercambio de ligandos de agua está bien correlacionada con las tasas de cambio de otros ligandos, es útil para la comparación general de las tasas de cambio en los complejos de diferentes iones metálicos. Para los metales alcalinos y alcalinotérreos, los tipos de cambio son muy altos (10 5 - 10 9 s -1), y los complejos de estos metales se clasifican como lábiles. Como el mecanismo disociativo se encuentra generalmente en estos casos, los iones con menor ionicidad y de mayor tamaño atraen menos ligandos de agua y sus tasas de cambio se vuelven más altas. En el Grupo 12 iones metálicos Zn 2 +, Cd 2+, Hg 2 +, Grupo 13 iones metálicos Al 3 +, Ga 3+, In 3 + y Grupo 3 iones metálicos Sc 3 +, Y 3+, agua rápida el intercambio de ligandos tiene lugar por un mecanismo disociativo.
Por otro lado, las tasas de cambio de los iones M (II) en los iones de metal de transición del bloque d son medias (10 - 10 4 s -1), y las de los iones M (III) son aún menores. Las tasas de d 3 Cr 3 + y d 6 Co 3+ son notablemente lentas (10 -1 - 10 -9 s -1), y sus complejos se denominan inertes. Se ha estudiado mucho las reacciones de intercambio de ligandos. Las tasas de cambio son menores cuanto mayor es la energía de estabilización del campo del ligando. Por lo tanto, las tasas de intercambio de ligando de los complejos 4d y 5d de metal de transición son generalmente lentas.
Experimentos con tubos de ensayo
Las reacciones químicas o biológicas fáciles que se realizan en tubos de ensayo a veces se denominan experimentos con tubos de ensayo. Las soluciones en tubos de ensayo se mezclan a temperatura ambiente en aire y la mezcla se agita para observar un cambio de color o formación de precipitados y se especula los resultados de las reacciones. Los profesores universitarios intentan ocasionalmente este tipo de experimentos. Aunque son fáciles, estos experimentos simples muestran solo los efectos de la absorción y solubilidad de la luz visible. No obstante, dado que incluso grandes descubrimientos pueden nacer de tales experimentos, no se deben desestimarlos.
H. Taube escribió que encontró un indicio del mecanismo de transferencia de electrones de la esfera interna de los experimentos con tubos de ensayo. Mezcló Cr 2 + (aq) e I 2 en un tubo de ensayo con el fin de aclarar la oxidación de Cr 2 + (aq) y observó el cambio de color a la característica de [Cr (H 2 O) 6] 3+ vía verde. El color verde se debe a [(H 2 O) 5 CRi] 2+ que es inestable y cambia a [Cr (H 2 O) 6] 3+ + I -. Supuso que esto se debió a la formación de un enlace Cr-I antes de que el Cr (II) fuera oxidado por I 2. Posteriormente, realizó otro experimento con tubo de ensayo utilizando [(NH 3) 5 CoCl] 2+ como oxidante y encontró que Cr 2 + (aq) se convirtió en [Cr (H 2 O) 6] 3+ vía verde [(H 2 O) 5 CrCl] 2+. Esta reacción estableció el mecanismo de transferencia de electrones de la esfera interna en el que se forma un puente Co-Cl-Cr entre Co 3 + y Cr 2 + y condujo al Premio Nobel en un año posterior.
b) Reacciones redox
El número de oxidación del metal central en un compuesto de metal de transición puede variar en unos pocos pasos de bajo a alto. Es decir, el estado de oxidación de un compuesto es cambiable por reacciones redox. Como consecuencia de esto, la distancia de unión y el ángulo de unión entre el metal y los elementos de coordinación, o entre los metales, cambian, y a veces toda la estructura de un complejo puede distorsionarse notablemente o el compuesto puede incluso descomponerse.
Las reacciones de un compuesto metálico con diversos agentes reductores u oxidantes también son muy importantes desde el punto de vista de la química sintética. Especialmente, las reacciones de reducción se utilizan en la preparación de compuestos organometálicos, tales como carbonilos metálicos o compuestos de conglomerados.
En tanto, se ha desarrollado el estudio de la transferencia de electrones entre complejos, especialmente las reacciones redox de los complejos de metales de transición. Taube ganó el Premio Nobel (1983) por el estudio de las reacciones de transferencia de electrones en complejos de metales de transición, clasificando tales reacciones en dos mecanismos. El mecanismo de transferencia de electrones en el que un ligando puente se comparte entre dos metales se denomina mecanismo de esfera interna, y el que implica una transferencia directa de electrones entre dos metales sin un ligando puente se llama mecanismo de esfera exterior.
Mecanismo de esfera interna
Cuando [CoCl (NH 3) 5] 2+ se reduce en [Cr (OH 2) 6] 2+, se forma un complejo intermedio, [(NH 3) 5 Co-Cl-Cr (OH 2) 5] 4+, en el que el átomo de cloro forma un puente entre cobalto y cromo. Como resultado de una transferencia de electrones del cromo al cobalto a través del cloro, [Co (NH 3) 5 Cl] +, en el que el cobalto se reduce de un estado de oxidación trivalente a uno divalente y [Cr (OH 2) 6] 3+, en el que el cromo se oxida a partir de un divalente a un estado de oxidación trivalente, se forman. Este tipo de reacción es una reacción redox a través del mecanismo de la esfera interna. Los aniones distintos de los halógenos adecuados para dicha formación de puentes son SCN -, N 3 -, CN -, etc.
Mecanismo de esfera externa
Cuando [Fe (phen) 3] 3+ (phen es ortofenantrolina) se reduce en [Fe (CN) 6] 4-, no se forma ningún puente ligando entre los metales y un electrón se mueve del HOMO de Fe (II) al LUMO de Fe (III) en un contacto muy corto y directo entre los dos complejos. Como resultado de la transferencia de electrones, [Fe (phen) 3] 2+ y [Fe (CN) 6] 3- forman. Este tipo de reacción es una reacción redox a través del mecanismo de esfera exterior, y es característica de un sistema complejo que tiene una tasa de sustitución de ligando muy lenta en comparación con la velocidad de transferencia de electrones, especialmente en sistemas que tienen los mismos ligandos pero diferentes números de oxidación, por ejemplo, [Fe (CN) 6] 3- - [Fe (CN) 6] 4- tiene una alta tasa de transferencia de electrones. R. A. Marcus ganó el Premio Nobel (1992) por su estudio de este mecanismo de transferencia de electrones de esfera externa.
problemas
6.1
¿Qué cavidad, ya sea la octaédrica o la tetraédrica, en una matriz de átomos de oxígeno tienden a ocupar los iones Fe 2 + en el óxido de hierro Fe 3 O 4 que contiene tanto iones Fe 2 + como Fe 3 +?
6.2
Describir un método para preparar trans - [PtcL (Et) (pET 3) 2].
6.3
Proponer complejos metálicos mononucleares y dinucleares que contengan ligandos ciclopentadienilo y carbonilo que satisfagan la regla de 18 electrones.
6.4
Diseñar un método de síntesis selectiva de cis - [PtcL 2 (NH 3) 2] y trans - [PtcL 2 (NH 3) 2] utilizando el efecto trans.
6.5
¿Cómo se puede probar que la reacción de reducción de [CoCl (NH 3) 5] 2+ por [Cr (OH2) 6] 2+ procede por el mecanismo de transferencia de electrones de la esfera interna?

