2.1: Desarrollo histórico de la teoría atómica
- Page ID
- 81209
La siguiente página es una breve descripción de la historia de la teoría atómica. Contiene muchos medios de video.
Las páginas alternativas sobre la historia de la teoría atómica son:
- Una descripción más detallada que incluye problemas de práctica está aquí (haga clic).
- Otra breve descripción está aquí (haga clic).
Habilidades para Desarrollar
Al final de esta sección, podrás:
- Exponer los postulados de la teoría atómica de Dalton
- Utilizar postulados de la teoría atómica de Dalton para explicar las leyes de proporciones definidas y múltiples
- Esbozar hitos en el desarrollo de la teoría atómica moderna
- Resumir e interpretar los resultados de los experimentos de Thomson, Millikan y Rutherford
Un video de introducción a la teoría atómica a través del siglo XIX desde el curso intensivo de química
Video\(\PageIndex{1}\): El descubrimiento de Lavoisier de La Ley de Conservación de la Materia condujo a las Leyes de Proporciones Definidas y Múltiples y, finalmente, a la Teoría Atómica de Dalton.
Teoría atómica a través del siglo XIX
La discusión más temprana registrada sobre la estructura básica de la materia proviene de los filósofos griegos antiguos, los científicos de su época. En el siglo V a.C., Leucipo y Demócrito argumentaron que toda la materia estaba compuesta por partículas pequeñas y finitas que llamaban atomos, término derivado de la palabra griega para “indivisible”. Pensaban en los átomos como partículas móviles que diferían en forma y tamaño, y que podían unirse. Posteriormente, Aristóteles y otros llegaron a la conclusión de que la materia consistía en varias combinaciones de los cuatro “elementos” —fuego, tierra, aire y agua— y podía dividirse infinitamente. Curiosamente, estos filósofos pensaron en los átomos y los “elementos” como conceptos filosóficos, pero aparentemente nunca consideraron realizar experimentos para poner a prueba sus ideas.
La visión aristotélica de la composición de la materia dominó durante más de dos mil años, hasta que el profesor de inglés John Dalton ayudó a revolucionar la química con su hipótesis de que el comportamiento de la materia podría explicarse utilizando una teoría atómica. Publicado por primera vez en 1807, muchas de las hipótesis de Dalton sobre las características microscópicas de la materia siguen siendo válidas en la teoría atómica moderna. Aquí están los postulados de la teoría atómica de Dalton.
- La materia está compuesta por partículas sumamente pequeñas llamadas átomos. Un átomo es la unidad más pequeña de un elemento que puede participar en un cambio químico.
- Un elemento consiste en un solo tipo de átomo, que tiene una masa que es característica del elemento y es la misma para todos los átomos de ese elemento (Figura\(\PageIndex{1}\)). Una muestra macroscópica de un elemento contiene un número increíblemente grande de átomos, todos los cuales tienen propiedades químicas idénticas.
- Los átomos de un elemento difieren en propiedades de los átomos de todos los demás elementos.
- Un compuesto consiste en átomos de dos o más elementos combinados en una pequeña relación de número entero. En un compuesto dado, los números de átomos de cada uno de sus elementos están siempre presentes en la misma proporción (Figura\(\PageIndex{2}\)).
- Los átomos no se crean ni se destruyen durante un cambio químico, sino que se reordenan para producir sustancias que son diferentes a las presentes antes del cambio (Figura\(\PageIndex{3}\)).

Figura\(\PageIndex{1}\): Un penique de cobre anterior a 1982 (izquierda) contiene aproximadamente 3\(\times\) 10 22 átomos de cobre (varias docenas se representan como esferas marrones a la derecha), cada una de las cuales tiene las mismas propiedades químicas. (crédito: modificación de obra por “slgckgc” /Flickr)

Figura\(\PageIndex{2}\): El óxido de cobre (II), un compuesto negro pulverulento, resulta de la combinación de dos tipos de átomos, cobre (esferas marrones) y oxígeno (esferas rojas), en una proporción 1:1. (crédito: modificación de obra por “ChemicalInterest” /Wikimedia Commons)

Figura\(\PageIndex{3}\): Cuando reaccionan los elementos cobre (un sólido brillante, rojo-marrón, mostrado aquí como esferas marrones) y oxígeno (un gas claro e incoloro, mostrado aquí como esferas rojas), sus átomos se reordenan para formar un compuesto que contiene cobre y oxígeno (un sólido negro pulverulento). (crédito cobre: modificación de obra por http://images-of-elements.com/copper.php).
La teoría atómica de Dalton proporciona una explicación microscópica de las muchas propiedades macroscópicas de la materia que has aprendido. Por ejemplo, si un elemento como el cobre consiste en un solo tipo de átomo, entonces no se puede descomponer en sustancias más simples, es decir, en sustancias compuestas por menos tipos de átomos. Y si los átomos no son creados ni destruidos durante un cambio químico, entonces la masa total de materia presente cuando la materia cambia de un tipo a otro permanecerá constante (la ley de conservación de la materia (o masa)).
¿Quieres conocer más sobre la Ley de Conservación de la Misa?
Video\(\PageIndex{2}\): “Estamos hechos de cosas de estrellas” - Carl Sagan.
Ejemplo\(\PageIndex{1}\): Prueba de la Teoría Atómica de Dalton
En el siguiente dibujo, las esferas verdes representan átomos de cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, forman parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? Si es así, ¿cuál?
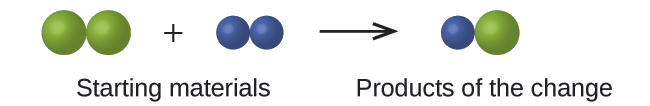
Solución
Los materiales de partida consisten en dos esferas verdes y dos esferas moradas. Los productos consisten en una sola esfera verde y una esfera púrpura. Esto viola el postulado de Dalton de que los átomos no se crean ni se destruyen durante un cambio químico, sino que simplemente se redistribuyen. (En este caso, los átomos parecen haber sido destruidos).
Ejercicio\(\PageIndex{1}\)
En el siguiente dibujo, las esferas verdes representan átomos de cierto elemento. Las esferas moradas representan átomos de otro elemento. Si las esferas se tocan, forman parte de una sola unidad de un compuesto. ¿El siguiente cambio químico representado por estos símbolos viola alguna de las ideas de la teoría atómica de Dalton? Si es así, cuál

- Contestar
-
Los materiales de partida constan de cuatro esferas verdes y dos esferas moradas. Los productos constan de cuatro esferas verdes y dos esferas moradas. Esto no viola ninguno de los postulados de Dalton: Los átomos no se crean ni se destruyen, sino que se redistribuyen en pequeñas proporciones de números enteros.
Dalton conocía los experimentos del químico francés Joseph Proust, quien demostró que todas las muestras de un compuesto puro contienen los mismos elementos en la misma proporción en masa. A esta afirmación se le conoce como la ley de proporciones definidas o la ley de la composición constante. La sugerencia de que los números de átomos de los elementos en un compuesto dado siempre existen en la misma proporción es consistente con estas observaciones. Por ejemplo, cuando se analizan diferentes muestras de isooctano (un componente de la gasolina y uno de los estándares utilizados en el sistema de clasificación de octano), se encuentra que tienen una relación másica carbono-hidrógeno de 5. 33:1, como se muestra en la Tabla\(\PageIndex{1}\).
| Muestra | Carbono | Hidrógeno | Relación Masa |
|---|---|---|---|
| A | 14.82 g | 2.78 g | \(\mathrm{\dfrac{14.82\: g\: carbon}{2.78\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| B | 22.33 g | 4.19 g | \(\mathrm{\dfrac{22.33\: g\: carbon}{4.19\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
| C | 19.40 g | 3.64 g | \(\mathrm{\dfrac{19.40\: g\: carbon}{3.63\: g\: hydrogen}=\dfrac{5.33\: g\: carbon}{1.00\: g\: hydrogen}}\) |
Cabe señalar que aunque todas las muestras de un compuesto en particular tienen la misma relación de masa, lo contrario no es cierto en general. Es decir, las muestras que tienen la misma relación de masa no son necesariamente la misma sustancia. Por ejemplo, existen muchos compuestos distintos al isooctano que también tienen una relación másica carbono-hidrógeno de 5. 33:1 .00.
Dalton también utilizó datos de Proust, así como resultados de sus propios experimentos, para formular otra ley interesante. La ley de proporciones múltiples establece que cuando dos elementos reaccionan para formar más de un compuesto, una masa fija de un elemento reaccionará con las masas del otro elemento en una proporción de números pequeños, enteros. Por ejemplo, el cobre y el cloro pueden formar un sólido cristalino verde con una relación en masa de 0.558 g de cloro a 1 g de cobre, así como un sólido cristalino marrón con una relación en masa de 1.116 g de cloro a 1 g de cobre. Estas proporciones por sí mismas pueden no parecer particularmente interesantes o informativas; sin embargo, si tomamos una relación de estas proporciones, obtenemos un resultado útil y posiblemente sorprendente: una pequeña relación de números enteros.
\[\mathrm{\dfrac{\dfrac{1.116\: g\: Cl}{1\: g\: Cu}}{\dfrac{0.558\: g\: Cl}{1\: g\: Cu}}=\dfrac{2}{1}}\]
Esta relación 2 a 1 significa que el compuesto marrón tiene el doble de la cantidad de cloro por cantidad de cobre que el compuesto verde.
Esto puede explicarse por la teoría atómica si la relación cobre-cloro en el compuesto marrón es de 1 átomo de cobre a 2 átomos de cloro, y la relación en el compuesto verde es de 1 átomo de cobre por 1 átomo de cloro. La relación de átomos de cloro (y por lo tanto la relación de sus masas) es, por lo tanto, de 2 a 1 (Figura\(\PageIndex{4}\)).
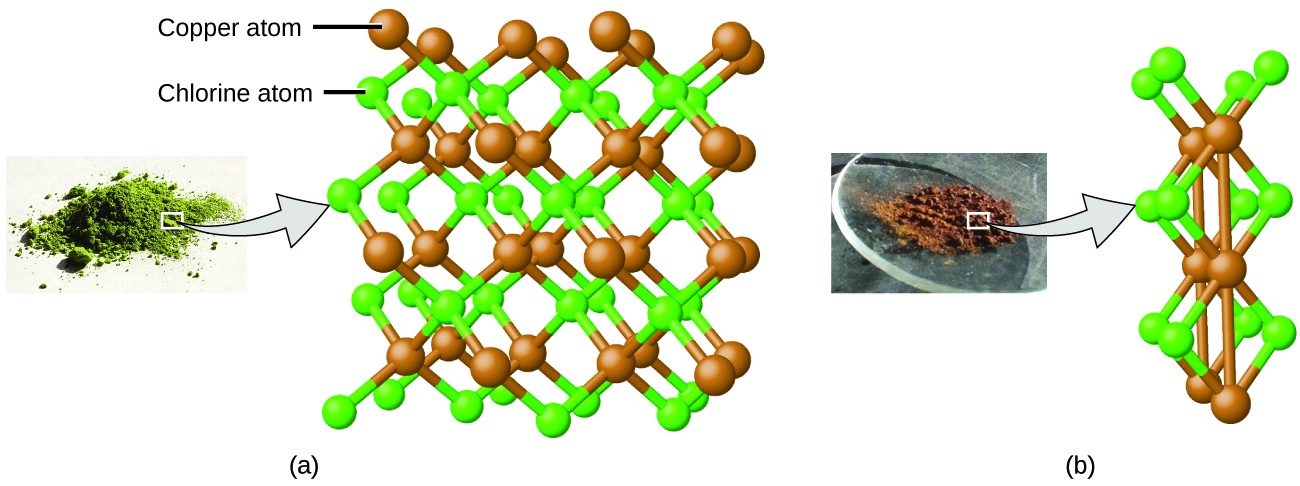
Figura\(\PageIndex{4}\): Comparado con el compuesto de cobre y cloro en (a), donde el cobre está representado por esferas marrones y el cloro por esferas verdes, el compuesto de cobre y cloro en (b) tiene el doble de átomos de cloro por átomo de cobre. (crédito a: modificación de obra por “Benjah-BMM27”/Wikimedia Commons; crédito b: modificación de obra por “Walkerma” /Wikimedia Commons)
Ejemplo\(\PageIndex{2}\): L aws de proporciones definidas y múltiples
Se analiza una muestra del compuesto A (un gas transparente e incoloro) y se encuentra que contiene 4.27 g de carbono y 5.69 g de oxígeno. Se analiza una muestra del compuesto B (también un gas transparente e incoloro) y se encuentra que contiene 5.19 g de carbono y 13.84 g de oxígeno. ¿Son estos datos un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna de las dos? ¿Qué le dicen estos datos sobre las sustancias A y B?
Solución
En el compuesto A, la relación másica de carbono a oxígeno es:
\[\mathrm{\dfrac{1.33\: g\: O}{1\: g\: C}} \nonumber\]
En el compuesto B, la relación másica de carbono a oxígeno es:
\[\mathrm{\dfrac{2.67\: g\: O}{1\: g\: C}} \nonumber\]
La relación de estas proporciones es:
\[\mathrm{\dfrac{\dfrac{1.33\: g\: O}{1\: g\: C}}{\dfrac{2.67\: g\: O}{1\: g\: C}}=\dfrac{1}{2}} \nonumber\]
Esto apoya la ley de múltiples proporciones. Esto significa que A y B son compuestos diferentes, teniendo A la mitad de carbono por cantidad de oxígeno (o el doble de oxígeno por cantidad de carbono) que B. Un posible par de compuestos que se ajustarían a esta relación sería A = CO 2 y B = CO.
Ejercicio\(\PageIndex{2}\)
Se analiza una muestra del compuesto X (un líquido combustible transparente, incoloro, con un olor notable) y se encuentra que contiene 14.13 g de carbono y 2.96 g de hidrógeno. Se analiza una muestra del compuesto Y (un líquido combustible transparente, incoloro, con un olor notable que es ligeramente diferente del olor de X) y se encuentra que contiene 19.91 g de carbono y 3.34 g de hidrógeno. ¿Son estos datos un ejemplo de la ley de proporciones definidas, la ley de proporciones múltiples, o ninguna de las dos? ¿Qué le dicen estos datos sobre las sustancias X e Y?
- Contestar
-
En el compuesto X, la relación másica de carbono a hidrógeno es\(\mathrm{\dfrac{14.13\: g\: C}{2.96\: g\: H}}\).
En el compuesto Y, la relación másica de carbono a oxígeno es\(\mathrm{\dfrac{19.91\: g\: C}{3.34\: g\: H}}\).
La relación de estas proporciones es
\[\mathrm{\dfrac{\dfrac{14.13\: g\: C}{2.96\: g\: H}}{\dfrac{19.91\: g\: C}{3.34\: g\: H}}=\dfrac{4.77\: g\: C/g\: H}{5.96\: g\: C/g\: H}=0.800=\dfrac{4}{5}}. \nonumber\]
Esta pequeña proporción de números enteros apoya la ley de proporciones múltiples. Esto significa que X e Y son compuestos diferentes.
En los dos siglos transcurridos desde que Dalton desarrolló sus ideas, los científicos han logrado avances significativos en la profundización de nuestra comprensión de la teoría atómica. Gran parte de esto provino de los resultados de varios experimentos seminales que revelaron los detalles de la estructura interna de los átomos. Aquí, discutiremos algunos de esos desarrollos clave, con énfasis en la aplicación del método científico, así como entendiendo cómo se analizó la evidencia experimental. Si bien las personas históricas y las fechas detrás de estos experimentos pueden ser bastante interesantes, lo más importante es comprender los conceptos resultantes de su trabajo.
Teoría atómica después del siglo XIX
Si la materia estuviera compuesta por átomos, ¿de qué estaban compuestos los átomos? ¿Eran las partículas más pequeñas, o había algo más pequeño? A finales del siglo XIX, varios científicos interesados en preguntas como estas investigaron las descargas eléctricas que podrían producirse en gases de baja presión, con el descubrimiento más significativo realizado por el físico inglés J. J. Thomson usando un tubo de rayos catódicos. Este aparato consistía en un tubo de vidrio sellado del que se había retirado casi todo el aire; el tubo contenía dos electrodos metálicos. Cuando se aplicó alto voltaje a través de los electrodos, apareció entre ellos un haz visible llamado rayo catódico. Este haz se desvió hacia la carga positiva y lejos de la carga negativa, y se produjo de la misma manera con propiedades idénticas cuando se utilizaron diferentes metales para los electrodos. En experimentos similares, el rayo fue desviado simultáneamente por un campo magnético aplicado, y las mediciones de la extensión de la deflexión y la intensidad del campo magnético permitieron a Thomson calcular la relación carga-masa de las partículas de rayos catódicos. Los resultados de estas mediciones indicaron que estas partículas eran mucho más ligeras que los átomos (Figura\(\PageIndex{1}\)).
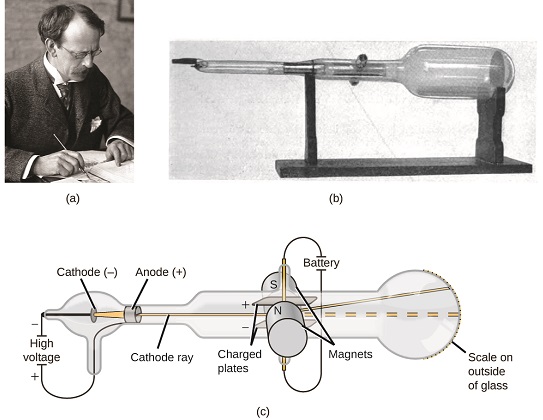
Figura\(\PageIndex{5}\): (a) J. J. Thomson produjo un haz visible en un tubo de rayos catódicos. (b) Se trata de un tubo de rayos catódicos temprano, inventado en 1897 por Ferdinand Braun. (c) En el rayo catódico, el haz (mostrado en amarillo) proviene del cátodo y se acelera más allá del ánodo hacia una escala fluorescente al final del tubo. Las deflexiones simultáneas por campos eléctricos y magnéticos aplicados permitieron a Thomson calcular la relación masa/carga de las partículas que componen el rayo catódico. (crédito a: modificación de obra de la Fundación Nobel; crédito b: modificación de obra de Eugen Nesper; crédito c: modificación de obra por “Kurzon” /Wikimedia Commons).
Con base en sus observaciones, aquí está lo que Thomson propuso y por qué: Las partículas son atraídas por cargas positivas (+) y repelidas por cargas negativas (−), por lo que deben estar cargadas negativamente (como las cargas repelen y a diferencia de las cargas atraen); son menos masivas que los átomos e indistinguibles, independientemente de la material fuente, por lo que deben ser constituyentes fundamentales, subatómicos de todos los átomos. Aunque polémica en su momento, la idea de Thomson fue poco a poco aceptada, y su partícula de rayos catódicos es lo que ahora llamamos un electrón, una partícula subatómica cargada negativamente con una masa más de mil veces menor que la de un átomo. El término “electrón” fue acuñado en 1891 por el físico irlandés George Stoney, a partir de “electr ic i on”.
En 1909, más información sobre el electrón fue descubierta por el físico estadounidense Robert A. Millikan a través de sus experimentos de “gotas de petróleo”. Millikan creó gotitas microscópicas de aceite, que podrían cargarse eléctricamente por fricción a medida que se formaban o mediante el uso de rayos X. Estas gotitas cayeron inicialmente debido a la gravedad, pero su avance hacia abajo podría ser ralentizado o incluso revertido por un campo eléctrico más bajo en el aparato. Al ajustar la intensidad del campo eléctrico y realizar mediciones cuidadosas y cálculos apropiados, Millikan pudo determinar la carga en gotas individuales (Figura\(\PageIndex{2}\)).
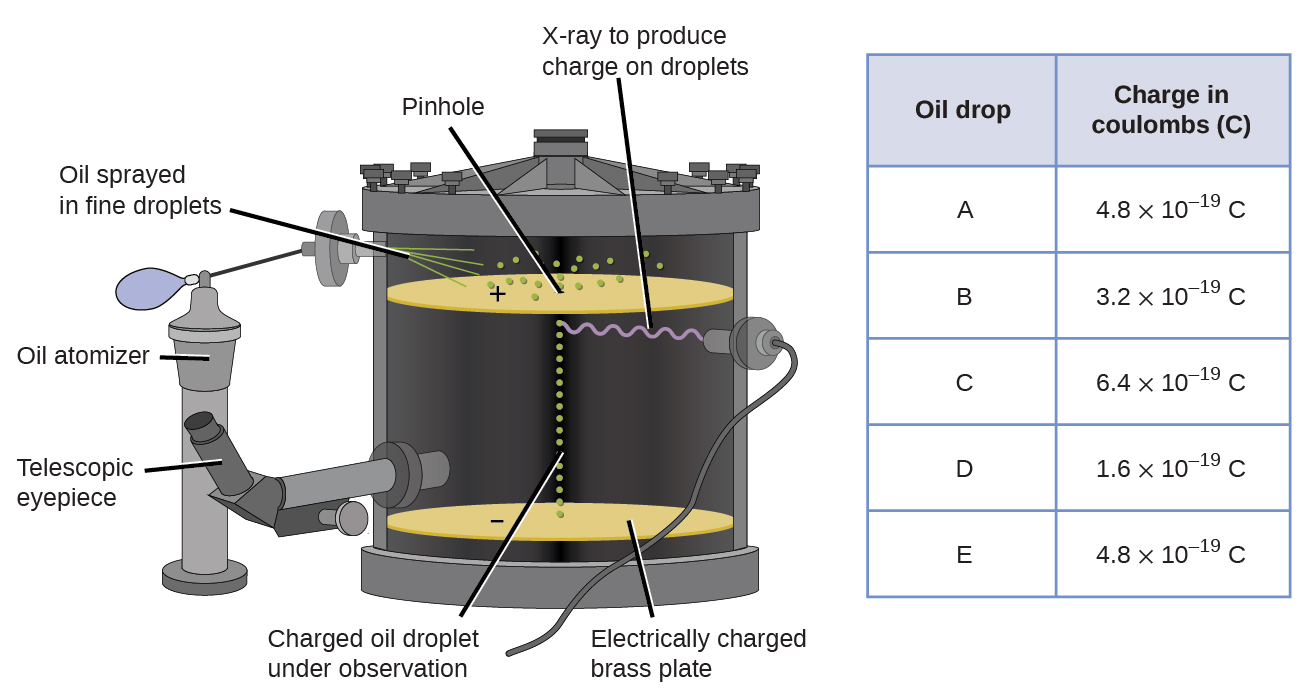
Figura\(\PageIndex{6}\): El experimento de Millikan midió la carga de gotas de aceite individuales. Los datos tabulados son ejemplos de algunos valores posibles.
Al observar los datos de carga que Millikan recopiló, es posible que haya reconocido que la carga de una gotita de aceite siempre es un múltiplo de una carga específica, 1.6\(\times\) 10 −19 C. Millikan concluyó que este valor debe ser, por lo tanto, una carga fundamental, la carga de un solo electrón, con su medida carga debido a un exceso de un electrón (1 por 1.6\(\times\) 10 −19 C), dos electrones (2 veces 1.6\(\times\) 10 −19 C), tres electrones (3 veces 1.6\(\times\) 10 −19 C), y así sucesivamente, en una gotita de aceite dada. Dado que la carga de un electrón ahora se conocía debido a la investigación de Millikan, y la relación carga-masa ya se conocía debido a la investigación de Thomson (1.759\(\times\) 10 11 C/kg), solo requirió un cálculo simple para determinar la masa del electrón también.
\[\mathrm{Mass\: of\: electron=1.602\times 10^{-19}\:\cancel{C}\times \dfrac{1\: kg}{1.759\times 10^{11}\:\cancel{C}}=9.107\times 10^{-31}\:kg} \tag{2.3.1}\]
Los científicos ya habían establecido que el átomo no era indivisible como Dalton había creído, y debido al trabajo de Thomson, Millikan y otros, se conocía la carga y masa de las partículas subatómicas negativas, los electrones. Sin embargo, la parte cargada positivamente de un átomo aún no se entendía bien. En 1904, Thomson propuso el modelo de átomos de “pudín de ciruela”, que describía una masa cargada positivamente con igual cantidad de carga negativa en forma de electrones incrustados en ella, ya que todos los átomos son eléctricamente neutros. Un modelo competidor había sido propuesto en 1903 por Hantaro Nagaoka, quien postuló un átomo similar a Saturno, consistente en una esfera cargada positivamente rodeada por un halo de electrones (Figura\(\PageIndex{3}\)).
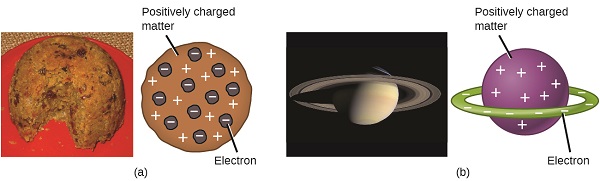
Figura\(\PageIndex{7}\): (a) Thomson sugirió que los átomos se asemejaban al pudín de ciruela, un postre inglés consistente en pastel húmedo con pasas incrustadas (“ciruelas”). (b) Nagaoka propuso que los átomos se asemejaban al planeta Saturno, con un anillo de electrones rodeando a un “planeta” positivo. (crédito a: modificación de obra de “Man vyi”/Wikimedia Commons; crédito b: modificación de obra por “NASA” /Wikimedia Commons).
El siguiente gran desarrollo en la comprensión del átomo vino de Ernest Rutherford, un físico de Nueva Zelanda que pasó en gran parte su carrera científica en Canadá e Inglaterra. Realizó una serie de experimentos utilizando un haz de partículas alfa de alta velocidad, cargadas positivamente (partículas α) que fueron producidas por la desintegración radiactiva del radio; las partículas α constan de dos protones y dos neutrones (aprenderás más sobre la desintegración radiactiva en el capítulo sobre nuclear química). Rutherford y sus colegas Hans Geiger (más tarde famoso por el contador Geiger) y Ernest Marsden apuntaron un haz de partículas α, cuya fuente estaba incrustada en un bloque de plomo para absorber la mayor parte de la radiación, a una pieza muy delgada de lámina de oro y examinaron la dispersión resultante de las partículas α usando una pantalla luminiscente que resplandeció brevemente donde fueron golpeadas por una partícula α.
¿Qué descubrieron? La mayoría de las partículas pasaron a través de la lámina sin ser desviadas en absoluto. Sin embargo, algunos se desviaron ligeramente, y un número muy pequeño se desviaron casi directamente hacia la fuente (Figura\(\PageIndex{4}\)). Rutherford describió encontrar estos resultados: “Fue el evento más increíble que me haya pasado en mi vida. Fue casi tan increíble como si dispararas un caparazón de 15 pulgadas a un trozo de papel tisú y volviera y te golpeara” 1 (p. 68).
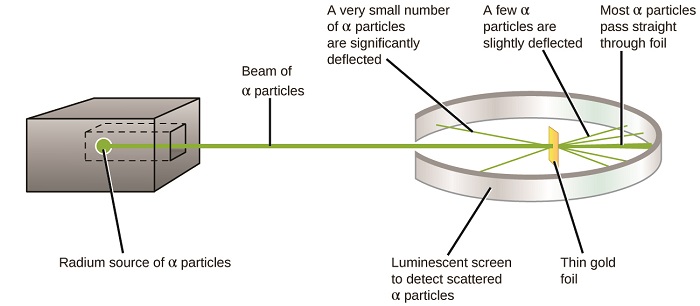
Figura\(\PageIndex{8}\): Geiger y Rutherford dispararon partículas α en un trozo de lámina de oro y detectaron a dónde iban esas partículas, como se muestra en este diagrama esquemático de su experimento. La mayoría de las partículas pasaron directamente a través de la lámina, pero algunas se desviaron ligeramente y un número muy pequeño se desvió significativamente.
Esto es lo que Rutherford dedujo: Debido a que la mayoría de las partículas α de rápido movimiento pasaron a través de los átomos de oro sin desviarse, debieron haber viajado a través del espacio esencialmente vacío dentro del átomo. Las partículas alfa están cargadas positivamente, por lo que las deflexiones surgieron cuando encontraron otra carga positiva (como las cargas se repelen entre sí). Como cargas similares se repelen unas a otras, las pocas partículas α cargadas positivamente que cambiaron de trayectoria abruptamente debieron haber golpeado, o acercarse de cerca, a otro cuerpo que también tenía una carga positiva altamente concentrada. Dado que las deflexiones ocurrieron una pequeña fracción del tiempo, esta carga sólo ocupaba una pequeña cantidad del espacio en la lámina de oro. Analizando una serie de tales experimentos en detalle, Rutherford sacó dos conclusiones:
- El volumen ocupado por un átomo debe consistir en una gran cantidad de espacio vacío.
- Un cuerpo pequeño, relativamente pesado, cargado positivamente, el núcleo, debe estar en el centro de cada átomo.
Este análisis llevó a Rutherford a proponer un modelo en el que un átomo consiste en un núcleo muy pequeño, cargado positivamente, en el que se concentra la mayor parte de la masa del átomo, rodeada por los electrones cargados negativamente, de manera que el átomo es eléctricamente neutro (Figura\(\PageIndex{5}\)).
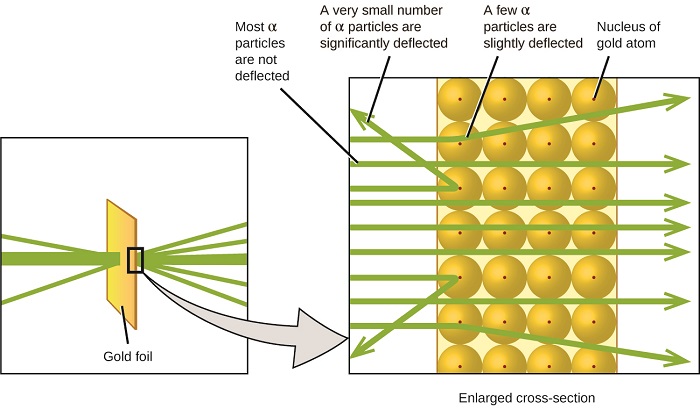
Figura\(\PageIndex{9}\): Las partículas α se desvían solo cuando chocan o pasan cerca del núcleo de oro mucho más pesado y cargado positivamente. Debido a que el núcleo es muy pequeño en comparación con el tamaño de un átomo, muy pocas partículas α son desviadas. La mayoría pasa a través de la región relativamente grande ocupada por electrones, que son demasiado ligeros para desviar las partículas que se mueven rápidamente.
Después de muchos más experimentos, Rutherford también descubrió que los núcleos de otros elementos contienen el núcleo de hidrógeno como un “bloque de construcción”, y nombró a esta partícula más fundamental el protón, la partícula subatómica cargada positivamente que se encuentra en el núcleo. Con una adición, que aprenderá a continuación, este modelo nuclear del átomo, propuesto hace más de un siglo, todavía se utiliza hoy en día.
Otro hallazgo importante fue el descubrimiento de isótopos. Durante principios del siglo XX, los científicos identificaron varias sustancias que parecían ser nuevos elementos, aislándolas de minerales radiactivos. Por ejemplo, a un “nuevo elemento” producido por la desintegración radiactiva del torio se le dio inicialmente el nombre de mesotorio. Sin embargo, un análisis más detallado mostró que el mesotorio era químicamente idéntico al radio (otro producto de desintegración), a pesar de tener una masa atómica diferente. Este resultado, junto con hallazgos similares para otros elementos, llevó al químico inglés Frederick Soddy a darse cuenta de que un elemento podría tener tipos de átomos con diferentes masas que eran químicamente indistinguibles. Estos diferentes tipos se llaman isótopos —átomos del mismo elemento que difieren en masa. Soddy fue galardonado con el Premio Nobel de Química en 1921 por este descubrimiento.
Quedó un rompecabezas: Se sabía que el núcleo contenía casi toda la masa de un átomo, con el número de protones solo proporcionando la mitad, o menos, de esa masa. Se hicieron diferentes propuestas para explicar qué constituía la masa restante, incluyendo la existencia de partículas neutras en el núcleo. Como cabría esperar, detectar partículas sin carga es muy desafiante, y no fue hasta 1932 que James Chadwick encontró evidencia de neutrones, partículas subatómicas no cargadas con una masa aproximadamente la misma que la de los protones. La existencia del neutrón también explicó isótopos: Difieren en masa porque tienen diferentes números de neutrones, pero son químicamente idénticos porque tienen el mismo número de protones. Esto se explicará con más detalle más adelante en esta dependencia.
Video\(\PageIndex{2}\): Una introducción a las partículas subatómicas
Resumen
Video\(\PageIndex{3}\): Un resumen de los descubrimientos en la teoría atómica.
Video\(\PageIndex{4}\): Un resumen diferente de los descubrimientos en la teoría atómica.
Los antiguos griegos propusieron que la materia consiste en partículas extremadamente pequeñas llamadas átomos. Dalton postuló que cada elemento tiene un tipo característico de átomo que difiere en propiedades de los átomos de todos los demás elementos, y que los átomos de diferentes elementos pueden combinarse en proporciones fijas, pequeñas, de número entero para formar compuestos. Todas las muestras de un compuesto en particular tienen las mismas proporciones elementales en masa. Cuando dos elementos forman compuestos diferentes, una masa dada de un elemento se combinará con las masas del otro elemento en una pequeña relación de número entero. Durante cualquier cambio químico, los átomos no son creados ni destruidos.
Aunque en realidad nadie ha visto el interior de un átomo, los experimentos han demostrado mucho sobre la estructura atómica. El tubo de rayos catódicos de Thomson mostró que los átomos contienen partículas pequeñas con carga negativa llamadas electrones. Millikan descubrió que existe una carga eléctrica fundamental: la carga de un electrón. El experimento de lámina de oro de Rutherford mostró que los átomos tienen un núcleo pequeño, denso y cargado positivamente; las partículas cargadas positivamente dentro del núcleo se llaman protones. Chadwick descubrió que el núcleo también contiene partículas neutras llamadas neutrones. Soddy demostró que los átomos del mismo elemento pueden diferir en masa; estos se llaman isótopos.
Notas al pie
- Ernest Rutherford, “El desarrollo de la teoría de la estructura atómica”, ed. J. A. Ratcliffe, en Antecedentes de la Ciencia Moderna, eds. Joseph Needham y Walter Pagel, (Cambridge, Reino Unido: Cambridge University Press, 1938), 61—74. Consultado el 22 de septiembre de 2014, https://ia600508.us.archive.org/3/it...e032734mbp.pdf.
Glosario
- Teoría atómica de Dalton
- conjunto de postulados que establecieron las propiedades fundamentales de los átomos
- ley de composición constante
- (también, ley de proporciones definidas) todas las muestras de un compuesto puro contienen los mismos elementos en las mismas proporciones en masa
- ley de múltiples proporciones
- cuando dos elementos reaccionan para formar más de un compuesto, una masa fija de un elemento reaccionará con las masas del otro elemento en una proporción de números enteros pequeños
- ley de proporciones definidas
- (también, ley de composición constante) todas las muestras de un compuesto puro contienen los mismos elementos en las mismas proporciones en masa
- partícula alfa (partícula α)
- partícula cargada positivamente que consiste en dos protones y dos neutrones
- electrón
- partícula subatómica cargada negativamente de masa relativamente baja ubicada fuera del núcleo
- isótopos
- átomos que contienen el mismo número de protones pero diferentes números de neutrones
- neutrones
- partícula subatómica no cargada ubicada en el núcleo
- protón
- partícula subatómica cargada positivamente ubicada en el núcleo
- núcleo
- centro masivo, cargado positivamente de un átomo compuesto por protones y neutrones
Colaboradores
Paul Flowers (University of North Carolina - Pembroke), Klaus Theopold (University of Delaware) and Richard Langley (Stephen F. Austin State University) with contributing authors. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download for free at http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110).
- Adelaide Clark, Instituto de Tecnología de Oregón
- Crash Course Chemistry: Crash Course es una división de Complexly y los videos son gratuitos para transmitir con fines educativos.
- El compromiso de TED-ed con la creación de lecciones dignas de compartir es una extensión de la misión de TED de difundir grandes ideas. Dentro de la creciente biblioteca de animaciones TED-ed, encontrarás videos educativos cuidadosamente seleccionados, muchos de los cuales representan colaboraciones entre talentosos educadores y animadores nominados a través del sitio web de TED-ed.

