2.1.1: La Tabla Periódica
- Page ID
- 81218
- Familiarizarse con la historia de la tabla periódica.
La tabla periódica moderna ha evolucionado a través de una larga historia de intentos de químicos para organizar los elementos de acuerdo con su reactividad y otras propiedades como ayuda para predecir el comportamiento químico. Ahora que hemos dispuesto la mesa de acuerdo a la estructura electrónica, tiene sentido volver atrás y mirar los esfuerzos anteriores a la luz de lo que sabemos sobre la estructura electrónica.
Uno de los primeros en sugerir tal arreglo fue el químico alemán Johannes Dobereiner (1780—1849), quien notó que muchos de los elementos conocidos podían agruparse en tríadas, conjuntos de tres elementos que tienen propiedades similares, por ejemplo, cloro, bromo y yodo; o cobre, plata y oro. Dobereiner propuso que todos los elementos pudieran agruparse en tales tríadas, pero los intentos posteriores de ampliar su concepto no tuvieron éxito. Ahora sabemos que partes de la tabla periódica —el bloque d en particular— contienen tríadas de elementos con similitudes sustanciales. Los tres miembros medios de la mayoría de las otras columnas, como azufre, selenio y teluro en el grupo 16 o aluminio, galio e indio en el grupo 13, también tienen una química notablemente similar.
A mediados del siglo XIX se habían determinado las masas atómicas de muchos de los elementos. El químico inglés John Newlands (1838—1898), planteando la hipótesis de que la química de los elementos podría estar relacionada con sus masas, dispuso los elementos conocidos en orden de aumentar la masa atómica y descubrió que cada séptimo elemento tenía propiedades similares (Figura 3.4.1). Por lo tanto, Newlands sugirió que los elementos podrían clasificarse en octavas: un grupo de siete elementos (sin contar los gases nobles, que se desconocían en ese momento) que corresponden a las filas horizontales en los elementos del grupo principal. Desafortunadamente, la “ley de octavas” de Newlands no parecía funcionar para elementos más pesados que el calcio, y su idea fue ridiculizada públicamente. En una reunión científica, se le preguntó a Newlands por qué no arregló los elementos en orden alfabético en lugar de por masa atómica, ¡ya que eso tendría tanto sentido! En realidad, Newlands estaba en el camino correcto, con solo unas pocas excepciones, la masa atómica aumenta con el número atómico, y propiedades similares ocurren cada vez que se llena un conjunto de ns 2 np 6 subshells. A pesar de que la mesa de Newlands no tenía lugar lógico para los elementos del bloque d, fue honrado por su idea por la Royal Society de Londres en 1887.
John Newlands (1838—1898)
Newlands notó que las propiedades elementales repetían cada séptimo (o múltiplo de siete) elemento, ya que las notas musicales repetían cada octava nota.
La tabla periódica logró su forma moderna a través de la obra del químico alemán Julius Lothar Meyer (1830—1895) y del químico ruso Dimitri Mendeleev (1834—1907), ambos enfocados en las relaciones entre la masa atómica y diversas propiedades físicas y químicas. En 1869, propusieron independientemente arreglos esencialmente idénticos de los elementos. Meyer alineó los elementos de su tabla según variaciones periódicas en las propiedades atómicas simples, como el “volumen atómico” (Figura 3.4.2), que obtuvo dividiendo la masa atómica (masa molar) en gramos por mol por la densidad del elemento en gramos por centímetro cúbico. Esta propiedad equivale a lo que hoy se define como volumen molar, la masa molar de un elemento dividida por su densidad (medida en centímetros cúbicos por mol):
\( \dfrac{molar\; mass\left ( \cancel{g}/mol \right )}{density\left ( \cancel{g}/cm^{3} \right )}=molar\; volume\left ( cm^{3}/mol \right ) \tag{3.4.1}\)
Como se muestra en la Figura 3.4.2, los metales alcalinos tienen los mayores volúmenes molares de los elementos sólidos. En la gráfica de Meyer de volumen atómico versus masa atómica, los no metales ocurren en la porción ascendente de la gráfica, y los metales ocurren en los picos, en los valles y en las laderas descendentes.
Dimitri Mendeleev (1834—1907)
Cuando la fábrica de vidrio de su familia fue destruida por un incendio, Mendeleev se mudó a San Petersburgo, Rusia, para estudiar ciencia. Se enfermó y no se esperaba que se recuperara, pero terminó su doctorado con la ayuda de sus profesores y compañeros de estudios. Además de la tabla periódica, otra de las contribuciones de Mendeleev a la ciencia fue un libro de texto destacado, Los principios de la química, que se utilizó durante muchos años.
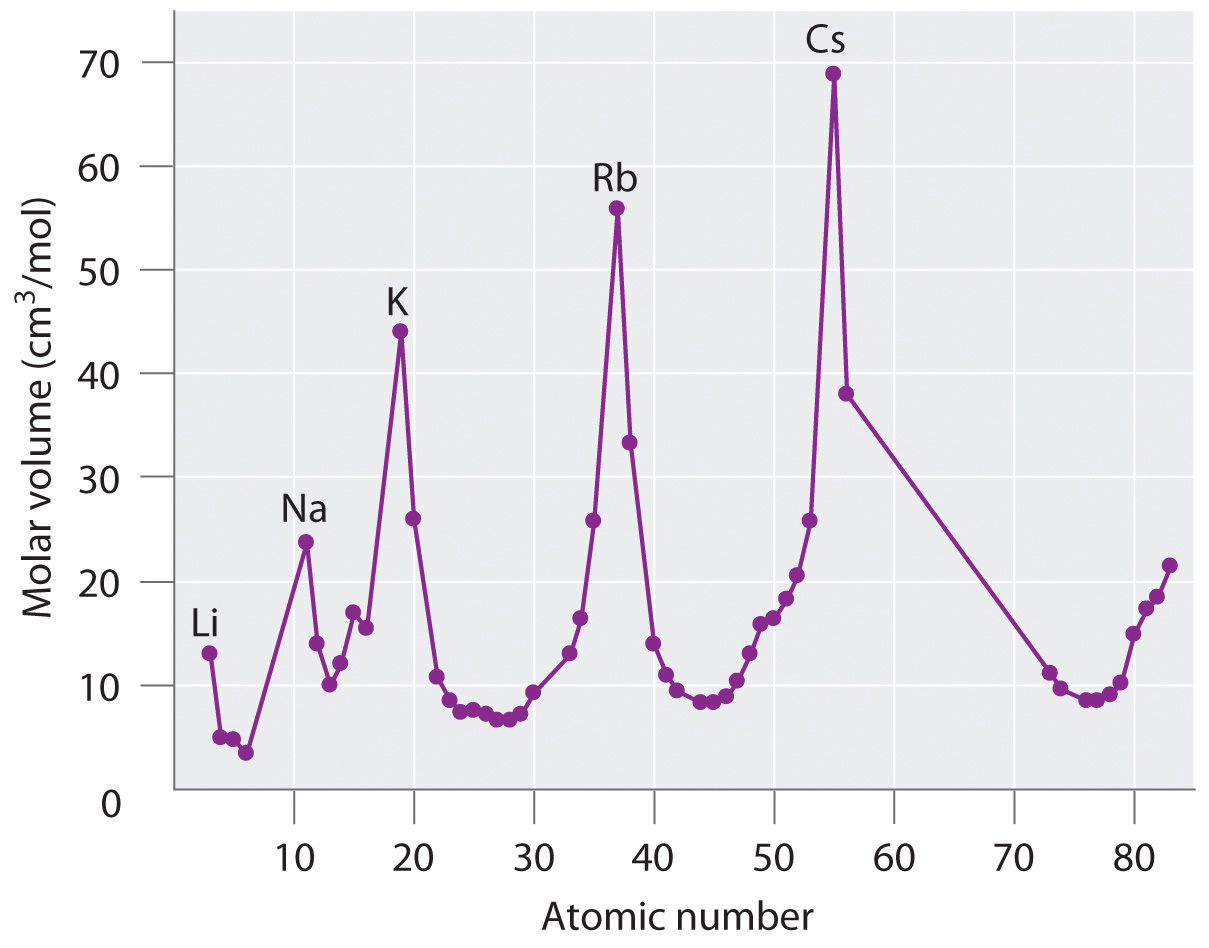
Tabla Periódica de Mendeleev
Mendeleev, quien publicó por primera vez su tabla periódica en 1869 (Figura 3.4.3), generalmente se le atribuye el origen de la tabla periódica moderna. La diferencia clave entre su disposición de los elementos y la de Meyer y otros es que Mendeleev no asumió que todos los elementos habían sido descubiertos (en realidad, solo alrededor de dos tercios de los elementos naturales se conocían en ese momento). En cambio, deliberadamente dejó espacios en blanco en su mesa a las masas atómicas 44, 68, 72 y 100, con la expectativa de que se descubrieran elementos con esas masas atómicas. Esos espacios en blanco corresponden a los elementos que hoy conocemos como candio, galio, germanio y tecnecio.
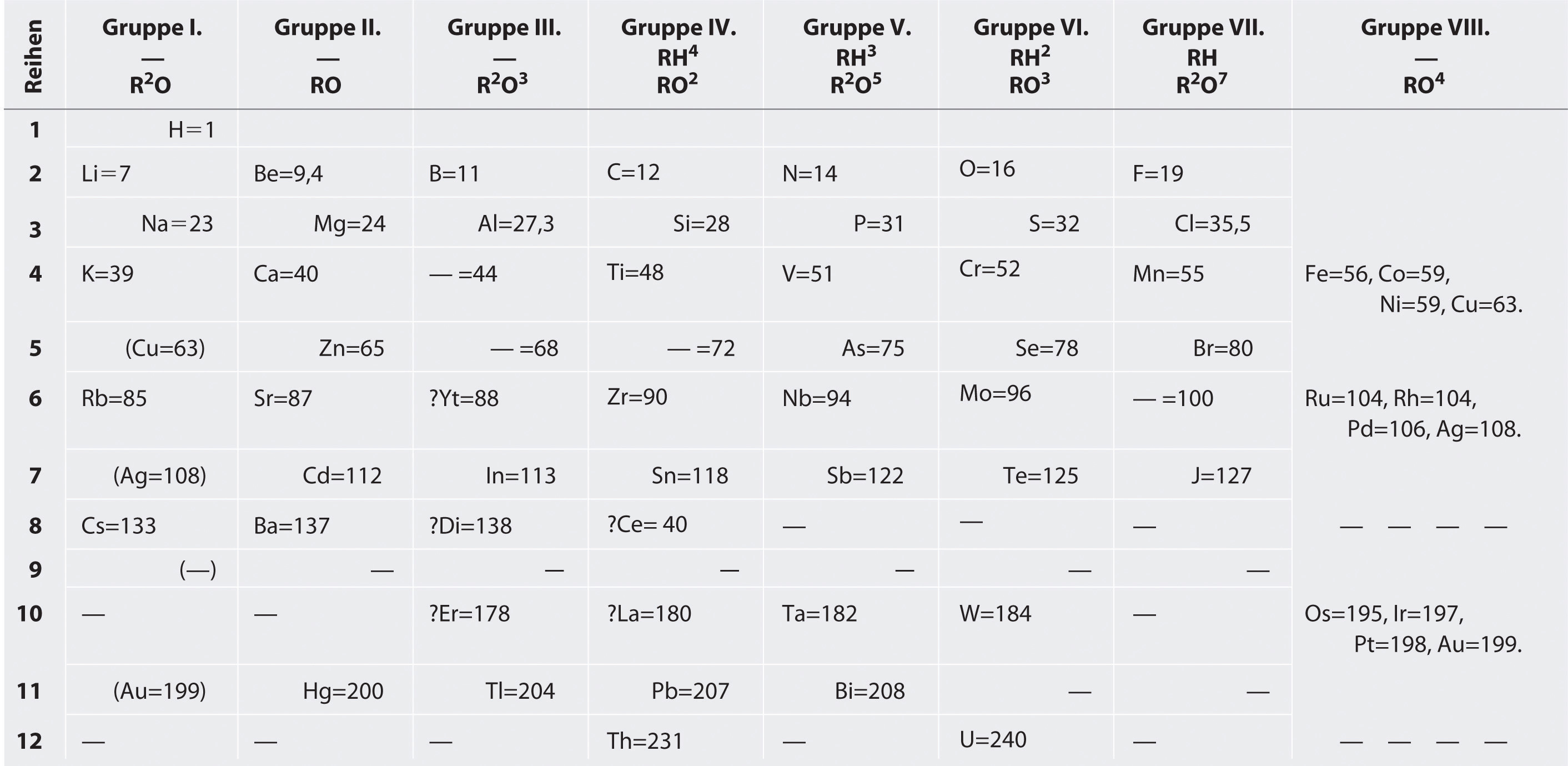
Los grupos en la tabla de Mendeleev están determinados por cuántos átomos de oxígeno o hidrógeno se necesitan para formar compuestos con cada elemento. Por ejemplo, en el Grupo I, dos átomos de hidrógeno (H), litio (Li), sodio (Na) y potasio (K) forman compuestos con un átomo de oxígeno. En el Grupo VII, un átomo de flúor (F), cloro (Cl) y bromo (Br), reacciona con un átomo de hidrógeno. Observe cómo este enfoque tiene problemas con los metales de transición. Hasta aproximadamente 1960, una mesa rectangular desarrollada a partir de la mesa de Mendeleev y basada en la reactividad era estándar en la parte delantera de las salas de conferencias de química.
La evidencia más convincente en apoyo de la disposición de Mendeleev de los elementos fue el descubrimiento de dos elementos previamente desconocidos cuyas propiedades correspondían estrechamente con sus predicciones (Cuadro 3.4.1). Dos de los espacios en blanco que Mendeleev había dejado en su mesa original estaban debajo del aluminio y el silicio, esperando el descubrimiento de dos elementos aún desconocidos, eka -aluminio y eka -silicio (del sánscrito eka, que significa “uno”, como en “uno más allá del aluminio”). Las propiedades observadas del galio y germanio coincidieron con las del eka -aluminio y ekasilicio tan bien que una vez descubiertas, la tabla periódica de Mendeleev rápidamente ganó aceptación.
Cuadro 3.4.1 Comparación de las propiedades predichas por Mendeleev en 1869 para eka -aluminio y eka -silicio con las propiedades del galio (descubierto en 1875) y germanio (descubierto en 1886)
| Propiedad | eka -Aluminio (predicho) | Galio (observado) | eka -Silicio (predicho) | Germanio (observado) |
|---|---|---|---|---|
| masa atómica | 68 | 69.723 | 72 | 72.64 |
| elemento | metal | metal | metal gris sucio | Gris-Blanco Metal |
| mp* bajo | mp = 29.8°C | alto mp | mp = 938°C | |
| d = 5.9 g/cm 3 | d = 5.91 g/cm 3 | d = 5.5 g/cm 3 | d = 5.323 g/cm 3 | |
| óxido | E 2 O 3 | Ga 2 O 3 | EO 2 | GeO 2 |
| d = 5.5 g/cm 3 | d = 6.0 g/cm 3 | d = 4.7 g/cm 3 | d = 4.25 g/cm 3 | |
| cloruro | ECl 3 | GACL 3 | ECl 4 | GeCL 4 |
| volátil |
mp = 78°C bp* = 201°C |
bp < 100°C | bp = 87°C | |
| *mp = punto de fusión; bp = punto de ebullición. | ||||
Cuando las propiedades químicas de un elemento sugerían que podría haber sido asignado el lugar equivocado en tablas anteriores, Mendeleev reexaminó cuidadosamente su masa atómica. Descubrió, por ejemplo, que las masas atómicas reportadas anteriormente para berilio, indio y uranio eran incorrectas. La masa atómica del indio había sido reportada originalmente como 75.6, basada en una supuesta estequiometría de iNO para su óxido. Si esta masa atómica fuera correcta, entonces el indio tendría que colocarse en el medio de los no metales, entre el arsénico (masa atómica 75) y el selenio (masa atómica 78). Debido a que el indio elemental es un metal blanco plateado, sin embargo, Mendeleev postuló que la estequiometría de su óxido estaba realmente en 2 O 3 en lugar de iNO. Esto significaría que la masa atómica del indio era en realidad 113, colocando el elemento entre otros dos metales, el cadmio y el estaño.
Un grupo de elementos ausentes de la mesa de Mendeleev fueron los gases nobles, todos los cuales fueron descubiertos más de 20 años después, entre 1894 y 1898, por Sir William Ramsay (1852-1916; Premio Nobel de Química 1904). Inicialmente, Ramsay no sabía dónde colocar estos elementos en la tabla periódica. El argón, el primero en ser descubierto, tenía una masa atómica de 40. Esto era mayor que el cloro y comparable al del potasio; por lo que Ramsay, usando el mismo tipo de razonamiento que Mendeleev, decidió colocar los gases nobles entre los halógenos y los metales alcalinos.
El papel del número atómico en la tabla periódica
A pesar de su utilidad, la tabla periódica de Mendeleev se basó enteramente en la observación empírica apoyada en muy poco entendimiento. No fue sino hasta 1913, cuando un joven físico británico, H. G. J. Moseley (1887—1915), al analizar las frecuencias de rayos X emitidas por los elementos, descubrió que la base subyacente del orden de los elementos era el número atómico, no la masa atómica. Moseley planteó la hipótesis de que la colocación de cada elemento en su serie correspondía a su número atómico Z, que es el número de cargas positivas (protones) en su núcleo. El argón, por ejemplo, aunque tenía una masa atómica mayor que la del potasio (39.9 amu versus 39.1 amu, respectivamente), se colocó antes del potasio en la tabla periódica. Al analizar las frecuencias de los rayos X emitidos, Moseley notó que el número atómico de argón es 18, mientras que el del potasio es 19, lo que indicó que efectivamente se colocaron correctamente. Moseley también notó tres brechas en su tabla de frecuencias de rayos X, por lo que predijo la existencia de tres elementos desconocidos: tecnecio (Z = 43), descubierto en 1937; prometio (Z = 61), descubierto en 1945; y renio (Z = 75), descubierto en 1925.
H. G. J. Moseley (1887—1915)
Moseley dejó su trabajo de investigación en la Universidad de Oxford para unirse al ejército británico como oficial de telecomunicaciones durante la Primera Guerra Mundial Murió durante la Batalla de Gallipoli en Turquía.
Ejemplo 3.4.1
Antes de su descubrimiento en 1999, algunos teóricos creían que un elemento con una Z de 114 existía en la naturaleza. Usa el razonamiento de Mendeleev para nombrar al elemento 114 como eka -______; luego identifica el elemento conocido cuya química predices sería más similar a la del elemento 114.
Dado: número atómico
Preguntado por: nombre usando prefijo eka -
Estrategia:
A Usando la tabla periódica localice la fila n = 7. Identificar la ubicación del elemento desconocido con Z = 114; luego identificar el elemento conocido que se encuentra directamente encima de esta ubicación.
B Nombra el elemento desconocido usando el prefijo eka - antes del nombre del elemento conocido.
Solución:
A La fila n = 7 se puede rellenar asumiendo la existencia de elementos con números atómicos mayores a 112, que se encuentra debajo del mercurio (Hg). Contando tres casillas a la derecha da el elemento 114, que se encuentra directamente debajo del plomo (Pb). B Si Mendeleev estuviera vivo hoy, llamaría al elemento 114 eka -lead.
Ejercicio
Usa el razonamiento de Mendeleev para nombrar al elemento 112 como eka -______; luego identifica el elemento conocido cuya química predices sería más similar a la del elemento 112.
Respuesta: eka -mercury
Resumen
La tabla periódica organiza los elementos de acuerdo con sus configuraciones electrónicas, de tal manera que los elementos de la misma columna tienen las mismas configuraciones de electrones de valencia. Las variaciones periódicas en el tamaño y las propiedades químicas son factores importantes para dictar los tipos de reacciones químicas que experimentan los elementos y los tipos de compuestos químicos que forman. La tabla periódica moderna se basó en correlaciones empíricas de propiedades como la masa atómica; los primeros modelos que utilizaron datos limitados señalaron la existencia de tríadas y octavas de elementos con propiedades similares. La tabla periódica logró su forma actual a través del trabajo de Dimitri Mendeleev y Julius Lothar Meyer, quienes se centraron en la relación entre la masa atómica y las propiedades químicas. Meyer dispuso los elementos por su volumen atómico, que hoy es equivalente al volumen molar, definido como masa molar dividida por densidad molar. La correlación con la estructura electrónica de los átomos se realizó cuando H. G. J. Moseley demostró que la disposición periódica de los elementos estaba determinada por el número atómico, no por la masa atómica.
Claves para llevar
- Los elementos de la tabla periódica se organizan de acuerdo a sus propiedades, y la tabla periódica sirve como una ayuda para predecir el comportamiento químico.
Problemas conceptuales
-
A Johannes Dobereiner se le atribuye el desarrollo del concepto de tríadas químicas. ¿Cuál de los 15 elementos del grupo esperarías para componer una tríada? ¿Esperarías que B, Al y Ga actúen como tríada? Justifica tus respuestas.
-
A pesar de que Dobereiner, Newlands, Meyer y Mendeleev contribuyeron al desarrollo de la tabla periódica moderna, Mendeleev se le atribuye su origen. ¿Por qué se aceptó tan rápidamente la tabla periódica de Mendeleev?
-
¿Cómo explicó la contribución de Moseley al desarrollo de la tabla periódica la ubicación de los gases nobles?
-
Se utilizó el esquema de nomenclatura eka ideado por Mendeleev para describir elementos no descubiertos.
- Utilice este método de nomenclatura para predecir el número atómico de eka -mercurio, eka -astatino, eka -talio y eka -hafnio.
- Usando el prefijo eka, identifique los elementos con estos números atómicos: 79, 40, 51, 117 y 121.
Problema Numérico
-
Con base en los datos dados, complete la tabla.
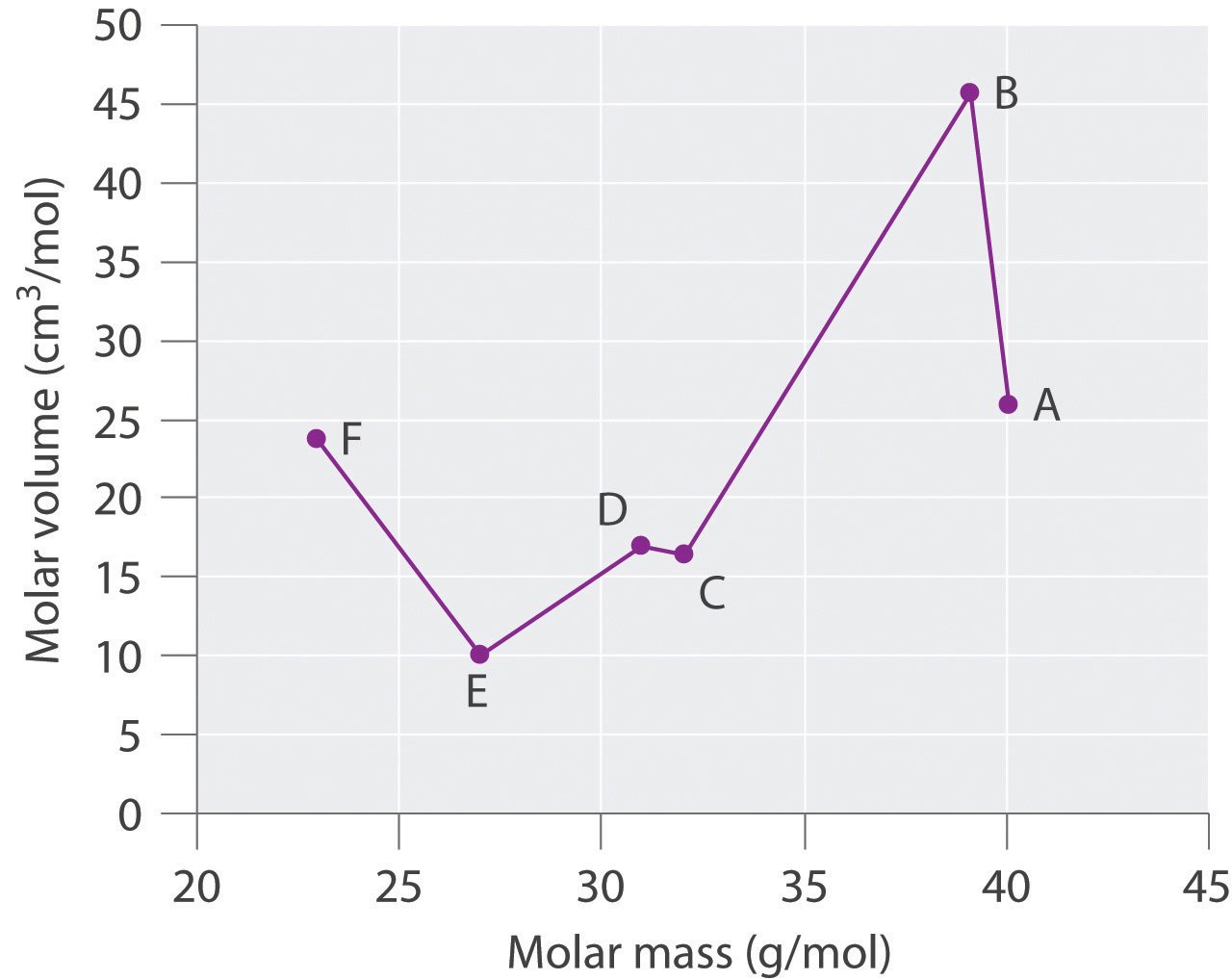
Especies Masa molar (g/mol) Densidad (g/cm 3) Volumen molar (cm 3 /mol) A 40.078 25.85 B 39.09 0.856 C 32.065 16.35 D 1.823 16.98 E 26.98 9.992 F 22.98 0.968 Trazar volumen molar versus masa molar para estas sustancias. Según Meyer, ¿cuáles serían considerados metales y cuáles serían considerados no metales?
Contestar
-
Especies Masa molar (g/mol) Densidad (g/cm 3) Volumen molar (cm 3 /mol) A 40.078 1.550 25.85 B 39.09 0.856 45.67 C 32.065 1.961 16.35 D 30.95 1.823 16.98 E 26.98 2.700 9.992 F 22.98 0.968 23.7 Meyer encontró que los metales alcalinos tenían los volúmenes molares más altos, y que los volúmenes molares disminuyeron de manera constante al aumentar la masa atómica, luego se nivelaron y finalmente volvieron a subir. Los elementos ubicados en la porción ascendente de una parcela de volumen molar versus masa molar fueron típicamente no metales. Si observamos la gráfica de los datos en la tabla, podemos identificar inmediatamente aquellos elementos con los mayores volúmenes molares (A, B, F) como metales ubicados en el lado izquierdo de la tabla periódica. El elemento con el menor volumen molar (E) es el aluminio. La gráfica muestra que los elementos posteriores (C, D) tienen volúmenes molares que son mayores que los de E, pero menores que los de A y B. Así, C y D tienen más probabilidades de ser no metales (que es el caso: C = azufre, D = fósforo).