3.1: Diagramas de punto y electrones de Lewis
- Page ID
- 81277
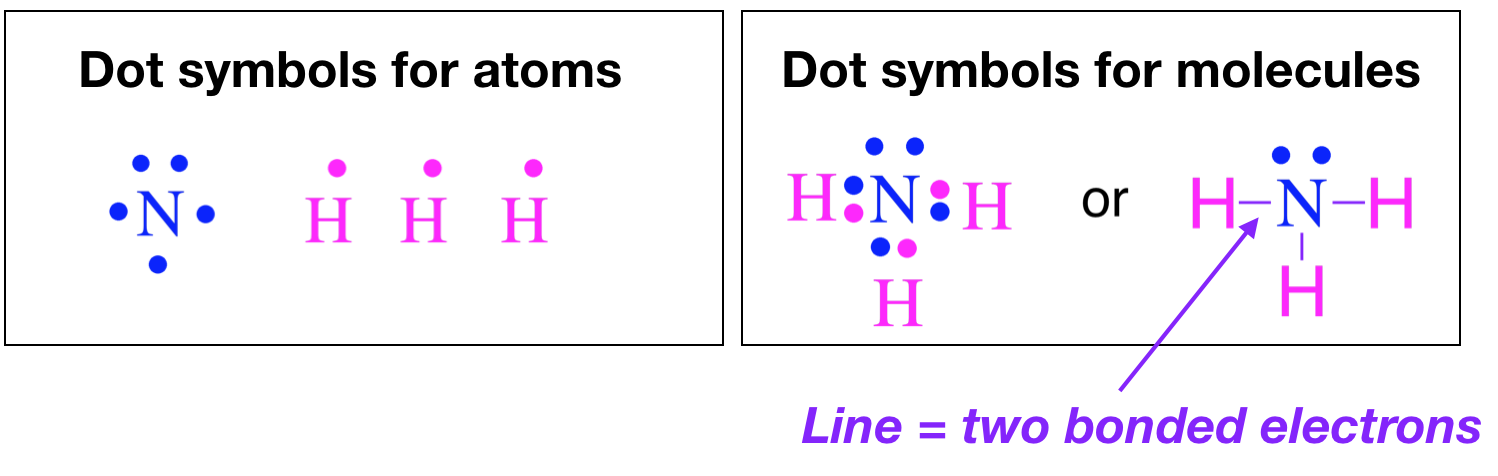
En 1916, Gilbert Lewis Newton introdujo una manera sencilla de mostrar la unión entre los átomos en una molécula a través de diagramas de puntos electrónicos de Lewis. Crear diagramas de Lewis es bastante simple y requiere solo unos pocos pasos y cierta contabilidad de los electrones de valencia en cada átomo. Los electrones de valencia se representan como puntos. Cuando dos electrones están emparejados (pares solitarios), se representan por dos puntos adyacentes ubicados en un átomo, y cuando dos electrones emparejados se comparten entre átomos (enlaces), se muestran como líneas. Por ejemplo, a continuación se muestran las estructuras de puntos electrónicos de los átomos y las estructuras de puntos electrónicos de Lewis de las moléculas.
Estos diagramas son útiles porque nos permiten mostrar cómo se conectan los átomos, y cuando se acoplan con la Teoría de Repulsión Electrónica de Cáscara de Valencia (VSEPR), podemos usar estructuras de Lewis para predecir la forma de la molécula.
El dibujo de las estructuras electrón-punto de Lewis se guía en gran medida por la regla del octeto: que los átomos forman enlaces para lograr ocho electrones en su caparazón de valencia. Para muchos elementos, una capa de valencia completa tiene una configuración electrónica de\(s^2p^6\), u ocho electrones. Una excepción común a esta regla son los elementos de la primera fila, H y He. Estos dos elementos tienen\(n=1\) como su caparazón de valencia, por lo que solo tienen dos electrones en una capa de valencia completa (configuración\(1s^2\) electrónica). Si bien H y Él son excepciones a la “regla del octeto”, aún forman lazos para lograr una concha de valencia completa. Tal vez sea mejor pensar en esto como la regla de la “valencia completa” de la vinculación. Veremos muchas más violaciones a la regla del “octeto” a medida que avancemos en este curso. En el caso de los metales y metaloides, la ruptura de las reglas es particularmente común. (CC-BY-NC-SA; Kathryn Haas)
- Menos de ocho electrones (hipovalencia): H y He son ejemplos de elementos que no pueden tener más de dos electrones en su caparazón de valencia completa. Adicionalmente, hay casos en los que una estructura de Lewis válida contiene átomos con hipovalencia: conchas de valencia parcialmente rellenas. Un ejemplo de ello es un carbocatión, un carbono cargado positivamente con sólo seis electrones en su caparazón de valencia. Los carbocationes son intermedios importantes en la química orgánica, y son ácidos de Lewis altamente reactivos (inestables) (electrófilos). Otro ejemplo de hipovalencia es la estructura de Lewis para BH 3, que muestra boro con tres enlaces, y sólo seis electrones en su caparazón de valencia. El hidruro de boro es un ácido de Lewis fuerte. (Nota al margen: la forma química real de BH 3 no está bien predicha por la estructura de Lewis y veremos más sobre esto en la Sección 3.1.4.)
- Más de ocho electrones (hipervalencia): Este es un caso donde un elemento tiene más de ocho electrones en su caparazón de valencia. Es común para átomos más grandes (\(n\geq3\)), y se discute más a fondo en la Sección 3.1.2.
¡Alerta de trampas! Existen diferentes reglas para contar electrones dependiendo del propósito del conteo. Estas son las reglas para contar para “octetos”. Las reglas para contar para el cálculo de la carga formal de un átomo son!! diferente!! y se describen en la Sección 3.1.1. Cuando un átomo es parte de una molécula, todos los electrones que están asociados con el átomo se cuentan como contribuyentes a la valencia del átomo. Esto incluye electrones que son pares solitarios en los átomos, y todos los electrones que se comparten en enlaces. Si cuatro electrones se comparten entre dos átomos, es un doble enlace. Si seis electrones se comparten entre átomos, se trata de un triple enlace.
Electrones en valencia (octeto) = electrones totales no enlazados en el átomo + electrones unidos totales (2 electrones por enlace)
Incluso si eres un viejo profesional dibujando estructuras de Lewis, es una buena idea pulir. Por favor, complete los ejercicios de práctica a continuación. Deberías sacar un pedazo de papel real (lo sé... solo hazlo. Es bueno para ti.) y una herramienta de escritura e intenta completar cada problema antes de verificar la respuesta.
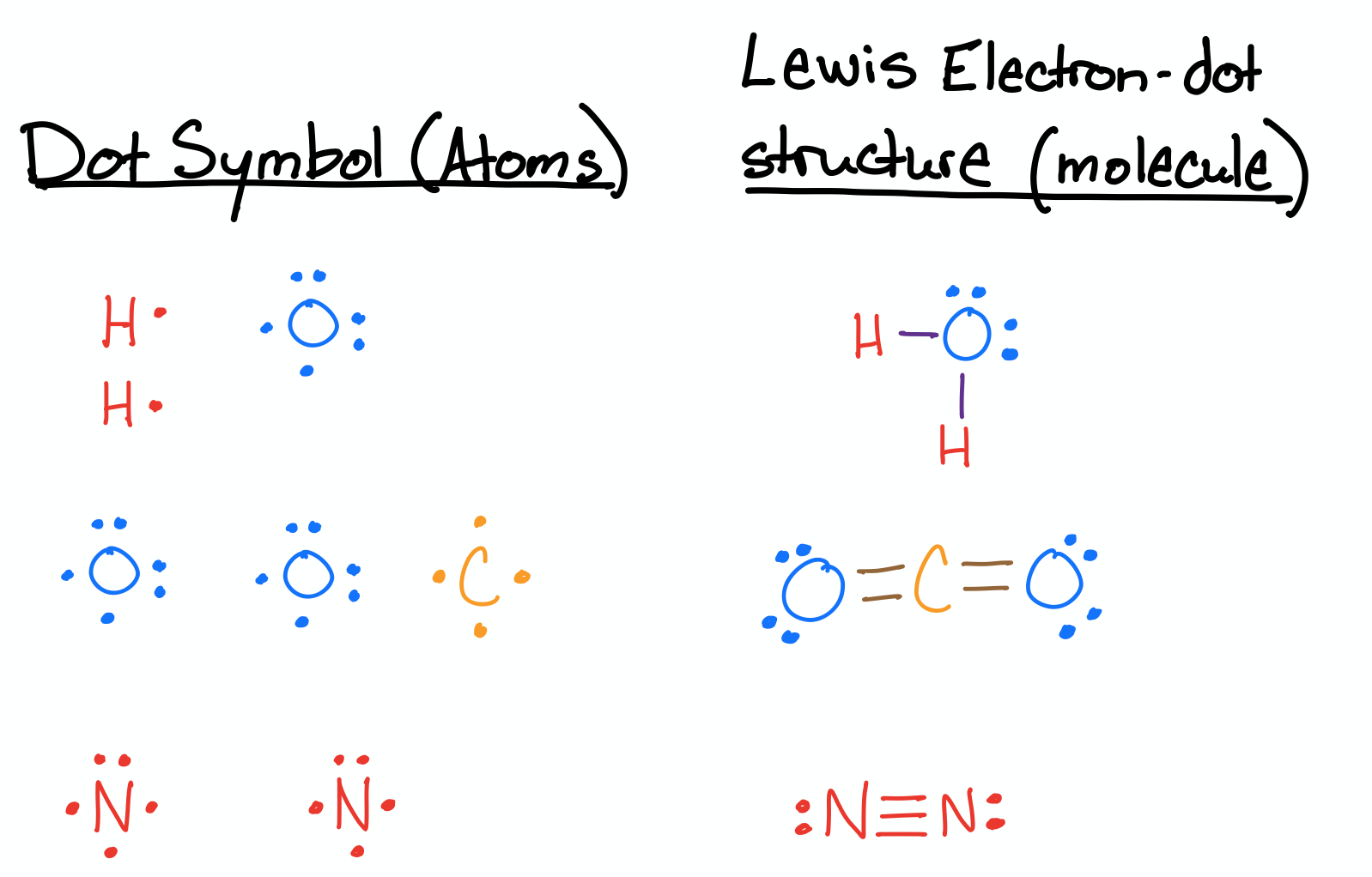
Dibuje las estructuras de Lewis para H 2 O, CO 2 y N 2.
- Responder
-
Dibuja las estructuras de Lewis para H 2, BH 3 y BF 3.
- Responder
-
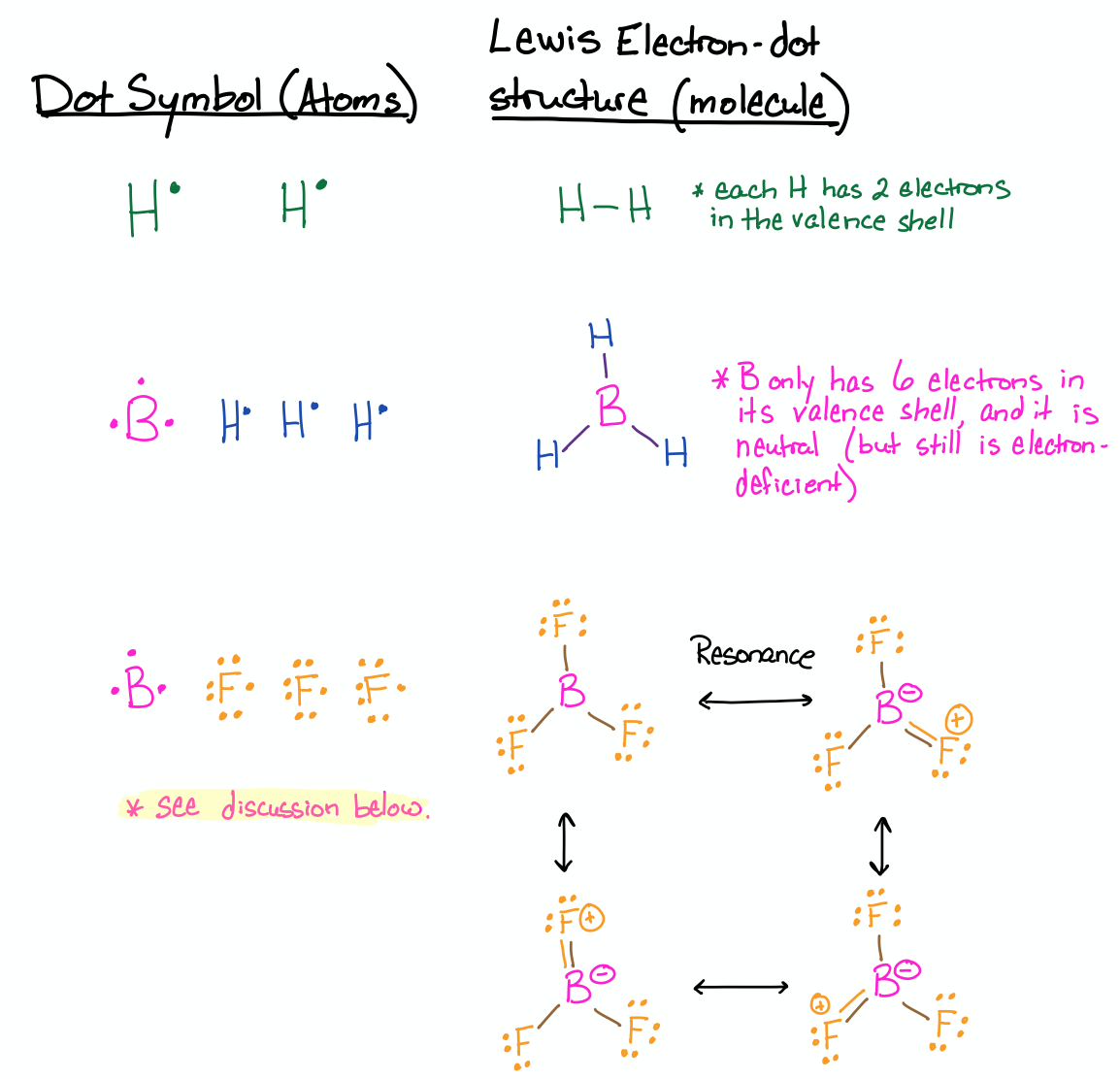
Estos tres ejemplos incluyen átomos que tienen menos de ocho electrones en su caparazón de valencia. En el caso de H, está satisfecho con sólo dos electrones en su valencia, como se discutió anteriormente en esta sección. También se discutió anteriormente el caso de BH 3. En la estructura Lewis de BH 3, el boro sólo puede tener seis electrones en su octeto y es neutro en carga. El boro es deficiente en electrones a pesar de que tiene carga neutra.
El caso de BF 3 merece una discusión: Si no está familiarizado con la resonancia y el cargo formal, consulte primero las Secciones 3.1.1 (Resonancia) y 3.1.3 (Cargo Formal) y vuelva a esto después. Podrías haber dibujado la estructura BF 3 similar a la que se dibuja para BH 3, donde el boro tiene tres enlaces y sólo seis electrones en su caparazón de valencia. Si hiciste eso, entonces tienes razón; pero si solo diste esta estructura, entonces tu respuesta no es completa. Hay otras tres formas correctas de dibujar la estructura. Dado que F tiene pares solitarios de electrones, otras estructuras de Lewis válidas tendrían cada una un doble enlace a uno de los fluorinos (tres en total). Todas estas estructuras se denominan estructuras de resonancia, y con base en las cuatro, podríamos predecir que BF 3 tendría enlaces B-F que tienen algún carácter de doble enlace. Si es cierto, este es el caso de BF 3; tiene longitudes de enlace que son más cortas que los enlaces simples, pero más largas que los dobles enlaces. Lee más sobre ello en su página de Wikipedia aquí (click).
Enlaces externos
- es.wikipedia.org/wiki/Lewis_Structures
- http://www.ausetute.com.au/lewisstr.html
- cost.georgiasouthern.edu/chem... cule/lewis.htm


