3.1.1: Resonancia
- Page ID
- 81296
- Comprender el concepto de resonancia.
Las estructuras de resonancia son un conjunto de dos o más estructuras de Lewis que describen colectivamente la unión electrónica de una sola especie poliatómica, incluidos los enlaces fraccionarios y las cargas fraccionarias. Las estructuras de resonancia son capaces de describir electrones deslocalizados que no pueden ser expresados por una sola fórmula de Lewis con un número integral de enlaces covalentes.
A veces una estructura de Lewis no es suficiente
A veces, incluso cuando se consideran cargas formales, la unión en algunas moléculas o iones no puede ser descrita por una sola estructura de Lewis. La resonancia es una manera de describir electrones deslocalizados dentro de ciertas moléculas o iones poliatómicos donde el enlace no puede ser expresado por una sola fórmula de Lewis. Una molécula o ion con tales electrones deslocalizados está representado por varias estructuras contribuyentes (también llamadas estructuras de resonancia o formas canónicas). Tal es el caso del ozono (\(\ce{O3}\)), un alótropo de oxígeno con una estructura en forma de V y un ángulo O—O—O de 117.5°.
Ozono (\(O_3\))
1. Sabemos que el ozono tiene una estructura en forma de V, por lo que un átomo de O es central:

2. Cada átomo O tiene 6 electrones de valencia, para un total de 18 electrones de valencia.
3. La asignación de un par de electrones de unión a cada enlace oxígeno-oxígeno da
con 14 electrones sobrantes.
4. Si colocamos tres pares solitarios de electrones en cada oxígeno terminal, obtenemos

y tienen 2 electrones sobrantes.
5. En este punto, ambos átomos de oxígeno terminales tienen octetos de electrones. Por lo tanto, colocamos los últimos 2 electrones en el átomo central:
6. El oxígeno central tiene sólo 6 electrones. Debemos convertir un par solitario en un átomo de oxígeno terminal en un par de electrones de unión, pero ¿cuál? Dependiendo de cuál escojamos, obtenemos ya sea
¿Cuál es el correcto? De hecho, tampoco es correcto. Ambos predicen un enlace sencillo O-O y un doble enlace O=O. Como aprenderás, si los bonos fueran de diferentes tipos (uno sencillo y otro doble, por ejemplo), tendrían diferentes longitudes. Resulta, sin embargo, que ambas distancias de enlace O-O son idénticas, 127.2 pm, lo que es más corto que un enlace sencillo O—O típico (148pm) y mayor que el doble enlace O=O en O 2 (120.7 pm).
Las estructuras equivalentes de punto de Lewis, como las del ozono, se denominan estructuras de resonancia. La posición de los átomos es la misma en las diversas estructuras de resonancia de un compuesto, pero la posición de los electrones es diferente. Las flechas de doble cabeza enlazan las diferentes estructuras de resonancia de un compuesto:
La flecha de doble punta indica que la estructura electrónica real es un promedio de las mostradas, no que la molécula oscile entre las dos estructuras.
Cuando es posible escribir más de una estructura de resonancia equivalente para una molécula o ion, la estructura real es el promedio de las estructuras de resonancia.
El Ion Carbonato (\(CO_3^{2−} \))
Al igual que el ozono, la estructura electrónica del ion carbonato no puede ser descrita por una sola estructura de electrones de Lewis. Sin embargo, a diferencia de O 3, la estructura real del CO 3 2 − es un promedio de tres estructuras de resonancia.
1. Debido a que el carbono es el elemento menos electronegativo, lo colocamos en la posición central:
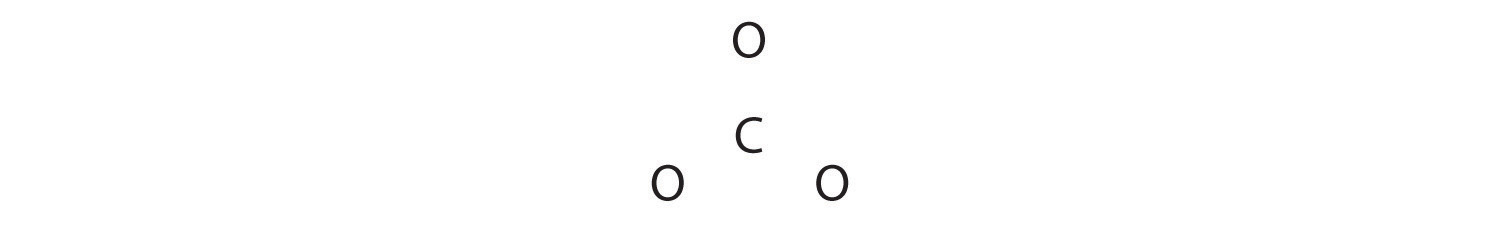
2. El carbono tiene 4 electrones de valencia, cada oxígeno tiene 6 electrones de valencia, y hay 2 más para la carga −2. Esto da 4 + (3 × 6) + 2 = 24 electrones de valencia.
3. Se utilizan seis electrones para formar tres pares de enlaces entre los átomos de oxígeno y el carbono:
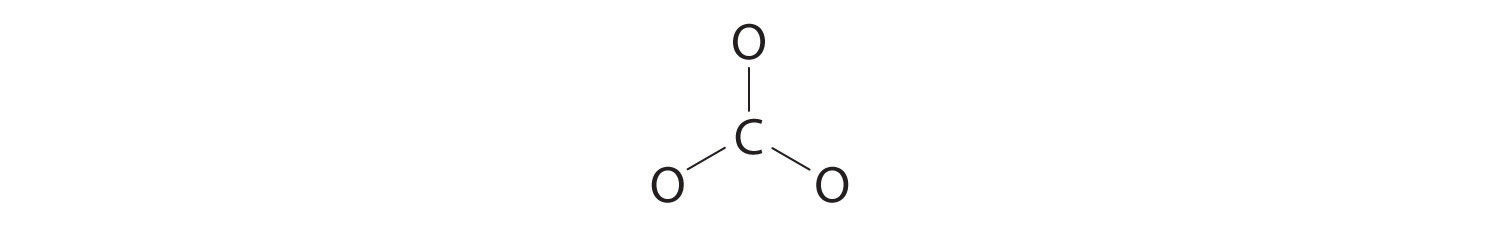
4. Dividimos los 18 electrones restantes por igual entre los tres átomos de oxígeno colocando tres pares solitarios en cada uno e indicando la carga −2:
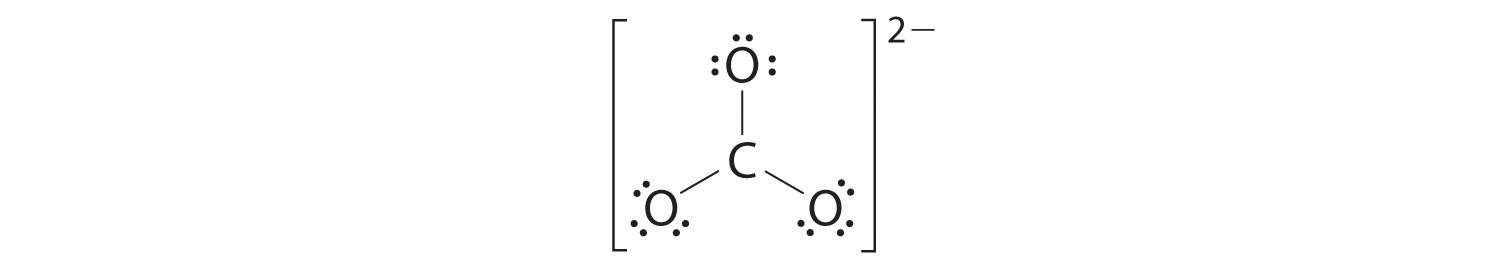
5. No quedan electrones para el átomo central.
6. En este punto, el átomo de carbono tiene solo 6 electrones de valencia, por lo que debemos tomar un par solitario de un oxígeno y usarlo para formar un doble enlace carbono-oxígeno. En este caso, sin embargo, hay tres opciones posibles:
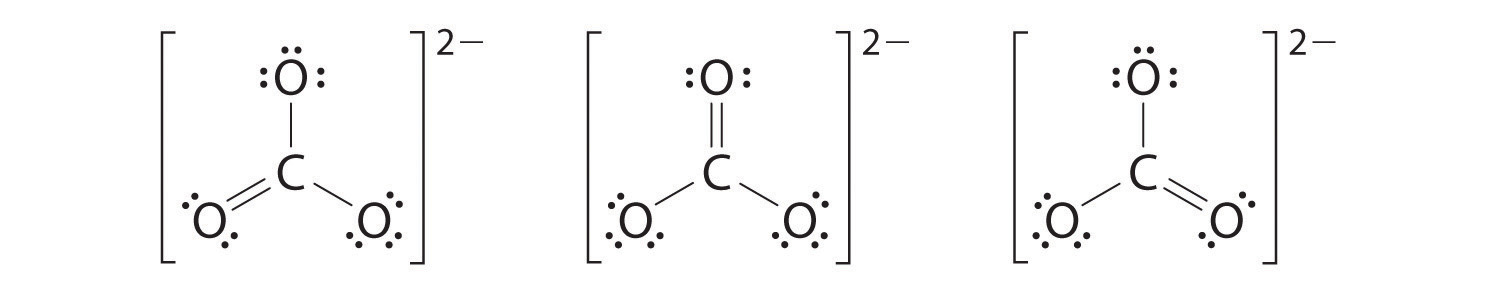
Al igual que con el ozono, ninguna de estas estructuras describe exactamente la unión. Cada uno predice un doble enlace carbono-oxígeno y dos enlaces simples carbono-oxígeno, pero experimentalmente todas las longitudes de enlace C—O son idénticas. Podemos escribir estructuras de resonancia (en este caso, tres de ellas) para el ion carbonato:
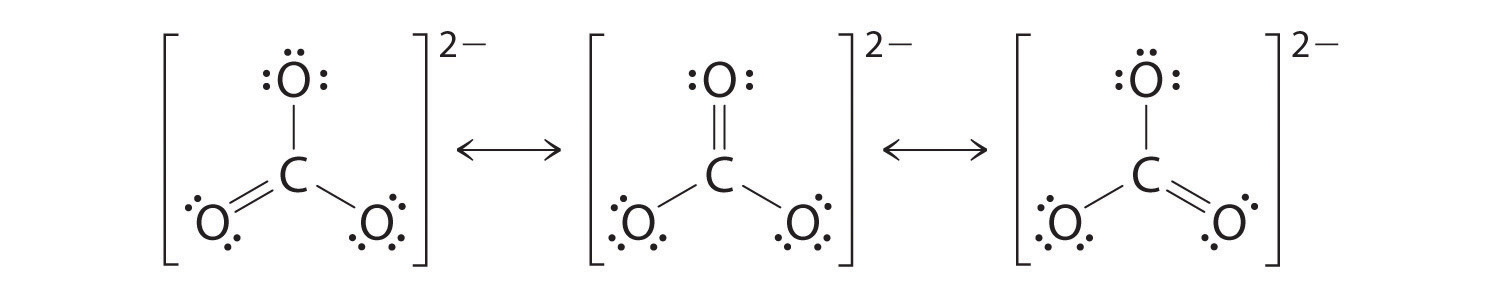
La estructura real es un promedio de estas tres estructuras de resonancia.
El ion Nitrato (\(NO_3^-\))
1. Cuenta hacia arriba los electrones de valencia: (1*5) + (3*6) + 1 (ion) = 24 electrones
2. Dibuja las conectividades de enlace:
3. Agregue electrones de octeto a los átomos unidos al átomo central:
4. Coloque los electrones sobrantes (24-24 = 0) en el átomo central:
5. ¿El átomo central tiene un octeto?
- NO, tiene 6 electrones
- Agrega un enlace múltiple (primero prueba un doble enlace) para ver si el átomo central puede lograr un octeto:
6. ¿El átomo central tiene un octeto?
- SÍ
- ¿Existen posibles estructuras de resonancia? SI
Nota: Se esperaría que las longitudes de enlace en el\(\ce{NO_3^{-}}\) ion sean algo más cortas que un enlace sencillo.
El benceno es un solvente orgánico común que anteriormente se usaba en la gasolina; sin embargo, ya no se usa para este propósito porque ahora se sabe que es carcinógeno. La molécula de benceno (\(\ce{C6H6}\)) consiste en un hexágono regular de átomos de carbono, cada uno de los cuales también está unido a un átomo de hidrógeno. Utilizar estructuras de resonancia para describir la unión en benceno.
Dado: fórmula molecular y geometría molecular
Preguntado por: estructuras de resonancia
Estrategia:
- Dibuje una estructura para benceno que ilustre los átomos unidos. Después calcule el número de electrones de valencia utilizados en este dibujo.
- Restar este número del número total de electrones de valencia en benceno y luego ubicar los electrones restantes de tal manera que cada átomo en la estructura alcance un octeto.
- Dibujar las estructuras de resonancia para benceno.
Solución:
A Cada átomo de hidrógeno aporta 1 electrón de valencia, y cada átomo de carbono aporta 4 electrones de valencia, para un total de (6 × 1) + (6 × 4) = 30 electrones de valencia. Si colocamos un par de electrones de enlace único entre cada par de átomos de carbono y entre cada carbono y un átomo de hidrógeno, obtenemos lo siguiente:
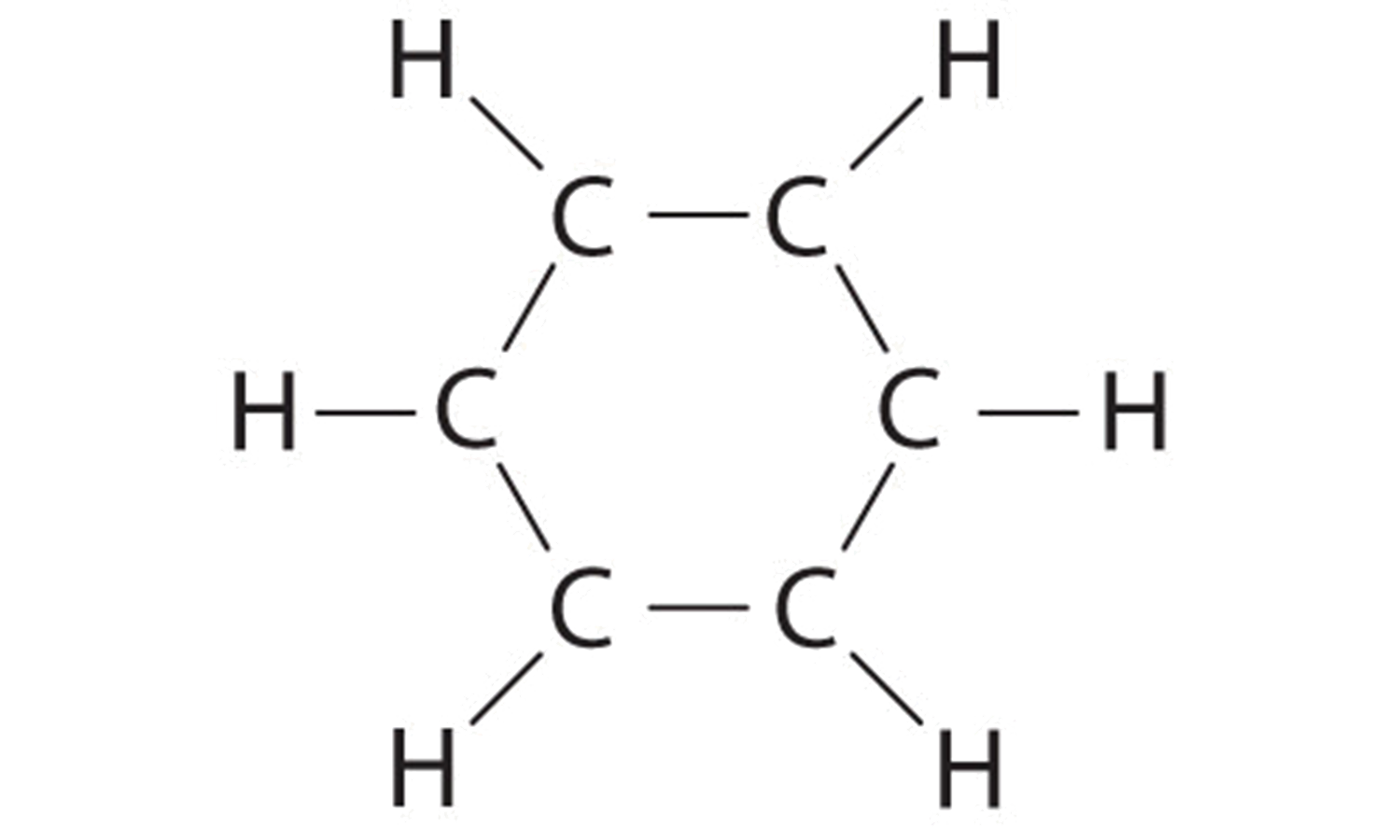
Cada átomo de carbono en esta estructura tiene sólo 6 electrones y tiene una carga formal de +1, pero solo hemos utilizado 24 de los 30 electrones de valencia.
B Si los 6 electrones restantes están distribuidos uniformemente por pares en átomos de carbono alternos, obtenemos lo siguiente:
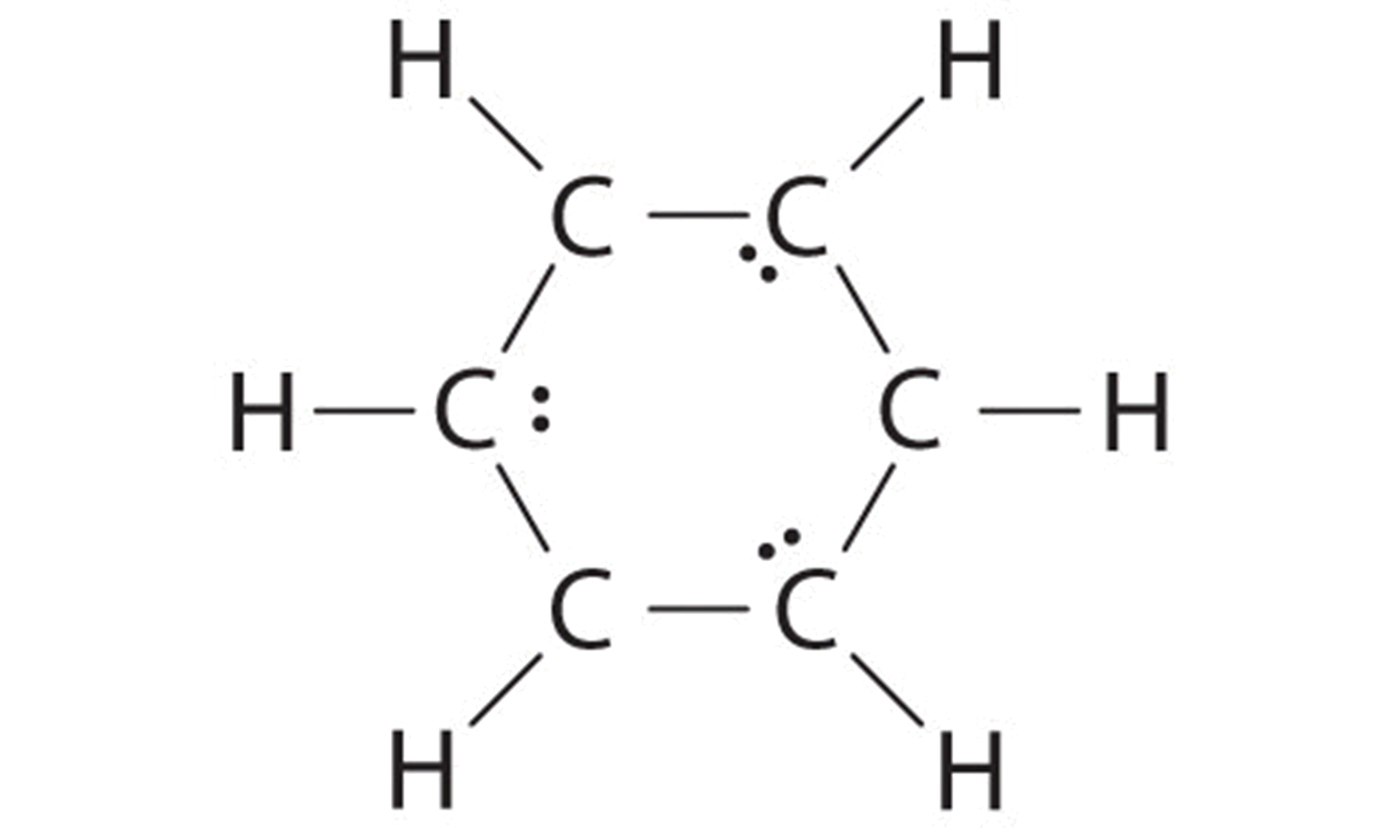
Tres átomos de carbono tienen ahora una configuración de octeto y una carga formal de −1, mientras que tres átomos de carbono tienen solo 6 electrones y una carga formal de +1. Podemos convertir cada par solitario en un par de electrones de enlace, lo que le da a cada átomo un octeto de electrones y una carga formal de 0, haciendo tres dobles enlaces C=C.
C Sin embargo, hay dos formas de hacerlo:
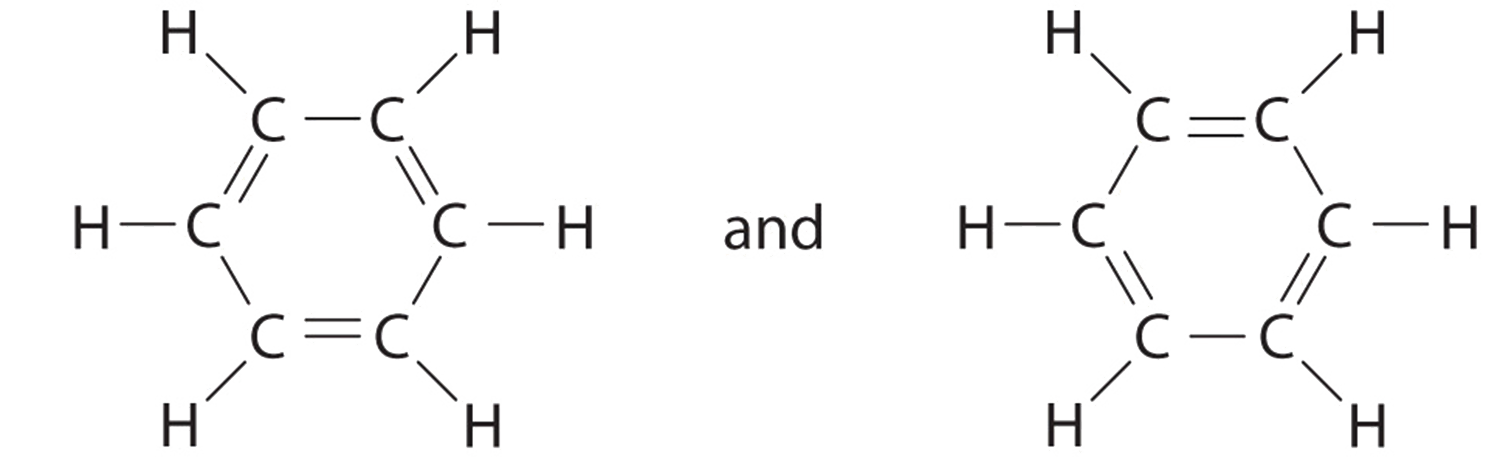
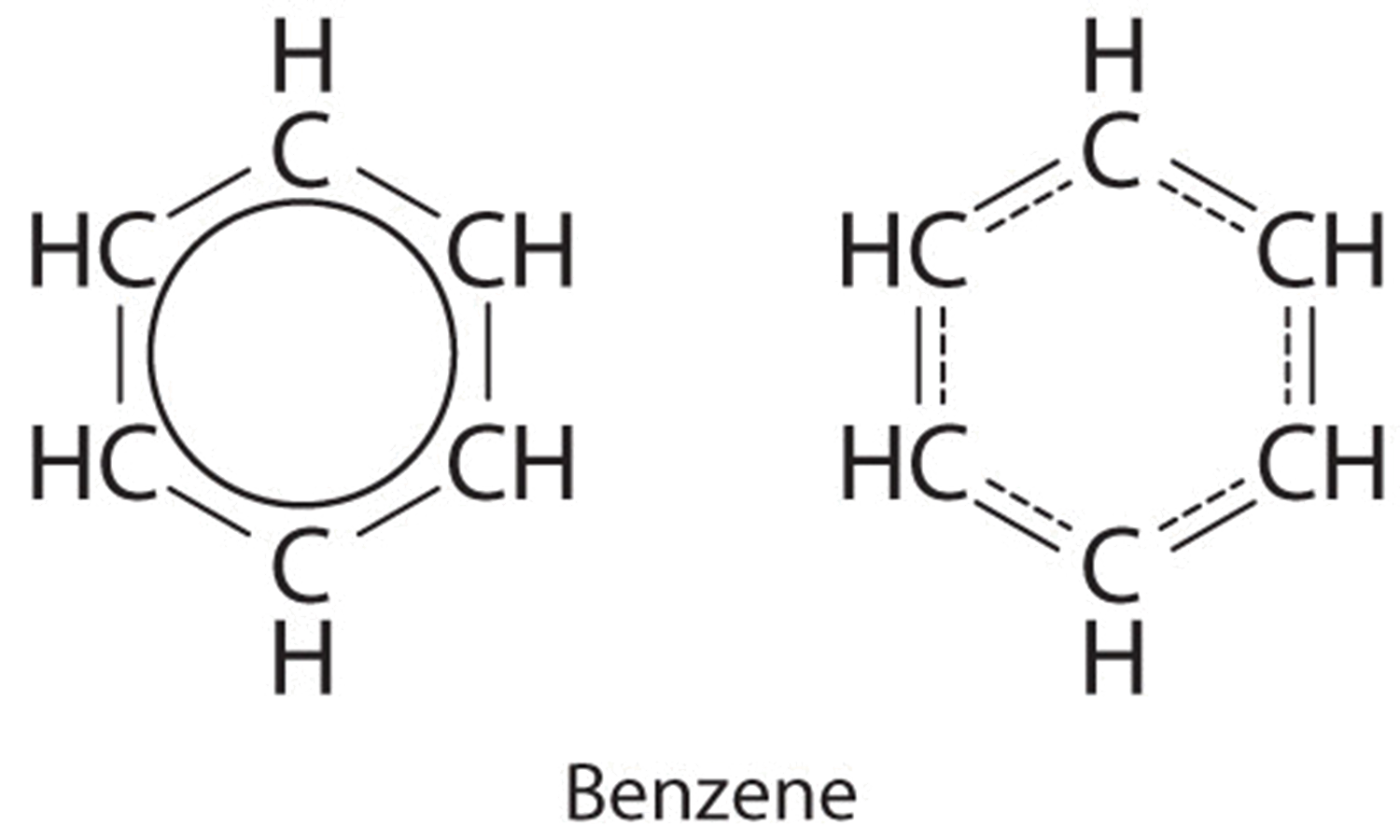
Cada estructura tiene enlaces dobles y simples alternantes, pero la experimentación muestra que cada enlace carbono-carbono en benceno es idéntico, con longitudes de enlace (139.9 pm) intermedias entre las que se encuentran típicamente para un enlace sencillo C—C (154pm) y un doble enlace C=C (134pm). Podemos describir la unión en benceno usando las dos estructuras de resonancia, pero la estructura electrónica real es un promedio de las dos. La existencia de múltiples estructuras de resonancia para hidrocarburos aromáticos como el benceno a menudo se indica dibujando un círculo o líneas discontinuas dentro del hexágono:
La sal sódica del nitrito se utiliza para aliviar los espasmos musculares. Dibuje dos estructuras de resonancia para el ion nitrito (NO 2 −).
- Responder
-
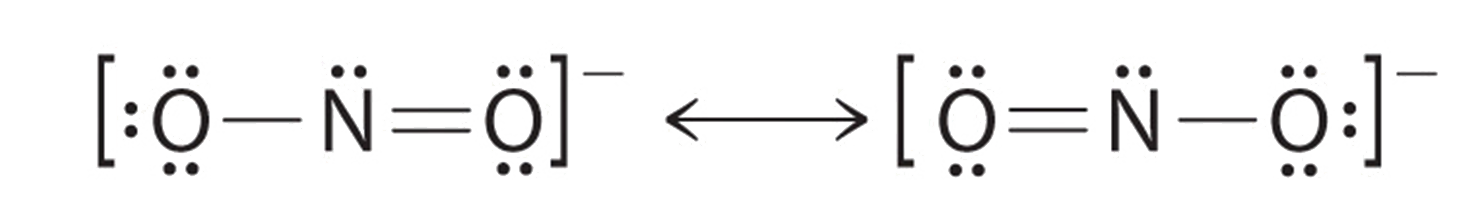
Existe un doble enlace entre un oxígeno y el nitrógeno, Se puede encontrar en el oxígeno izquierdo o en el oxígeno derecho. Las estructuras de resonancia son particularmente comunes en los oxoaniones de los elementos del bloque p, como el sulfato y el fosfato, y en los hidrocarburos aromáticos, como el benceno y el naftaleno.
Si existen varias formas de resonancia razonables para una molécula, la “estructura electrónica real” de la molécula probablemente será intermedia entre todas las formas que puedas dibujar. El ejemplo clásico es el benceno en Ejemplo\(\PageIndex{1}\). Uno esperaría que los dobles enlaces fueran más cortos que los enlaces simples, pero si uno superpone las dos estructuras, se ve que una estructura tiene un enlace sencillo donde la otra estructura tiene un doble enlace. Las mejores medidas que podemos hacer del benceno no muestran dos longitudes de enlace, sino que muestran que la longitud del enlace es intermedia entre las dos estructuras de resonancia.
Las estructuras de resonancia son un mecanismo que nos permite utilizar todas las estructuras de resonancia posibles para tratar de predecir cuál sería la forma real de la molécula. Los enlaces simples, dobles enlaces, triples enlaces, +1 cargas, -1 cargas, estas son nuestras limitaciones para explicar las estructuras, y las verdaderas formas pueden estar en el medio: un enlace carbono-carbono podría ser principalmente un enlace sencillo con un poco de carácter de doble enlace y una carga negativa parcial, por ejemplo.
Resumen
Algunas moléculas tienen dos o más estructuras de electrones de Lewis químicamente equivalentes, llamadas estructuras de resonancia. La resonancia es un ejercicio mental y método dentro de la Teoría de Enlace de Valencia que describe la deslocalización de electrones dentro de las moléculas. Estas estructuras están escritas con una flecha de dos puntas entre ellas, lo que indica que ninguna de las estructuras de Lewis describe con precisión la unión sino que la estructura real es un promedio de las estructuras de resonancia individuales. Las estructuras de resonancia se utilizan cuando una estructura de Lewis para una sola molécula no puede describir completamente el enlace que tiene lugar entre los átomos vecinos en relación con los datos empíricos para las longitudes de enlace reales entre esos átomos. La suma neta de estructuras de resonancia válidas se define como un híbrido de resonancia, que representa la deslocalización global de electrones dentro de la molécula. Una molécula que tiene varias estructuras de resonancia es más estable que una con menos. Algunas estructuras de resonancia son más favorables que otras.

