5.1.1: Orbitales Moleculares de Orbitales s
- Page ID
- 80998
Enlace Sigma con orbitales s (por ejemplo: Dihidrógeno)
En el caso de la molécula de hidrógeno, tomamos dos orbitales atómicos y los combinamos para formar dos orbitales moleculares. Estos nuevos orbitales moleculares tenían diferentes longitudes de onda que los dos orbitales atómicos: uno tenía una longitud de onda más larga y era un poco menor en energía, mientras que el otro tenía una longitud de onda más corta y era un poco mayor en energía. Si tomamos en cuenta la energía de las dos funciones de onda atómicas originales, y las comparamos con la energía total de las dos nuevas funciones de onda molecular, no hay ningún cambio general.
Comenzamos con dos orbitales atómicos, y combinándolos producimos dos orbitales moleculares. Ambas ideas son útiles para considerar la formación de moléculas más complejas a partir de átomos individuales.
-
- La energía promedio de los orbitales se ha mantenido casi constante.
- Además, el número de funciones de onda se ha mantenido constante.
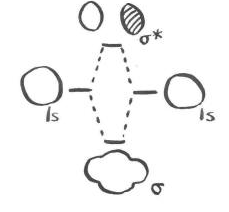
Por supuesto, desde el punto de vista de los dos electrones reales, se han producido algunos cambios notables. Ambos electrones han adoptado una longitud de onda más larga y una energía más baja y eso ha marcado toda la diferencia. Hay un orbital molecular ocupado y otro orbital molecular desocupado; solo el orbital ocupado hace una contribución energética real a la estabilidad general de la molécula. El orbital desocupado es completamente imaginario.
Una imagen de unión de He 2 se vería exactamente igual, porque también implicaría la superposición de electrones 1s en un átomo con electrones 1s en el otro átomo. Habría una energía electrónica diferente, sin embargo. Esa diferencia afectaría las perspectivas de formación de enlaces helio y helio.
- Los electrones tienen menor energía cinética en el enlace que tenían antes de la unión.
- La energía electrónica ha disminuido. Se ha formado un enlace estable.
Construir diagramas orbitales moleculares para las siguientes especies diatómicas y discutir la probabilidad de formación de enlaces en cada caso.
- Él 2.
- Li 2.
- Ser 2.
- Responder
-


