5.1.2: Orbitales Moleculares de Orbitales p
- Page ID
- 80996
Vinculación con orbitales P
Vinculación sigma con orbitales p
Otras moléculas diatómicas en la esquina superior derecha de la tabla periódica se pueden construir de manera similar. Mira dinitrogen, N 2.
Podemos pensar en cómo se formaría el dinitrógeno si se colocaran dos átomos de nitrógeno lo suficientemente cerca como para compartir electrones. El nitrógeno tiene más electrones que hidrógeno, por lo que esta interacción es más complicada.
En nuestro examen cualitativo de la unión en diatómicas de grupos principales, tomaremos el enfoque utilizado en las estructuras de Lewis y solo veremos los electrones de valencia. Un cálculo orbital molecular cuantitativo con una computadora no tomaría este atajo, sino que incluiría todos los electrones en los átomos que se unen entre sí.
El nitrógeno tiene cinco electrones de valencia, y estos electrones se encuentran en los niveles 2s y 2p. Hay tres posibles orbitales atómicos en el nivel 2p donde se pudieron encontrar algunos de estos electrones: p x, p y p z. Necesitamos observar la interacción entre los orbitales s y p x, p y p z en un átomo de nitrógeno con los orbitales s y p x, p y p z en el otro nitrógeno. Ese proceso podría ser extremadamente complicado, pero:
- Las interacciones orbitales se rigen por la simetría.
Los orbitales interactúan más fácilmente con otros orbitales que tienen el mismo elemento de simetría. Por ahora, podemos simplificar y decir que los orbitales en un átomo sólo interactúan con el mismo tipo de orbitales en el otro átomo.
- s orbitales interactúan con s orbitales. Ya podemos ver cómo va a funcionar eso en dinitrogen, porque eso es lo que pasó en dihidrógeno.
- p x orbitales interactúan con p x orbitales.
- Los orbitales p y interactúan con los orbitales p y.
- Los orbitales p z interactúan con los orbitales p z.
Otra complicación aquí es que los orbitales s y p no arrancan en el mismo nivel de energía. Cuando los orbitales se mezclan, una combinación sube en energía y otra baja. ¿La combinación s antiadhesión va más alta en energía que las combinaciones de p orbitales? ¿Las combinaciones de unión p van más bajas en energía que las combinaciones de s orbitales? Simplificaremos y asumiremos que los niveles s y p permanecen completamente separados entre sí. Esto no siempre es cierto, pero la situación varía dependiendo de qué átomos estemos tratando.
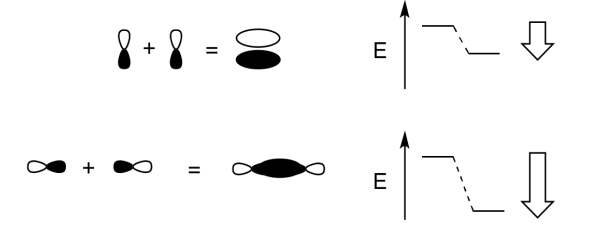
- La combinación de uno s orbital con otro es igual que en hidrógeno. Dos orbitales originales se combinarán y reorganizarán para producir dos nuevos orbitales.
- Existe una combinación de unión en la que los orbitales están en fase. El nuevo orbital producido tiene una longitud de onda más larga que la orbital original. Es menor en energía.
- Existe una combinación antiadhesión en la que los orbitales están desfasados. El nuevo orbital producido tiene una longitud de onda más corta que la orbital original. Es mayor en energía.
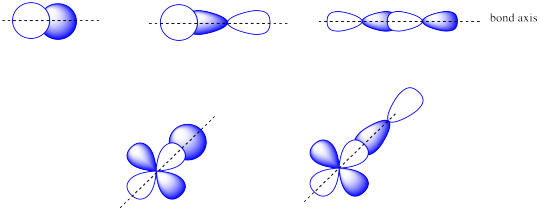
Al considerar la interacción de dos orbitales p, hay que tener en cuenta que los orbitales p son direccionales. Un orbital p se encuentra a lo largo de un eje particular: x, y o z. Los tres orbitales p sobre nitrógeno son todos mutuamente perpendiculares (u ortogonales) entre sí. Esa situación contrasta con los orbitales s, que son esféricos y así se ven igual desde cualquier dirección.
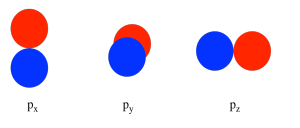
Primero necesitamos definir un eje como tendido a lo largo del enlace N-N. Realmente no importa cuál. Decimos arbitrariamente que el enlace N-N se encuentra a lo largo del eje z. Los orbitales p z tienen una relación espacial diferente entre sí en comparación con los p y y p x. Los orbitales p z se encuentran a lo largo del eje del enlace, mientras que los p y y p x son ortogonales a él.
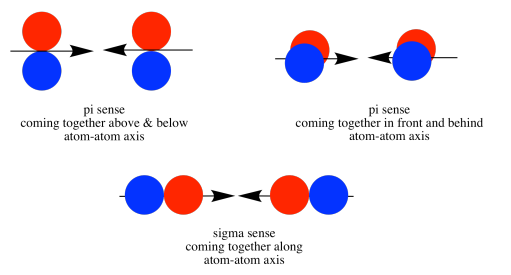
A medida que los átomos de nitrógeno se juntan, un lóbulo en un orbital p z se solapa fuertemente con un lóbulo en el otro orbital p z. Los otros lóbulos se alejan entre sí y no interactúan de ninguna manera obvia.
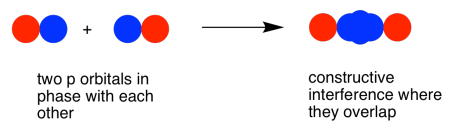
Al igual que con el orbital s, los orbitales p z pueden estar en fase o fuera de fase. La combinación en fase da como resultado interferencia constructiva. (Aquí, “en fase” significa que los lóbulos que se superponen están en fase; para que eso suceda, los dos orbitales p están en realidad completamente desfasados entre sí matemáticamente, de modo que un orbital es la imagen especular del otro). Esta combinación tiene una longitud de onda más larga que la orbital original. Es una combinación de menor energía.
La combinación fuera de fase (lo que significa en este caso que los lóbulos superpuestos están desfasados) resulta en interferencia destructiva. Esta combinación tiene una longitud de onda más corta que la orbital original. Es una combinación de mayor energía.
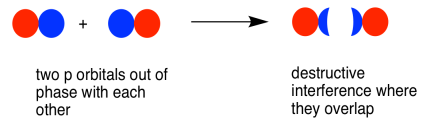
Como resultado, tenemos dos combinaciones diferentes derivadas de dos orbitales p diferentes que se unen de dos maneras diferentes. Obtenemos una combinación de unión de baja energía, en fase y una combinación antiadhesión de alta energía, fuera de fase.
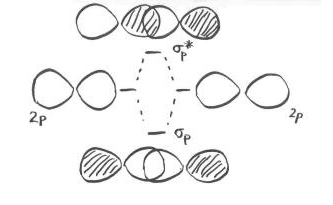
¿Y esos otros orbitales p, los que no se encuentran a lo largo del eje de enlace? Vamos a echar un vistazo a ese problema en la página siguiente.
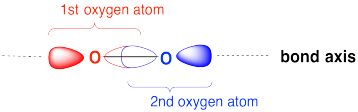
Dibujar una caricatura MO de un orbital de unión sigma formado por la superposición de dos orbitales p entre dos átomos de oxígeno. Etiquetar las posiciones de los núcleos de oxígeno con el símbolo “O”. Etiquete el eje de unión O-O.
- Contestar
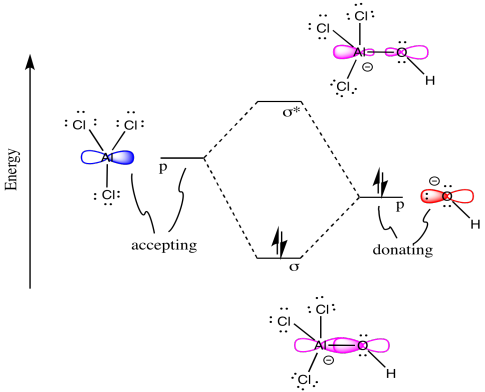
¡Las reacciones químicas también se pueden describir mediante diagramas MO! Considera la siguiente reacción en la que se forma un nuevo enlace sigma.

Dibuja un diagrama MO para la reacción anterior. Es decir, comenzar desde el MO de una frontera en cada reactivo para construir los MO del nuevo enlace sigma en el producto.
o Dibujar el orbital de la base (hidróxido) que es probable que done sus electrones.
o Dibuja el orbital del ácido (cloruro de aluminio) que es probable que acepte electrones.
o Complete el diagrama de mezcla MO de estos dos orbitales:
• Etiquetar el orbital donador de electrones
• Marcar el orbital aceptor de electrones
• Rellenar el diagrama de mezcla MO con electrones
o Dibuja una caricatura que muestre cada reactivo y producto MO que contribuya a la interacción de unión.
- Contestar
Unión PI con orbitales p
Anteriormente, vimos que p orbitales que se encuentran a lo largo del mismo eje pueden interactuar para formar enlaces.
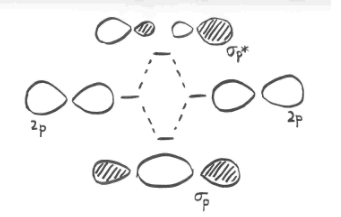
Los orbitales p paralelos, pero no colineales, también pueden interactuar entre sí. Se acercarían uno al otro lado del otro, por encima y por debajo del eje de enlace entre los dos átomos. Pueden estar lo suficientemente cerca entre sí como para solaparse, aunque no se superponen tan fuertemente como los orbitales que se encuentran a lo largo del eje del enlace. Pueden hacer una combinación en fase, como se muestra a continuación.
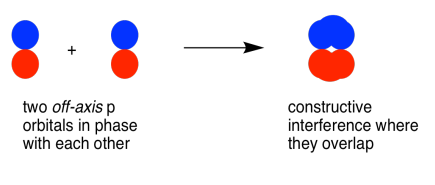
También podrían hacer una combinación fuera de fase, como se muestra a continuación.
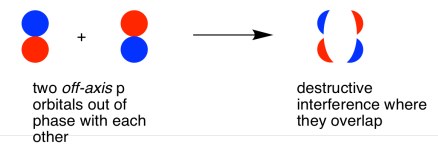
- los orbitales p paralelos pueden superponerse para producir combinaciones de unión y antiadhesión.
- los orbitales resultantes contienen nodos a lo largo del eje de enlace.
- la densidad electrónica se encuentra por encima y por debajo del eje del enlace.
- esto se llama un enlace p (pi).
La ilustración anterior es para un conjunto de p orbitales que son ortogonales al eje de enlace. La segunda imagen muestra el resultado de la interferencia constructiva (o destructiva). Se podría mostrar una imagen similar para el otro conjunto de orbitales p.
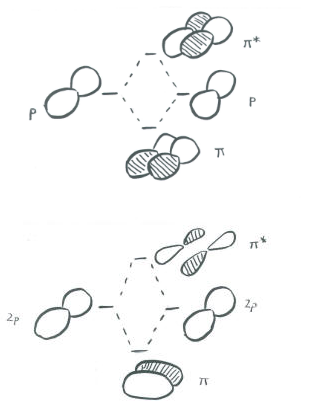
En un grupo principal especies diatómicas como dinitrógeno, un orbital p que se extiende a lo largo del eje de enlace puede participar en la unión s. Los dos orbitales p ortogonales al eje de unión pueden acoplarse en la unión p. Habrá combinaciones tanto de unión como de antiadhesión.
Así como los orbitales de unión sigma muestran longitudes de onda progresivamente más cortas a lo largo del eje de unión a medida que van a mayor energía, también lo hacen los orbitales de unión pi. En otras palabras, hay más nodos en los orbitales de mayor energía que en los de menor energía.
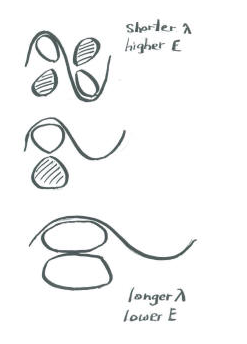
Una consecuencia importante de la distribución espacial o “forma” de un orbital p es que no es simétrica con respecto al eje de enlace. Un orbital s no se ve afectado cuando el átomo en un extremo del enlace se gira con respecto al otro. Un orbital p se ve afectado por tal rotación. Si un átomo gira con respecto al otro, el orbital p tendría que estirarse para mantener la conexión. Los orbitales no serían capaces de superponerse, por lo que se perdería la conexión entre los átomos.
Las combinaciones de ______________ orbitales atómicos conducen a orbitales σ.
Dibuja imágenes.
- Contestar
-
Las combinaciones de s + s OR s + p OR p + p OR s + d OR p + d orbitales atómicos pueden conducir a orbitales σ.
Las combinaciones de ______________ orbitales atómicos conducen a π orbitales.
Dibuja imágenes.
- Contestar
-
Las combinaciones de orbitales atómicos lado a lado p + p o p + d conducen a orbitales π.

¿Cuál orbital molecular es típicamente el más alto en energía?
a. p
b. σ
c. π*
d. π
e. σ*
- Contestar
-
e) σ*
¿Por qué un núcleo orbital 1s no interactuaría con un orbital de valencia 2s?
Pista: ¿Por qué un enlace Li 2 O es más fuerte que un enlace K 2 O?
- Contestar
-
Li + y O 2- son más similares en tamaño que K + y O 2-, por lo que el enlace entre Li + y O 2- es más fuerte.
La diferencia energética entre cualquier orbitales centrales y orbitales de valencia es demasiado grande, por lo que no pueden interactuar. Para que los orbitales interactúen, los orbitales necesitan tener la misma simetría, estar en el mismo plano, y ser similares en energía.
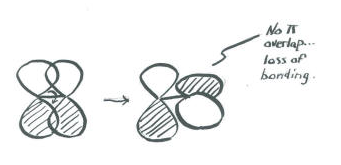
Agrega algunas palabras para explicar las ideas que se transmiten en estos dibujos.
- Contestar
-
Cuando dos orbitales p paralelos se combinan fuera de fase, se produce interferencia destructiva.
Hay un nodo entre los átomos.
La energía de los electrones aumenta.
Cuando dos orbitales p paralelos se combinan en fase, se produce interferencia constructiva.
No hay ningún nodo entre los átomos; los electrones se encuentran por encima y por debajo del eje que conecta los átomos.
La energía de los electrones disminuye.
Atribución
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John's University)
Modified by Kathryn Haas (khaaslab.com)

