5.1.4: Orbitales no unidos y otros factores
- Page ID
- 81011
El caso más simple es cuando hay un número par de orbitales atómicos que todos se combinan para formar orbitales fuertes de unión y antiadhesión. Pero, ¿y si hay un número desigual de orbitales atómicos? ¿O qué pasa si hay algunos orbitales que no cumplen con los criterios de vinculación? ¿O qué pasa si las interacciones de vinculación son débiles? En estos casos, habrá orbitales moleculares sobre la molécula que tengan carácter de no unión.
Es importante señalar que la naturaleza de unión, no unión y antiadhesión de los orbitales existe en un espectro. Algunos orbitales de unión y antiunión pueden tener algún carácter de no unión dependiendo de dónde se encuentren sus energías con respecto a las energías orbitales atómicas originales. Cuando los orbitales moleculares tengan energías similares a sus orbitales atómicos originales, tendrán algún carácter no ligado. Cuanto más cerca están las energías de los orbitales atómicos y moleculares, más no se unen los orbitales moleculares.
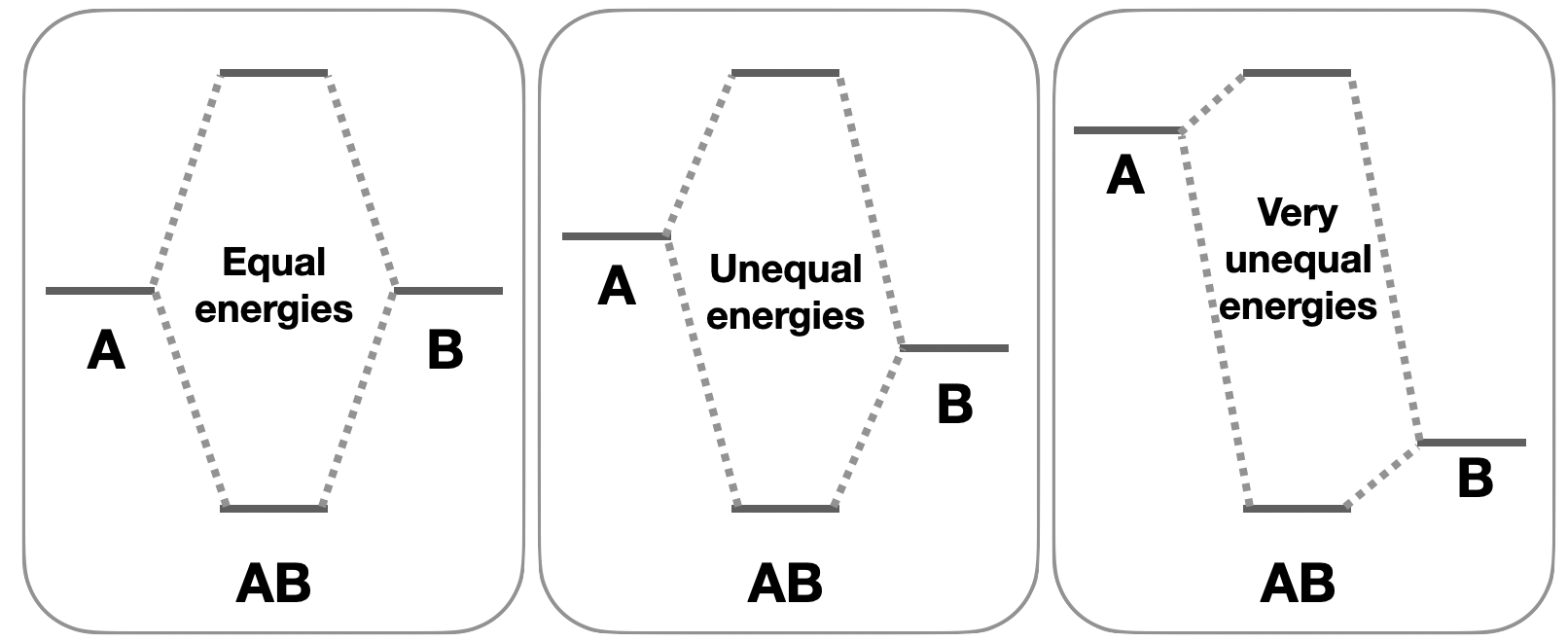
Número desigual de orbitales atómicos: En el caso de que exista un número desigual de orbitales atómicos con simetría compatible, se formarán orbitales con carácter no ligado. Por ejemplo, en el caso en que tres orbitales atómicos se combinan, el resultado más común es la formación de un orbital de unión de baja energía, un orbital antiadhesión de alta energía y un orbital sin unión de energía intermedia (Figura\(\PageIndex{1}\)).
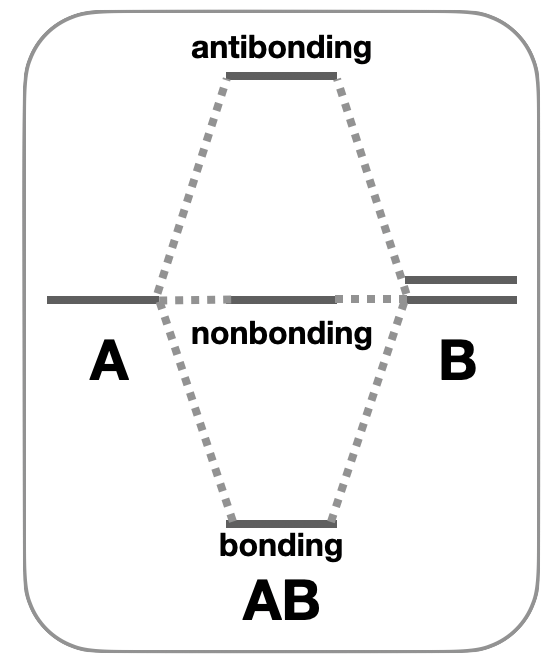
Diferencias en la energía: La combinación de orbitales con diferentes energías puede conducir a orbitales con carácter no ligado. Los orbitales atómicos que tienen energías similares tendrán las interacciones más fuertes, y resultarán en la unión de orbitales moleculares con energías mucho más bajas que los orbitales atómicos componentes. Por otro lado, los orbitales atómicos con energías muy desiguales tienen una interacción más débil debido a que los orbitales moleculares están más cerca en energía a las energías orbitales atómicas, por lo que hay menos beneficio energético al poner electrones en los orbitales moleculares de unión (Figura\(\PageIndex{2}\)). Cuando los orbitales de unión o antiunión están cerca de las energías de los orbitales atómicos contribuyentes, esos orbitales moleculares pueden tener algún carácter de no unión.