5.1.3: Orbitales moleculares a partir de orbitales d
- Page ID
- 81012
En los metales de transición y otros elementos más pesados, los\(d\) orbitales pueden combinarse con otros orbitales de simetría (y energía) compatibles para formar orbitales moleculares. Generalmente, hay tres tipos de interacciones de unión y antiunión que pueden ocurrir con\(d\) orbitales: enlaces sigma (\(\sigma\)), pi (\(\pi\)) y delta (\(\delta\)).
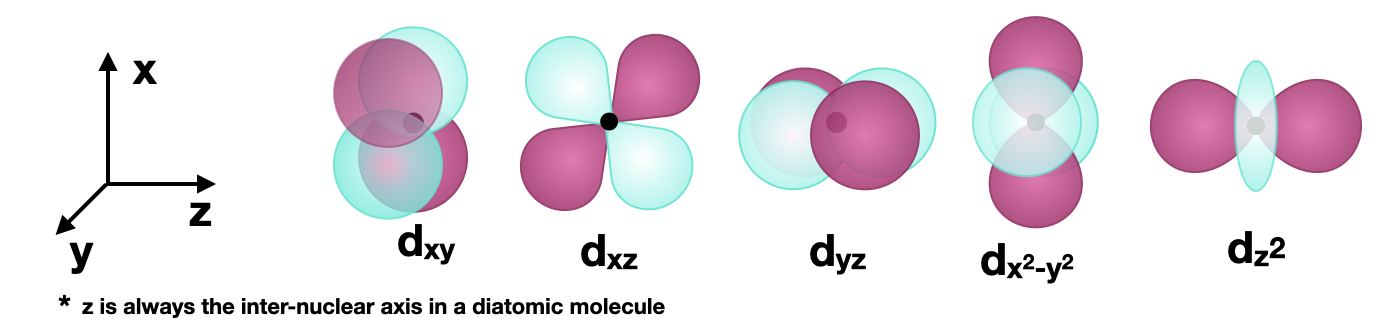 Figura\(\PageIndex{1}\): Se muestran los cinco\(3d\) orbitales. La orientación de los ejes es consistente y el\(z\) eje es horizontal para mayor comodidad al dibujar la unión a lo largo del\(z\) eje (ver ejemplos a continuación). (CC-BY-SA; Kathryn Haas)
Figura\(\PageIndex{1}\): Se muestran los cinco\(3d\) orbitales. La orientación de los ejes es consistente y el\(z\) eje es horizontal para mayor comodidad al dibujar la unión a lo largo del\(z\) eje (ver ejemplos a continuación). (CC-BY-SA; Kathryn Haas)Sigma (\(\sigma\)) vinculación con\(d\) orbitales
\(\sigma\)los enlaces son simétricos con respecto al eje internuclear (en una molécula diatómica, este es el\(z\) eje). Un ejemplo de un\(\sigma\) vínculo formado por\(d\) orbitales es el de dos\(d_{z^2}\) orbitales (ver Figura\(\PageIndex{2}\)). Si un átomo unido está en una posición distinta a la del\(z\) eje (en una geometría octaédrica, por ejemplo), también se pueden formar\(\sigma\) enlaces. Por ejemplo, dos\(d_{x^2-y^2}\) orbitales en átomos unidos a lo largo de\(y\) los ejes\(x\) o también podrían formar un\(\sigma\) enlace.
\(d\)los orbitales también pueden formar\(\sigma\) vínculos con otros tipos de orbitales con la simetría apropiada. Ejemplos de orbitales con simetría apropiada son los\(s\) orbitales y ciertos\(p\) orbitales en otro átomo, como se muestra a continuación en la Figura\(\PageIndex{2}\).
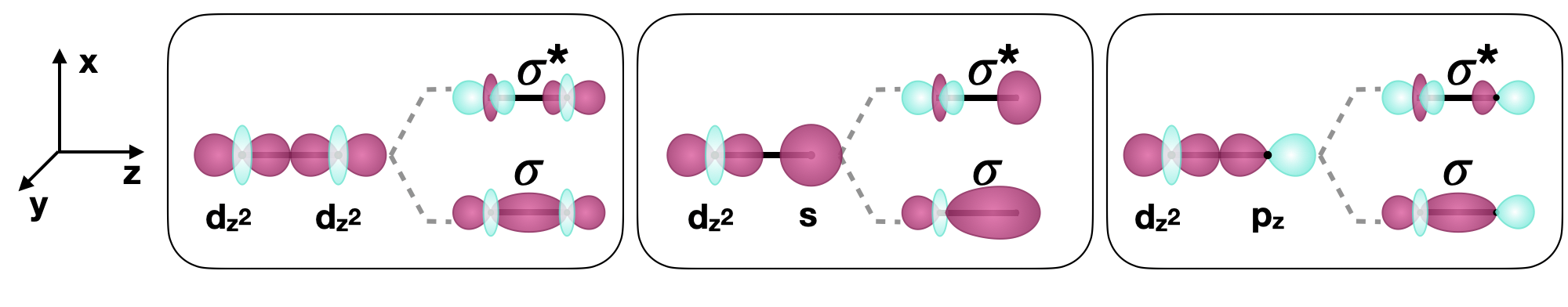 Figura\(\PageIndex{2}\): Ejemplos seleccionados de\(\sigma\) enlaces que involucran\(d\) orbitales a lo largo del eje\(z\) internuclear (mostrados como una línea horizontal en negrita) entre dos átomos. (CC-BY-SA; Kathryn Haas)
Figura\(\PageIndex{2}\): Ejemplos seleccionados de\(\sigma\) enlaces que involucran\(d\) orbitales a lo largo del eje\(z\) internuclear (mostrados como una línea horizontal en negrita) entre dos átomos. (CC-BY-SA; Kathryn Haas)Vinculación Pi (\(\pi\)) con\(d\) orbitales
\(\pi\)son aquellos con un nodo que está en el plano con el eje internuclear. Se puede formar un\(\pi\) vínculo entre dos\(d\) orbitales o entre\(d\) orbitales y otros tipos de orbitales con simetría comparable. Un ejemplo de un\(\pi\) vínculo entre dos\(d\) orbitales es el formado por dos\(d_{xz}\) orbitales a lo largo del\(z\) eje (mostrado en la Figura\(\PageIndex{3}\)). \(d\)los orbitales también pueden formar\(\pi\) enlaces usando\(p\) orbitales con simetría compatible, como se muestra en la Figura\(\PageIndex{3}\).
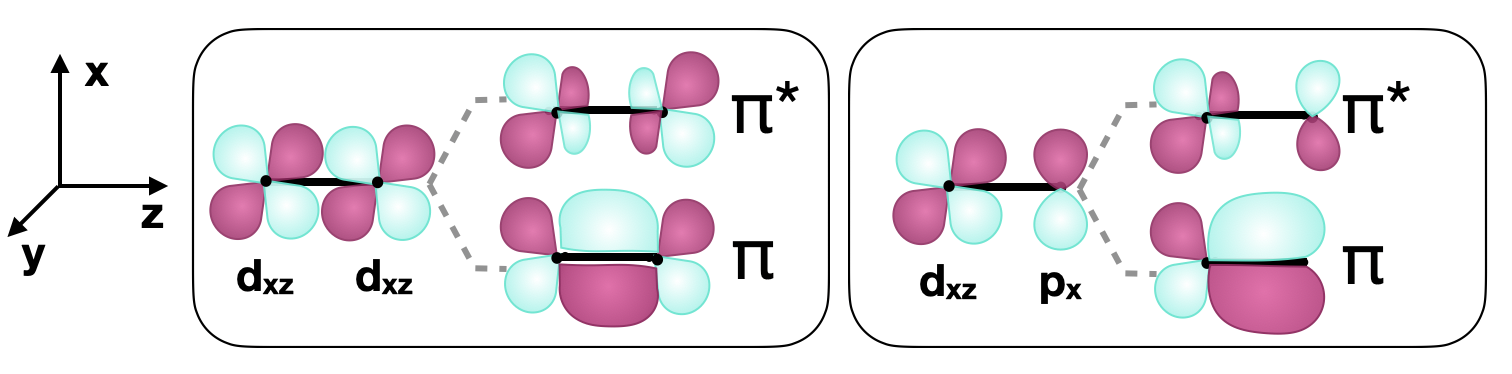
Vinculación delta (\(\delta\)) con\(d\) orbitales
\(\delta \)son aquellos con dos nodos que están en el plano con el eje internuclear. \(\delta\)se pueden formar vínculos entre dos\(d\) orbitales con la simetría apropiada. Por ejemplo, cuando dos átomos se unen a lo largo del\(z\) eje, los\(d_{xy}\) orbitales y los dos\(d_{x^2-y^2}\) orbitales pueden formar\(\delta\) enlaces (Figura\(\PageIndex{4}\)).
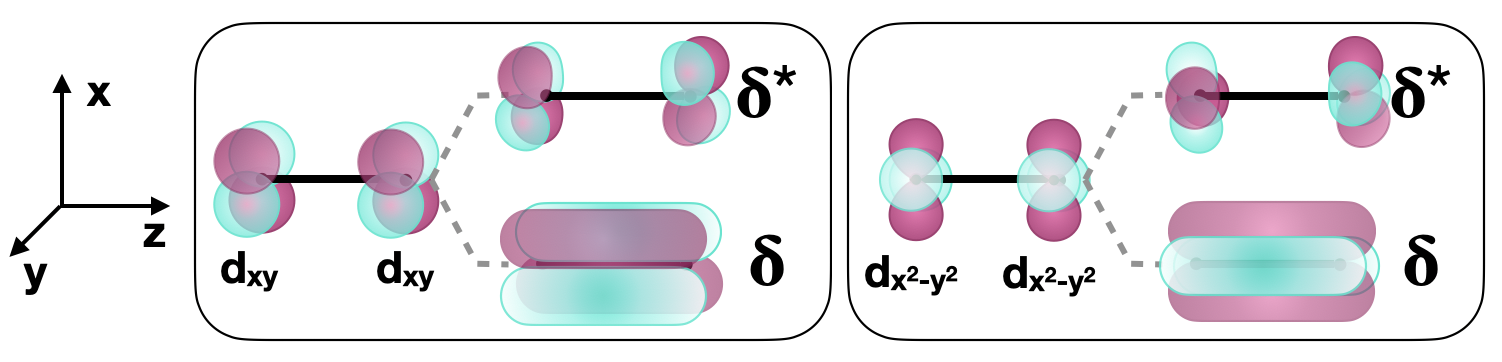
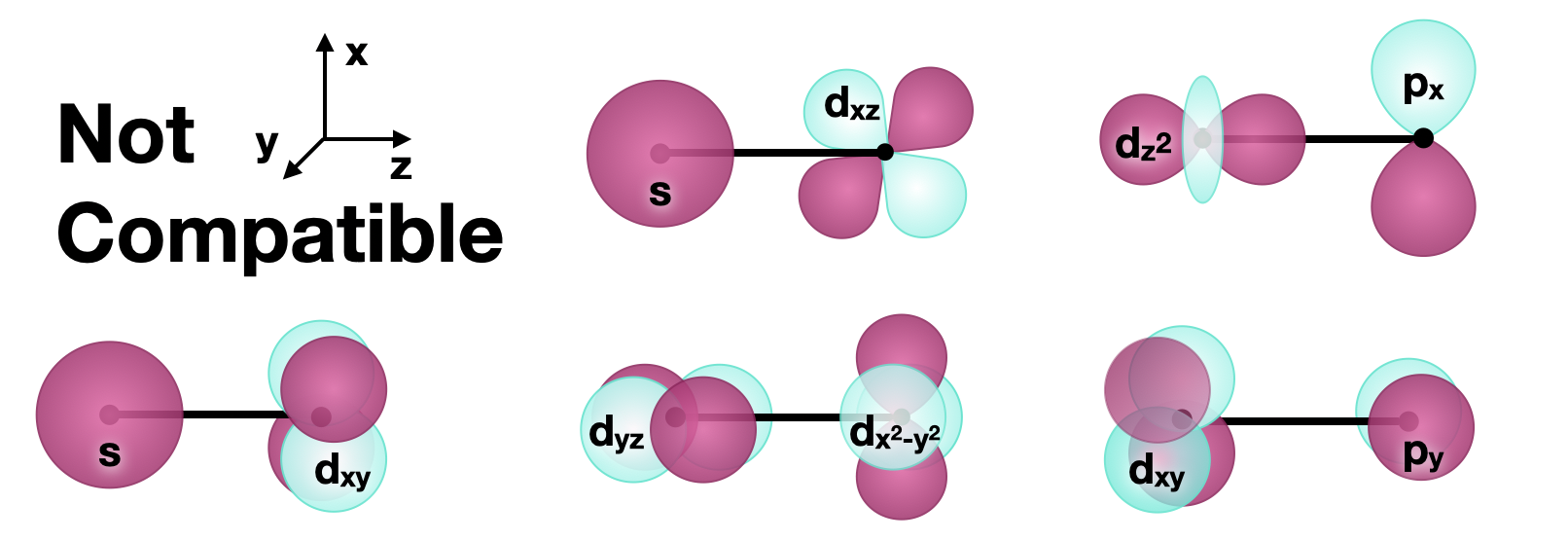
Orbitales incompatibles
En las descripciones anteriores, nos enfocamos en cómo se pueden formar enlaces (y antienlaces) con\(d\) orbitales. Todas las interacciones vinculantes y no vinculantes requieren que los orbitales tengan simetría compatible para formar interacciones productivas. Cabe mencionar que los orbitales con simetría que es incompatible con los\(d\) orbitales no tendrán interacciones ligantes o\(d\) antiligantes con los orbitales. La siguiente figura muestra varios conjuntos de orbitales que son incompatibles para la vinculación.
Modified by Kathryn Haas (khaaslab.com)


