5.2.2: Mezcla Orbital
- Page ID
- 81035
En la sección anterior, se introdujo un diagrama orbital molecular simplificado (MO), asumiendo que las interacciones se limitaban a orbitales degenerados de simetría compatible. Una versión de ese diagrama simplificado para diatómicas homonucleares de segunda fila se muestra en el lado izquierdo de la Figura\(\PageIndex{1}\) (solo se muestran los orbitales de valencia).
En realidad, los orbitales de simetría compatible pueden combinarse, o mezclarse, incluso cuando tienen diferentes energías. Cuando se mezclan conjuntos de orbitales, tiene el efecto de disminuir la energía del conjunto de menor energía y aumentar la energía del conjunto de mayor energía. Existen dos formas de explicar la mezcla, descritas en los puntos siguientes. El diagrama a la derecha del lado de la Figura\(\PageIndex{1}\) muestra cómo los niveles de energía se ven afectados por la mezcla orbital.
- Partiendo del diagrama MO simplificado y mezclando orbitales moleculares de simetría similar: Si comenzamos con el diagrama simplificado “sin mezcla” que se muestra a la izquierda, podemos seleccionar los orbitales con simetría similar y considerar qué pasará si estos orbitales moleculares se mezclan. Por ejemplo, partiendo del diagrama MO del lado izquierdo de la Figura\(\PageIndex{1}\), vemos que hay dos\(\sigma_g\) orbitales que tienen simetría idéntica (de ahí que tengan etiquetas de simetría idénticas). Al mezclarse, la energía más baja\(\sigma_g(2s)\) disminuirá en energía mientras que la energía más alta\(\sigma_g(2p)\) aumentará en energía. De igual manera, hay dos\(\sigma_u^{*}\) orbitales que se mezclarán, disminuyendo la energía de\(\sigma_u^{*}(2s)\) mientras aumenta la energía de\(\sigma_u^{*}(2p)\).
- Partiendo y mezclando orbitales atómicos de simetría compatible: A partir de los orbitales atómicos, podemos seleccionar los orbitales que tienen simetría compatible para hacer interacciones productivas, y combinarlos como un conjunto para hacer orbitales moleculares. De los dos conjuntos de orbitales atómicos en el panel derecho de la Figura\(\PageIndex{1}\), hay dos conjuntos de cuatro orbitales con simetría compatible; uno es el conjunto de dos\(2s\) y dos\(2p_z\) orbitales. Estos cuatro orbitales pueden combinarse para formar orbitales moleculares con\(\sigma\) simetría. Se combinan para formar una unión de menor energía\(\sigma_g\), una de mayor energía\(\sigma_u^{*}\) y dos orbitales con energía intermedia (\(\sigma_g\), y\(\sigma_u^{*}\)). Este tratamiento puede expresarse como la combinación lineal de cuatro orbitales atómicos:\[\Psi=c_{1} \psi\left(2 s_{a}\right) \pm c_{2} \psi\left(2 s_{b}\right) \pm c_{3} \psi\left(2 p_{a}\right) \pm c_{4} \psi\left(2 p_{b}\right) \nonumber \] donde se encuentran los coeficientes\(c_1=c_2\) y\(c_3=c_4\) para las moléculas diatómicas homonucleares.
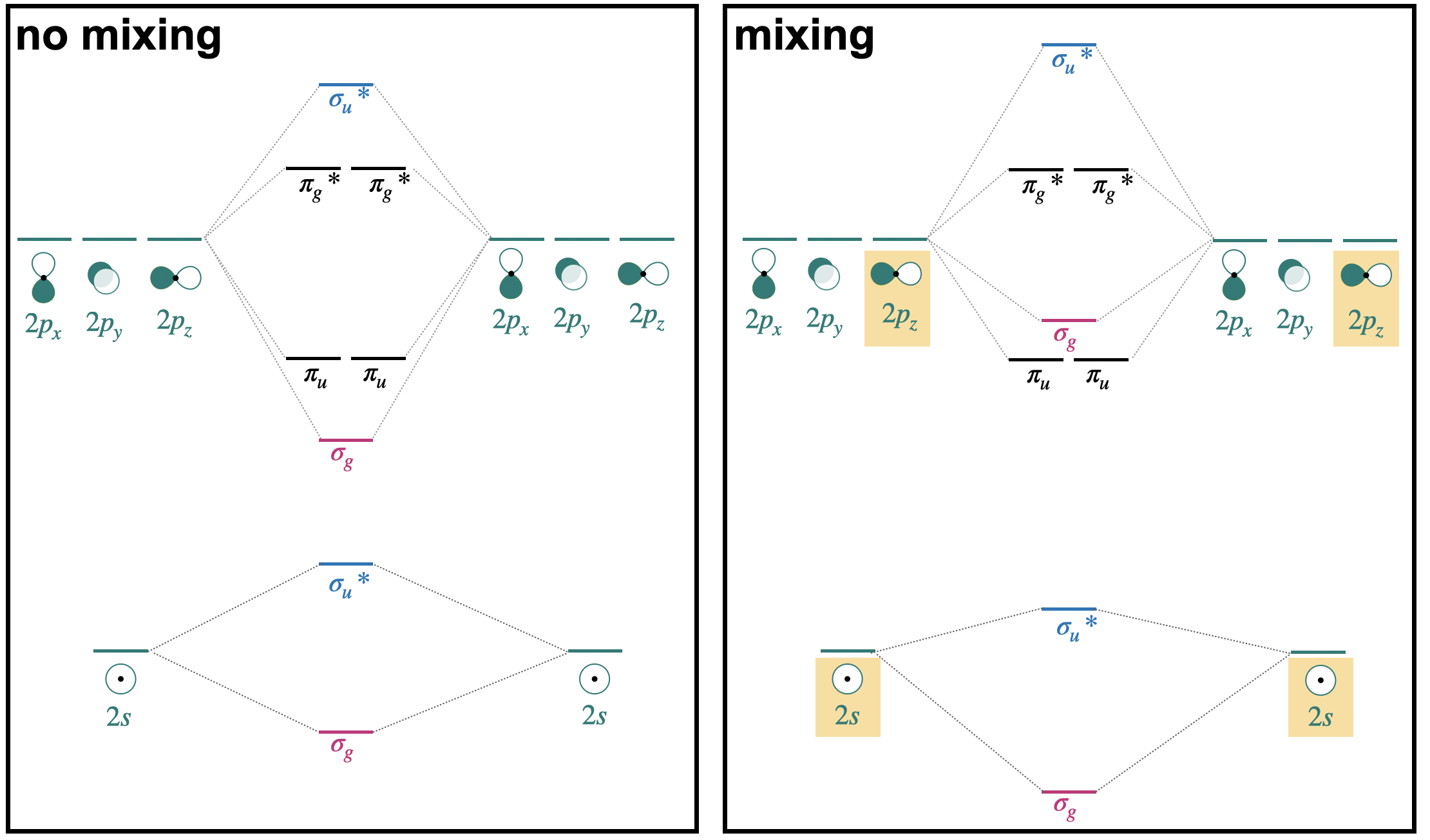
En el caso de las moléculas diatómicas homonucleares de la segunda fila, la mezcla orbital tiene importantes consecuencias para el orden energético de los\(\pi_u(2p)\) orbitales\(\sigma_g(2p)\) y. Esto se discutirá en la siguiente sección.


