5.2.3: Moléculas diatómicas del Primer y Segundo Periodo
- Page ID
- 81034
Moléculas Diatómicas Homonucleares del Primer Período
En la primera fila de la tabla periódica, los orbitales atómicos de valencia son\(1s\). Existen dos posibles moléculas diatómicas homonucleares del primer periodo:
Dihidrógeno, H 2\([\sigma_g^2(1s)]\): Esta es la molécula diatómica más simple. Tiene sólo dos orbitales moleculares (\(\sigma_g\)y\(\sigma_u^{*}\)), dos electrones, un orden de enlace de 1, y es diamagnético. Su longitud de unión es de 74 pm. La teoría MO nos llevaría a esperar que el orden de enlace disminuyera y que la longitud del enlace aumentara si sumamos o restamos un electrón. La longitud de enlace calculada para el\(\ce{H_2^{+}}\) ion es de aproximadamente 105pm. 1
Dihelio, He 2 \([\sigma_g^2\sigma_u^{*2}(1s)]\): Esta molécula tiene un orden de enlace de cero debido al igual número de electrones en orbitales de enlace y antiunión. Al igual que otros gases nobel, Él existe en la forma atómica y no forma enlaces a temperaturas y presiones ordinarias.
Dibuja los diagramas orbitales moleculares completos para\(\ce{H2}\) y para\(\ce{He2}\). Incluir bocetos de los orbitales atómicos y moleculares.
- Contestar
-
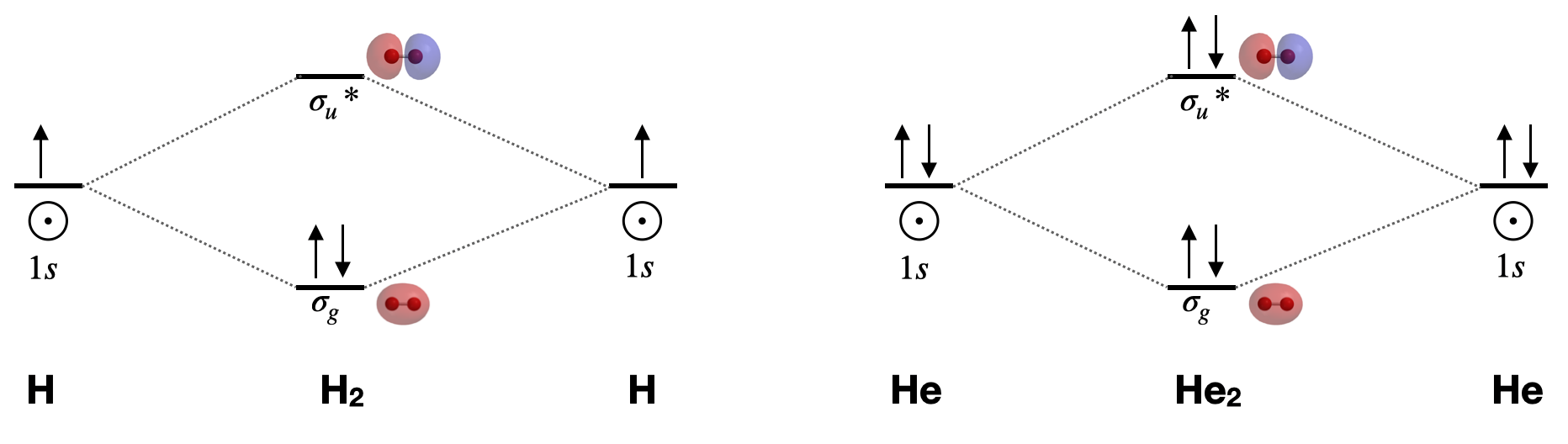
Figura para Ejercicio\(\PageIndex{1}\): Diagramas orbitales moleculares para dihidrógeno y dihelio. Superficies orbitales moleculares calculadas con el software Spartan. (CC-BY-NC-SA; Kathryn Haas) Un diagrama orbital molecular completo incluye todos los orbitales atómicos y orbitales moleculares, sus etiquetas de simetría y el relleno de electrones.
Moléculas Diatómicas Homonucleares del Segundo Período
Los elementos del segundo periodo abarcan de Li a Ne. Los orbitales de valencia son 2s y 2p. En sus diagramas orbitales moleculares, los orbitales no de valencia (1s en este caso) a menudo se ignoran en los diagramas orbitales moleculares.
La mezcla orbital tiene consecuencias significativas para las propiedades magnéticas y espectroscópicas de las moléculas diatómicas homonucleares del segundo período debido a que afecta el orden de llenado de los\(\pi_u(2p)\) orbitales\(\sigma_g(2p)\) y. Temprano en el periodo 2 (hasta e incluyendo el nitrógeno), los\(\pi_u(2p)\) orbitales son más bajos en energía que los\(\sigma_g(2p)\) (ver Figura\(\PageIndex{1})\). Sin embargo, más adelante en el periodo 2, los\(\sigma_g(2p)\) orbitales son atraídos a una energía menor. Esta disminución en la energía de no\(\sigma_g(2p)\) es única; todos los\(\sigma\) orbitales en la molécula son atraídos para disminuir la energía debido a la creciente carga positiva del núcleo. También se ven afectados\(\pi\) los orbitales en la molécula, pero en mucho menor grado que\(\sigma\) los orbitales. La razón tiene que ver con la alta penetración de los orbitales\(s\) atómicos en comparación con los orbitales\(p\) atómicos (recordemos nuestra discusión previa sobre penetración y blindaje, y su efecto en las tendencias periódicas). Los orbitales\(\sigma\) moleculares tienen más\(s\) carácter y por lo tanto su energía está más influenciada por el aumento de la carga nuclear. A medida que aumenta la carga nuclear, la energía de la\(\sigma_g(2p)\) órbita disminuye significativamente más que la energía de los\(\pi_u(2p)\) orbitales (Figura\(\PageIndex{1})\).
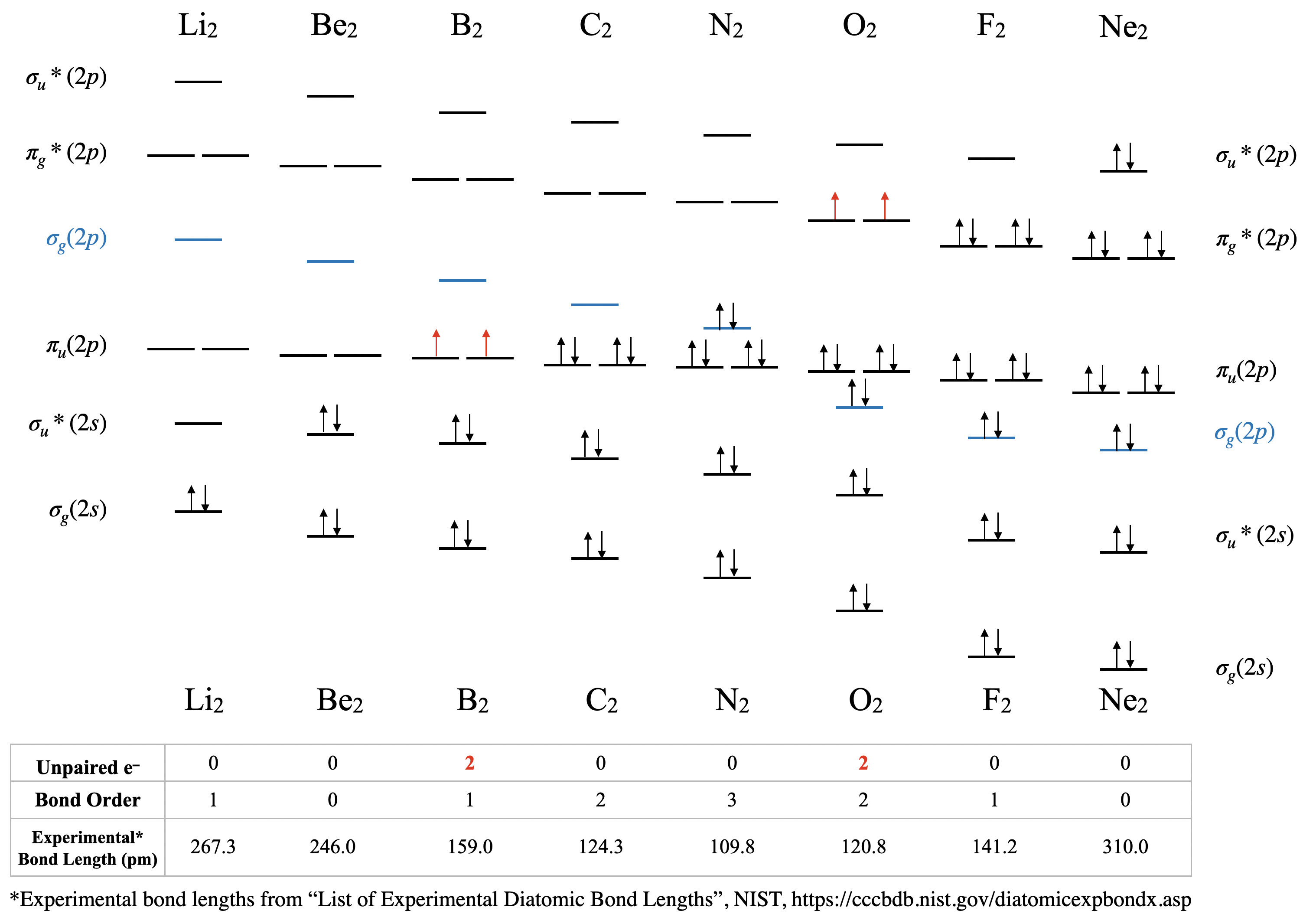
Dilitio, Li 2 \([\sigma_g^2(2s)]\): Esta molécula tiene un orden de enlace de uno y se observa experimentalmente en fase gaseosa para tener un enlace Li-Li.
Diberilio, Be 2 \([\sigma_g^2\sigma_u^{*2}(2s)]\): Esta molécula tiene un orden de enlace de cero debido al igual número de electrones en orbitales de enlace y antiunión. Si bien el Be 2 no existe en condiciones ordinarias, se puede producir en un laboratorio y medir su longitud de unión (Figura\(\PageIndex{2}\)). Aunque el enlace es muy débil, su longitud de enlace es sorprendentemente ordinaria para un enlace covalente de los elementos del segundo período. 2
Diboro, B 2\([\sigma_g^2\sigma_u^{*2}(2s)\pi_u^1\pi_u^1(2p)]\): El caso del diboro es uno que está mucho mejor descrito por la teoría orbital molecular que por las estructuras de Lewis o la teoría de enlaces de valencia. Esta molécula tiene un orden de enlace de uno. La descripción orbital molecular del diboro también predice, con precisión, que el diboro es paramagnético. El paramagnetismo es consecuencia de la mezcla orbital, dando como resultado que los\(\sigma_g\) orbitales estén a una energía más alta que los dos\(\pi_u^*\) orbitales degenerados.
Dicarbono, C 2\([\sigma_g^2\sigma_u^{*2}(2s)\pi_u^2\pi_u^2(2p)]\): Esta molécula tiene un orden de enlace de dos. La teoría orbital molecular predice dos enlaces con\(\pi\) simetría y sin\(\sigma\) unión. C 2 es raro en la naturaleza porque su alótropo, el diamante, es mucho más estable.
Dinitrogen, N 2\([\sigma_g^2\sigma_u^{*2}(2s)\pi_u^2\pi_u^2\sigma_g^2(2p)]\): Se prevé que esta molécula tenga un triple enlace. Esta predicción es consistente con su longitud de enlace corto y su energía de disociación de enlaces. Las energías de los\(\sigma_g(2p)\) y\(\pi_u(2p)\) orbitales están muy cerca, y sus niveles relativos de energía han sido objeto de cierto debate (ver siguiente sección para discusión).
Dioxígeno, O 2\([\sigma_g^2\sigma_u^{*2}(2s)\sigma_g^2\pi_u^2\pi_u^2\pi_g^{*1}\pi_g^{*1}(2p)]\): Este es otro caso donde la teoría del enlace de valencia no logra predecir las propiedades reales. La teoría orbital molecular predice correctamente que el dioxígeno es paramagnético, con un orden de enlace de dos. Aquí, el diagrama orbital molecular vuelve a su orden “normal” de orbitales donde la mezcla orbital podría ser algo ignorada, y donde\(\sigma_g(2p)\) es menor en energía que\(\pi_u(2p)\).
Difluorina, F 2\([\sigma_g^2\sigma_u^{*2}(2s)\sigma_g^2\pi_u^2\pi_u^2\pi_g^{*2}\pi_g^{*2}(2p)]\): Esta molécula tiene un orden de enlace de uno y al igual que el oxígeno, el\(\sigma_g(2p)\) es menor en energía que\(\pi_u(2p)\).
Dineon, Ne 2 \([\sigma_g^2\sigma_u^{*2}(2s)\sigma_g^2\pi_u^2\pi_u^2\pi_g^{*2}\pi_g^{*2}\sigma_u^{*2}(2p)]\): Al igual que otros gases nobles, el Ne existe en forma atómica y no forma enlaces a temperaturas y presiones ordinarias. Al igual que Be 2, Ne 2 es una especie inestable que se ha creado en condiciones extremas de laboratorio y se ha medido su longitud de unión (Figura\(\PageIndex{2}\))
Dibuja el diagrama orbital molecular completo para O 2. Mostrar el cálculo de su orden de unión y decir si es diamagnético o paramagnético.
- Contestar
-
O 2 es paramagnético con un orden de enlace de 2. Su orbital\(\sigma_g(2p)\) molecular es menor en energía que el conjunto de\(\pi_{u}(2p)\) orbitales.
Orden de bonos\(=\frac{1}{2}\left[\left(\begin{array}{c}\text { 8 electrons in} \\ \text { valence bonding orbitals }\end{array}\right)-\left(\begin{array}{c}\text {4 electrons in} \\ \text { valence antibonding orbitals }\end{array}\right)\right]\)
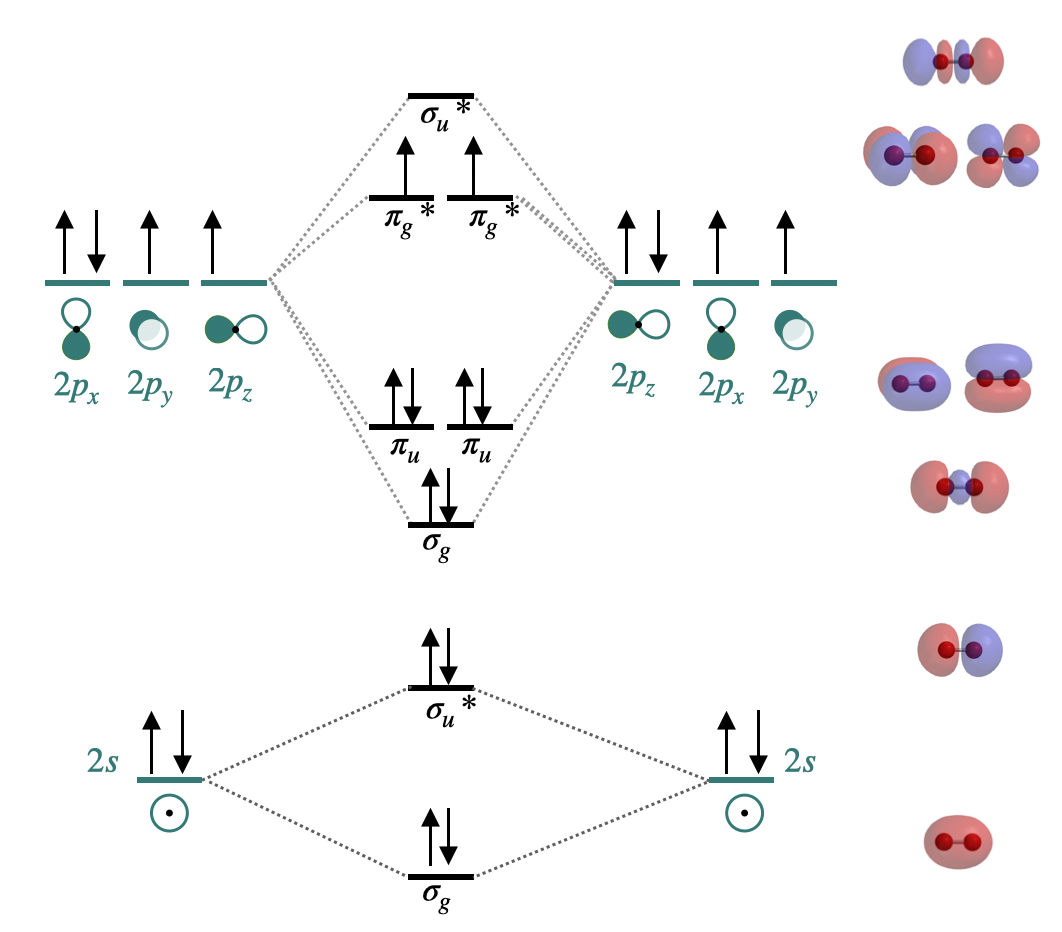
Figura para Ejercicio Diagrama orbital\(\PageIndex{2}\). molecular de O 2. (CC-BY-NC-SA, Kathryn Haas)
Utilice un diagrama cualitativo de nivel de energía orbital molecular para predecir la configuración de los electrones, el orden de enlace y el número de electrones desapareados en el ion peróxido (O 2 2 −).
- Contestar
-
Este diagrama se parece al de\(\ce{O2}\), excepto que hay dos electrones adicionales.
\( \left ( \sigma _{g}(2s) \right )^{2}\left ( \sigma_u ^{\star }(2s) \right )^{2}\left ( \sigma _g(2p) \right )^{2}\left ( \pi _{u}(2p) \right )^{4}\left ( \pi _g(2p) \right )^{4} \); orden de enlace de 1; sin electrones desapareados.
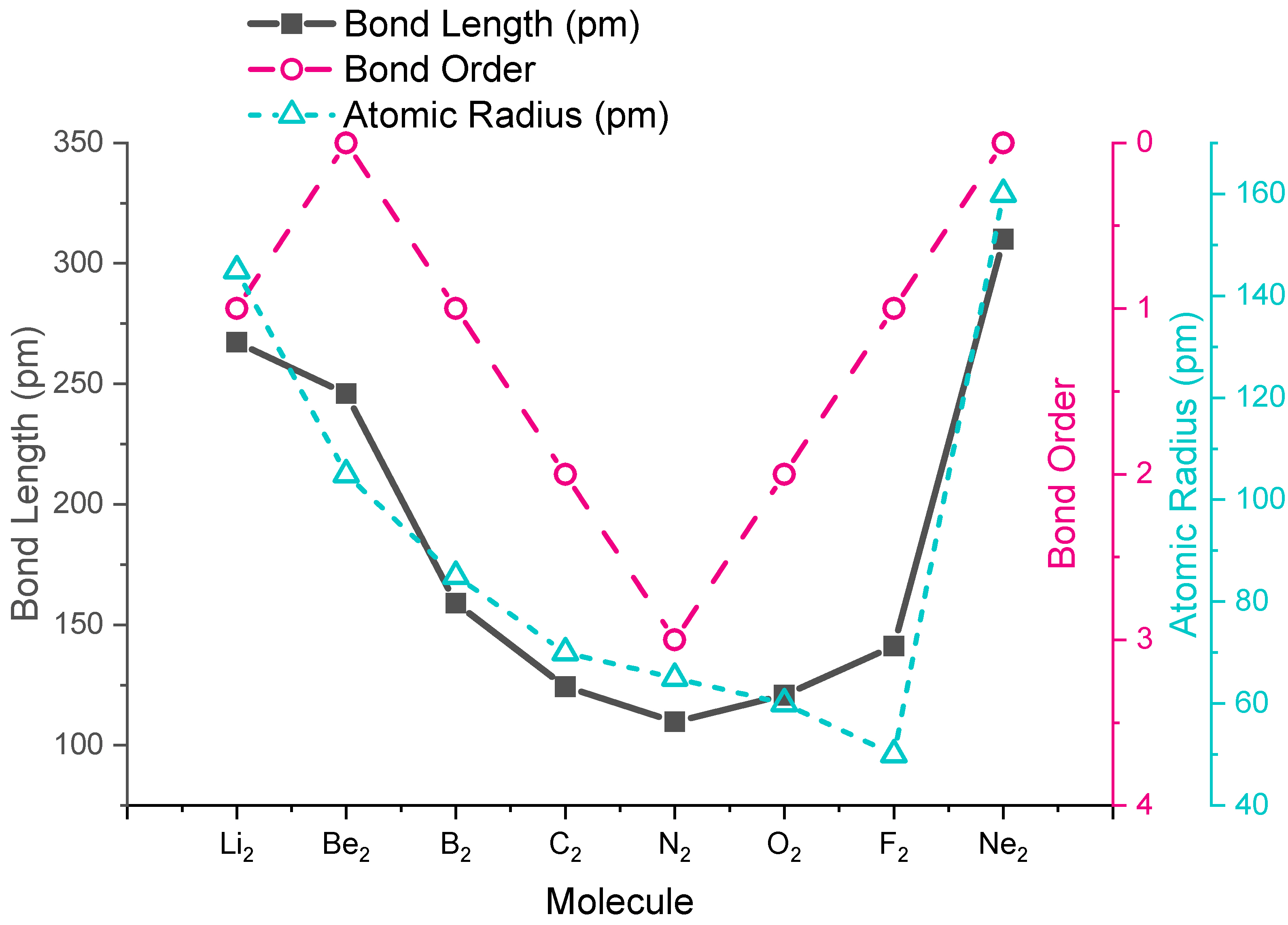
Longitudes de enlace en moléculas diatómicas homonucleares
Las tendencias en las longitudes de enlace experimentales se predicen por la teoría orbital molecular, específicamente por el orden de enlace calculado. Los valores de orden de enlace y longitudes de enlace experimentales para las moléculas diatómicas del segundo período se dan en la Figura\(\PageIndex{1}\), y se muestran en formato gráfico en la gráfica de la Figura\(\PageIndex{2}\). De la parcela, podemos ver que la longitud del enlace se correlaciona bien con el orden de unión, con una longitud mínima de enlace que ocurre donde el orden de unión es mayor (\(\ce{N2}\)). La distancia de unión más corta está en\(\ce{N2}\) debido a su alto orden de unión de 3. De\(\ce{N2}\) a\(\ce{F2}\) la distancia de enlace aumenta a pesar de que el radio atómico disminuye.
Referencias
- NIST, Geometrías calculadas disponibles para H 2 + (catión de hidrógeno) 2σg+ d∞ h, disponible en https://cccbdb.nist.gov/diatomicexpbondx.asp
- Merritt, J. M.; Bondybey, V. E.; Cielo, M. C., Dímero-Berilio-Atrapado en el Acto de Vinculación. Ciencia 2009, 324 (5934), 1548-1551.


