6.1: Los modelos ácido-base como conceptos de organización
- Page ID
- 81249
En un sentido muy real, podemos hacer un ácido cualquier cosa que deseemos. Las diferencias entre los diversos conceptos ácido-base no se refieren a cuál es “correcto”, sino cuál es el más conveniente de usar en una situación particular.
James E. Huheey, Ellen A. Keiter y Richard L. Keiter
El concepto de ácidos y bases suele asociarse con el movimiento de iones de hidrógeno de una molécula o ion a otro. Sin embargo, se han desarrollado una serie de conceptos ácido-base para ayudar a los químicos a organizar y dar sentido a una amplia gama de reacciones (Cuadro 6.1).
| Definición | Paradigma teórico y características notables. | Ácido | Base | Reacciones ilustrativas de muestra |
|---|---|---|---|---|
|
Arrhenius (1894) |
Interesado en lo que la sustancia hace al estado de una solución acuosa. En particular, evalúa la donación de protones a & remoción del agua usando [H 3 O +] como proxy. Se adapta fácilmente al concepto de pH como una medida del estado de una solución. |
Incrementa [H 3 O +] |
Disminuye [H 3 O +] |
\(\underset{acid}{HCl}~+~H_2O~\rightarrow~H_3O^+~+~Cl^-\) \(\underset{base}{NH_3}~+~H_2O~\rightarrow~NH_4^+~+~OH^-\) |
|
Brønsted-Lowry (1923) |
Visualiza la reactividad ácido-base en términos de la transferencia de un H + de una sustancia a otra. Permite la conjugación de ácidos y bases y la autoionización de solventes. | Dona H + | Acepta H + |
\(\underset{acid}{HCl}~+~\underset{base}{NH_3}~\rightarrow~\underset{conj.~acid}{NH_4^+}~+~\underset{conj.~base}{Cl^-}\) \(\underset{acid}{HOAc}~+~\underset{base}{NH_3}~\rightarrow~\underset{conj.~acid}{NH_4^+}~+~\underset{conj.~base}{OAc^-}\) \(\underset{amphoteric}{2~H_2O}~\rightarrow~\underset{conj.~acid}{H_3O^+}~+~\underset{conj.~base}{OH^-}\) |
|
Lux-Inundación (1939-~47) |
Describe reacciones que involucran óxidos y oxianiones en términos de la transferencia de iones óxido (O 2-). Se utiliza principalmente en geoquímica, aunque también se puede utilizar para describir algunas reacciones redox. | Aceptador de óxido | Donante de óxido |
\(\underset{acid}{SiO_2}~+~\underset{base}{CaO}~\rightarrow~CaSiO_3\) \(\underset{base}{H_2O}~+~\underset{acid}{CO}~\rightarrow~H_2~+~CO_2\) |
| Sistema Solvente | Aplica aspectos de los conceptos de base ácida Arrhenius, Brønsted-Lowry y Luk-Flood a la formación de cationes y aniones solventes en una reacción generalizada. Se puede utilizar para describir la química de la solución en sistemas solventes no acuosos como BrF 3. | Es un catión disolvente o aumenta la concentración de catión disolvente, a menudo al recibir un grupo portador de pares solitarios | Es un anión solvente o aumenta la concentración de anión solvente, a menudo donando un grupo portador de pares solitarios |
\(\underset{acid}{SbF_5}~+~\underset{base}{BrF_3}~\rightarrow~\underset{conj.~base}{SbF_6^-}~+~\underset{conj.~acid}{BrF_2^+}\) \(\underset{amphoteric}{2~BrF_3}~\rightarrow~\underset{conj.~acid}{BrF_2^+}~+~\underset{conj.~base}{BrF_4^-}\) |
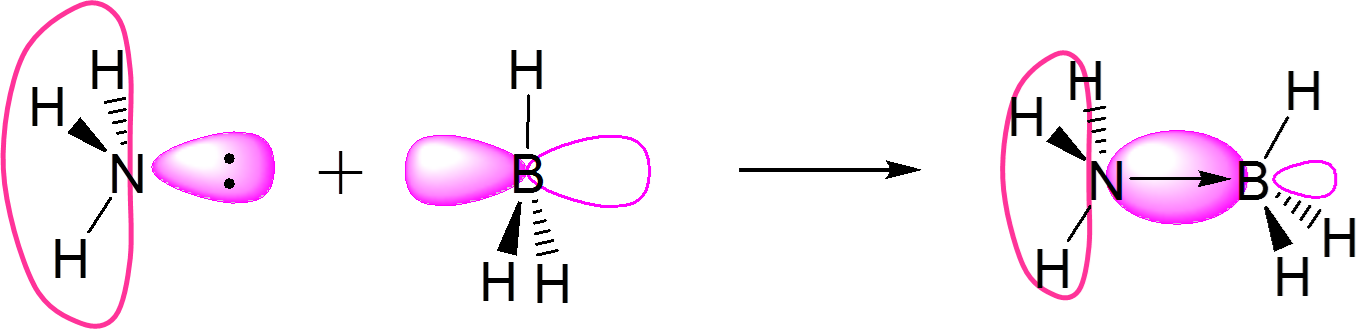
| Lewis (1923) | Visualiza la reactividad ácido-base en términos de donación de pares de electrones. Abarca las definiciones de Arrhenius, Brønsted-Lowry, Luk-Flood y Solvente System y se integra fácilmente con descripciones orbitales moleculares de reactividad química en la teoría orbital Frontier. | Acepta un par de electrones | Dona un par de electrones | \(\underset{base}{:NH_3}~+~\underset{acid}{BF_3}~\rightarrow~H_3N~+~BF_3\) |
| Nucleófilo-electrófilo | Aplica el concepto Lewis a la reactividad orgánica. Los nucleófilos son bases de Lewis que tienden a reaccionar para formar un enlace con sitios ácidos de Lewis llamados centros electrófilos. |
(El electrófilo) |
(El nucleófilo) Dona un par de electrones para formar un enlace a un electrófilo |
\(\underset{base}{Br^-}~+~\underset{acid}{CH_3-Cl}~\rightarrow~Br-CH_3~+~Cl^-\) |
|
Usanovich (1939) |
Extiende la teoría de Lewis para incluir la donación y aceptación de cualquier número de electrones, ya sea a través de la formación de un aducto o transferencia de electrones. | Acepta electrones | Dona electrones |
\(\underset{base}{:NH_3}~+~\underset{acid}{BH_3}~\rightarrow~\underset{adduct}{H_3N-BH_3}\) \(\underset{acid}{Fe^{2+}}~+~\underset{base}{Zn^0}~\rightarrow~Fe^0~+~Zn^{2+}\) |
| Orbital Fronteriza (1960) | Visualiza reacciones ácido-base/electrófilo-nucleófilo de Lewis en términos de donación y aceptación de electrones entre los orbitales fronterizos del reactivo. Específicamente, la reacción se concibe en términos de donación de los electrones HOMO de la base al nivel LUMO del ácido. | Posee un LUMO capaz de formar un MO de unión ocupado al mezclarse con el HOMO de una base. | Posee un HOMO portador de electrones capaz de formar un MO de enlace lleno al mezclarse con un LUMO de ácido. |
aducto de ácido base |
Algunos conceptos implican definir ácidos y bases de manera particular que permitan la comprensión de tipos particulares de sistemas químicos. Por ejemplo, los conocidos conceptos de ácido y base de Arrhenius y Brønsted utilizados en la química general ayudan a los químicos a dar sentido al comportamiento de los compuestos que pueden transferir iones H + entre ellos, a menudo en solución acuosa. Sin embargo, el concepto ácido-base del sistema solvente define ácidos y bases en términos de la transferencia de un grupo portador de par solitario y es particularmente útil para conceptualizar la reactividad de haluros, óxidos y compuestos relacionados del grupo principal. Algunas definiciones ácido-base buscan abarcar una gama extremadamente amplia de reacciones químicas. Por ejemplo, la definición ácido-base de Lewis abarca las definiciones de Arrhenius, Brønsted y sistemas solventes y también ha encontrado un amplio uso en la química inorgánica debido a la facilidad con la que las interacciones ácido-base de Lewis pueden ser descritas por el enfoque Orbital Frontier en términos de interacción molecular orbitales sobre el ácido y la base.
Referencias
Huheey, J. E.; Keiter, E. A.; Keiter, R. L., Química Inorgánica: principios de estructura y reactividad. 4ª ed. ; HarperCollins: Nueva York, NY, 1993, pág. 318.