7.1.2: Transiciones Metal-Aislante
- Page ID
- 81204
En el Capítulo 6 aprendimos que los metales y aislantes no solo tienen diferentes propiedades eléctricas sino que también tienen estructuras cristalinas muy diferentes. Los metales tienden a tener altos números de coordinación (típicamente 8 o 12) mientras que los aislantes tienen números de coordinación bajos que pueden racionalizarse como arreglos de unión de “octeto”. Por ejemplo, en Si cristalino o Ge (estructura de diamante), cada átomo tiene cuatro vecinos más cercanos. Hay dos electrones por enlace, y así cada átomo tiene ocho electrones en su caparazón de valencia. Sn, el elemento debajo de Ge, existe en dos formas diferentes, una (estaño gris) con la estructura de diamante que es un semiconductor quebradizo de brecha estrecha, y la otra (estaño blanco) con una estructura tetragonal centrada en el cuerpo que es un metal maleable. Estas dos formas son muy cercanas en energía, y de hecho el estaño blanco metálico se transforma en la forma gris semiconductora quebradiza a baja temperatura. El clima extremadamente frío en la Europa del siglo XVIII provocó que muchas tuberías de órganos de estaño se rompieran y eventualmente se convirtieran en polvo Esta transformación se ha denominado tizón del estaño, enfermedad del estaño, plaga del estaño o lepra del estaño. El polvo es en realidad estaño gris, que carece de la maleabilidad de su primo metálico estaño blanco.
Bajo temperaturas y presiones experimentalmente accesibles, Si y Ge son siempre semiconductores (es decir, aislantes), y el Pb siempre es metálico. ¿Por qué Sn es diferente? La razón tiene que ver con el solapamiento orbital. La teoría nos dice de hecho que cualquier (y todos) aislantes deben volverse metálicos a una presión suficientemente alta, o más al punto, a una densidad suficientemente alta. Para la mayoría de los aislantes, sin embargo, las presiones requeridas van mucho más allá de las que podemos lograr en el laboratorio.

¿Cómo podemos racionalizar la transición de los aislantes al estado metálico? En efecto, ¿cómo podemos entender en absoluto la existencia de aislantes?
El modelo Hubbard
Consideremos una cadena de un gran número (N) de átomos como lo hicimos en el Capítulo 6. Por conveniencia, podemos decir que se trata de átomos como H, Na o Cs que tienen un electrón de valencia. El modelo de banda simple que desarrollamos anteriormente sugiere que la cadena debe ser metálica, porque los átomos de N se combinan para hacer N orbitales, y los electrones de valencia N solo llenan la banda de orbitales a mitad de camino. Pero esta conclusión no depende de la densidad, lo que crea una paradoja. Si los átomos en la cadena están muy separados, sospechamos que los electrones deberían localizarse en los átomos.
|
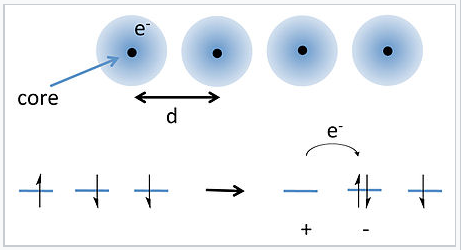
Saltos de electrones en una cadena 1-D de átomos. |
Una solución a este problema fue propuesta por J. Hubbard en 1963. [1] Hubbard consideró la energía requerida para transferir un electrón de un átomo a su vecino más cercano, como se muestra en la imagen de la derecha. Debido a que cada átomo ya tiene un electrón (con espín aleatorio), mover un electrón sobre un átomo requiere superar la energía de la repulsión electrón-electrón para hacer un par catión-anión. Para los átomos bien separados esta energía (U) viene dada por:
\[U = IP -Ea -\frac{e^{2}}{4\pi \varepsilon_{0} d}\]
donde IP y EA son la energía de ionización y afinidad electrónica, ε 0 es la permitividad del espacio libre, y el último término en la ecuación representa la atracción culómbica entre el catión y el anión. Para átomos como los metales alcalinos, U es del orden de 3—5 eV, que es mucho mayor que la energía térmica kT. Por lo tanto, esperamos que haya muy pocos pares anión-catión a temperatura ambiente, y la cadena de átomos debería ser aislante.
|
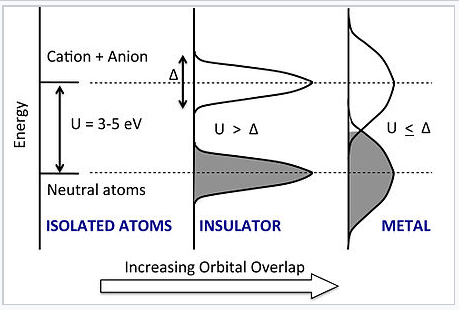
Energía vs. DOS para la cadena de átomos a medida que aumenta la densidad y el grado de superposición orbital entre átomos. El aumento de la superposición amplía los estados de átomo neutro y anión-catión en bandas, cada una de las cuales tiene un ancho de banda Δ. Una transición al estado metálico ocurre abruptamente cuando Δ excede el hueco Hubbard U. |
¿Qué pasa cuando apretamos los átomos juntos? En el modelo Hubbard, a medida que disminuye la distancia entre los átomos, las energías tanto de los estados de átomos neutros como de los estados anión-catiónicos se ensanchan en bandas, cada una de las cuales tiene un ancho de banda Δ. La banda inferior puede acomodar exactamente N electrones (no 2N como en la imagen MO que desarrollamos anteriormente) porque cada orbital solo puede tomar un electrón sin emparejamiento de espinas. Así, para δ pequeña la banda inferior está llena y la banda superior está vacía. Sin embargo, a medida que continuamos comprimiendo la cadena, el solapamiento orbital se vuelve tan fuerte que Δ ≈ U. En este punto, las bandas se superponen y algunos de los electrones llenan los estados anión-catiónicos. Luego, la cadena se vuelve conductora y el material es metálico.
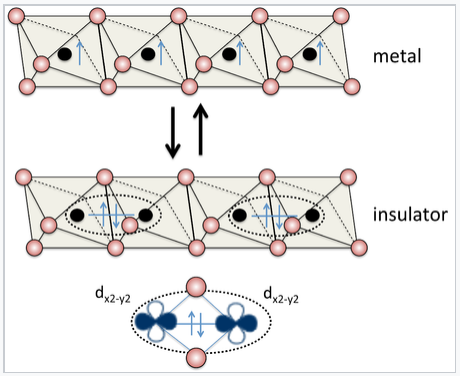
Algunos materiales, como Sn y VO 2, tienen el grado justo de superposición orbital para hacer que la transición Hubbard ocurra cambiando la temperatura o la presión. Dichos materiales pueden ser muy útiles para la conmutación eléctrica, como se ilustra a la derecha para la estructura de rutilo VO 2. La mayoría de los materiales están lejos de la transición, ya sea en el lado metálico o aislante. Una interesante tendencia periódica que ilustra este concepto se puede observar entre los monóxidos de metales de transición, MO (M = Ti, V, Cr, Mn, Fe, Co, Ni), todos los cuales tienen la estructura de NaCl. El TiO y VO son metálicos, ya que los orbitales 3d tienen un solapamiento significativo en la estructura. Sin embargo, CrO, MnO, FeO, CoO y NiO son todos aislantes, porque los orbitales 3d se contraen (y por lo tanto Δ < U) atravesando la serie de metales de transición. En contraste, los sulfuros análogos (TIs, VS,... NiS) son todos metálicos. Los sulfuros tienen la estructura NiAs, en la que todos los átomos metálicos son eclipsados a lo largo del eje de apilamiento (el eje c hexagonal). Las distancias cortas metal-metal a lo largo de ese eje dan como resultado una fuerte superposición orbital, haciendo Δ > U.
|
El dióxido de vanadio tiene la estructura rutilo, y en su forma no distorsionada es metálico, con un electrón de valencia por átomo de V. La distorsión de la celosía produce pares de átomos de V, lo que resulta en un estado electrónicamente aislante. La transición del aislador metálico se puede impulsar de manera reversible cambiando la temperatura, la presión o la ocupación orbital. Se está estudiando la conmutación eléctrica de esta transición en VO 2 para aplicaciones en transistores de película delgada de alto rendimiento [2] |
El modelo Mott
Un modelo más simple y menos atomístico de la transición metal-aislante fue formulado por Neville Mott. [3] El modelo Mott considera el comportamiento de un electrón en un material como una función de la densidad de todos los demás electrones de valencia. Sabemos que para un átomo similar al hidrógeno de un electrón (H, Na, Cs, etc.) la ecuación de Schrödinger contiene un término energético potencial:
\[V(r) = -(\frac{e^{2}}{4 \pi \varepsilon_{0} r})\]
Esta función energética potencial da lugar a una escalera familiar de niveles de energía permitidos en el átomo de hidrógeno. Sin embargo, en un metal, este potencial de Coulomb debe ser modificado para incluir el cribado de carga nuclear por los otros electrones en el sólido. En este caso hay un potencial de Coulomb proyectado:
\[V(r) = -(\frac{e^{2}}{4 \pi \varepsilon_{0}r}) exp(-qr)\]
donde q, que es la inversa de la longitud de cribado, viene dada por:
\[ q^{2} = 4m_{e}^{2}(\frac{3n}{\pi})^{\frac{1}{3}}(\frac{2\pi}{h})\]
Aquí n es la densidad de átomos (o electrones de valencia), m e es la masa de electrones, y h es la constante de Planck. A distancias mucho mayores que la longitud de cribado q -1, el electrón ya no “siente” la carga en el núcleo. Mott demostró que existe una densidad crítica de electrones n c por encima de la cual los electrones de valencia ya no están unidos por núcleos individuales y son libres de vagar por el cristal. Esta densidad crítica marca la transición al estado metálico, y viene dada por el criterio Mott:
\[\mathbf{n_{c}^{\frac{1}{3}}a_{H} \approx 0.26}\]
En esta ecuación, un H es un radio Bohr efectivo para los electrones de valencia en el límite de baja densidad, por ejemplo, el radio orbital promedio de los electrones en la capa 6s de un átomo de Cs cuando se calcula el valor para el metal Cs.
|
Soluciones de metal litio en amoníaco líquido a baja (parte superior, conductor iónico) y mayor (inferior, metal) concentración de Li. De un video de Joshua Judkins |
El concepto importante del modelo Mott es que la transición metal-aislador depende muy fuertemente de la densidad de los electrones de valencia. Esto es consistente con el modelo de superposición orbital de Hubbard, pero también más general en el sentido de que no depende de una estructura periódica de átomos. El modelo Mott es así aplicable a sistemas tan diversos como átomos metálicos disueltos en amoníaco líquido, átomos metálicos atrapados en matrices de gas congeladas y dopantes en semiconductores. [4] En algunos sistemas, es posible sintonizar continuamente la densidad de los electrones de valencia con resultados bastante llamativos. Por ejemplo, la disolución de metal alcalino (Li, Na,...) en amoníaco líquido (bp -33 o C) produce un líquido azul. Los cationes alcalinos solvatados y los electrones cargados negativamente imparten conductividad iónica (como en una solución salina) pero no conductividad electrónica a la solución de amoníaco líquido azul. Pero a medida que aumenta la concentración de electrones, se forma una fase líquida reflectante de color bronce que flota sobre la fase azul. Esta fase de bronce es metálica y altamente conductora. Eventualmente, con suficiente metal alcalino agregado, todo el líquido se convierte en la fase de bronce electrónicamente conductora.
La conmutación eléctrica de VO 2 entre fases aislantes y metálicas (ver arriba) también se puede racionalizar en términos de la transición Mott. Agregar más densidad de electrones (por dopaje de campo químico o eléctrico) aumenta la concentración de electrones de valencia, impulsando la transición de fase al estado metálico.
Termodinámica y transiciones de fase
Termodinámicamente, la transición metal-aislante es una transición de fase de primer orden. En tal transición, la estructura y las propiedades cambian abruptamente (piense en la transición del desayuno al almuerzo en McDonalds; ¡simplemente no hay forma de obtener panqueques después, o hamburguesas antes de las 10:30 AM! [5]). Así, en el caso del metal Sn, los cambios en la estructura (de cuatro a ocho coordinaciones) y en la conductividad electrónica (aislante a metal) ocurren simultáneamente. Al igual que en otras transiciones de fase de primer orden como hielo a agua a vapor, hay un calor latente asociado con la transición y una discontinuidad en propiedades derivadas como la capacidad calorífica.
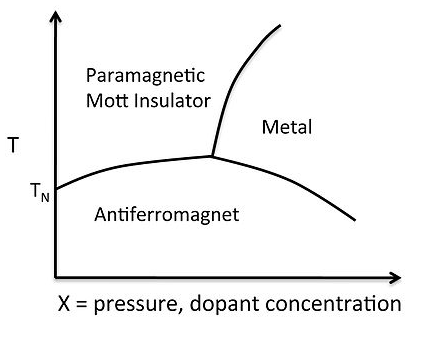
Un diagrama de fases típico para una transición de aislador metálico se muestra a la derecha para V 2 O 3. El ion V 3+ coordinado octaédricamente tiene un recuento de electrones d 2, por lo que hay dos espines desapareados por átomo, y a baja temperatura los espines en el orden reticular antiferromagnéticamente. Como aprendimos en el Capítulo 8, por encima de la temperatura de Néel un antiferroimán se convierte en paramagnet, que también es un aislante Mott. El aumento de la presión, o el dopaje con electrones (por ejemplo, sustituyendo algunos d 3 Cr 3+ por V 3+) empuja la densidad de electrones sobre la transición Mott, el par de espines y el sólido se vuelve metálico.