8.3.1: Propiedades Químicas de los Metales Alcalinos
- Page ID
- 81450
La química de los metales alcalinos refleja su tendencia a formar +1 cationes.
Los metales alcalinos tienden a formar +1 cationes. La formación de cationes se ve favorecida por las energías de ionización relativamente bajas del metal libre (lo que facilita la formación del catión) y la alta energía de solvatación de sus cationes (lo que indica que el catión se estabiliza termodinámicamente en solución). Las variaciones en la energía de ionización y las energías de solvatación en el grupo de los metales alcalinos ayudan a explicar por qué Li es más reductor que los otros metales alcalinos. 1 Las energías de ionización y entalpías de hidratación relevantes se dan en la Tabla\(\sf{\PageIndex{1}}\). Como puede verse a partir de los datos de la Tabla\(\sf{\PageIndex{1}}\), la energía de ionización del metal disminuye en ~ 20% al pasar de Li a Cs mientras que la energía de solvatación del catión disminuye en ~ 75% sobre el mismo rango (con ~2/3 de esa disminución teniendo lugar al pasar de Li + a Na +).
Mesa\(\sf{\PageIndex{1}}\). Propiedades termodinámicas seleccionadas de los metales alcalinos y sus cationes. 2,3
| Metal alcalino |
Energía de ionización (KJ/mol) |
Entalpía de solvatación o f el Catión +1 (KJ/mol) |
| Litio, Li | 513 | -1091 |
| Sodio, Na | 496 | -515 |
| Potasio, K | 419 | -405 |
| Rubidio, Rb | 403 | -321 |
| Cesio, Cs | 376 | -296 |
| Francium. Fr | 400 | -263 |
Un resultado de esta mayor estabilidad de Li + en solución respecto a la de otros cationes de metales alcalinos es que Li tiende a ser el más reductor de los metales alcalinos, como lo ilustran los potenciales de reducción de los metales dados en la Figura\(\sf{\PageIndex{1}}\). Sin embargo, como puede verse en la Figura\(\sf{\PageIndex{1}}\), los potenciales de reducción de los otros metales alcalinos no aumentan monótonamente al pasar de Na a Cs. En cambio, Na es el metal menos reductor, mientras que los potenciales de reducción de K, Rb y Cs son aproximadamente iguales.
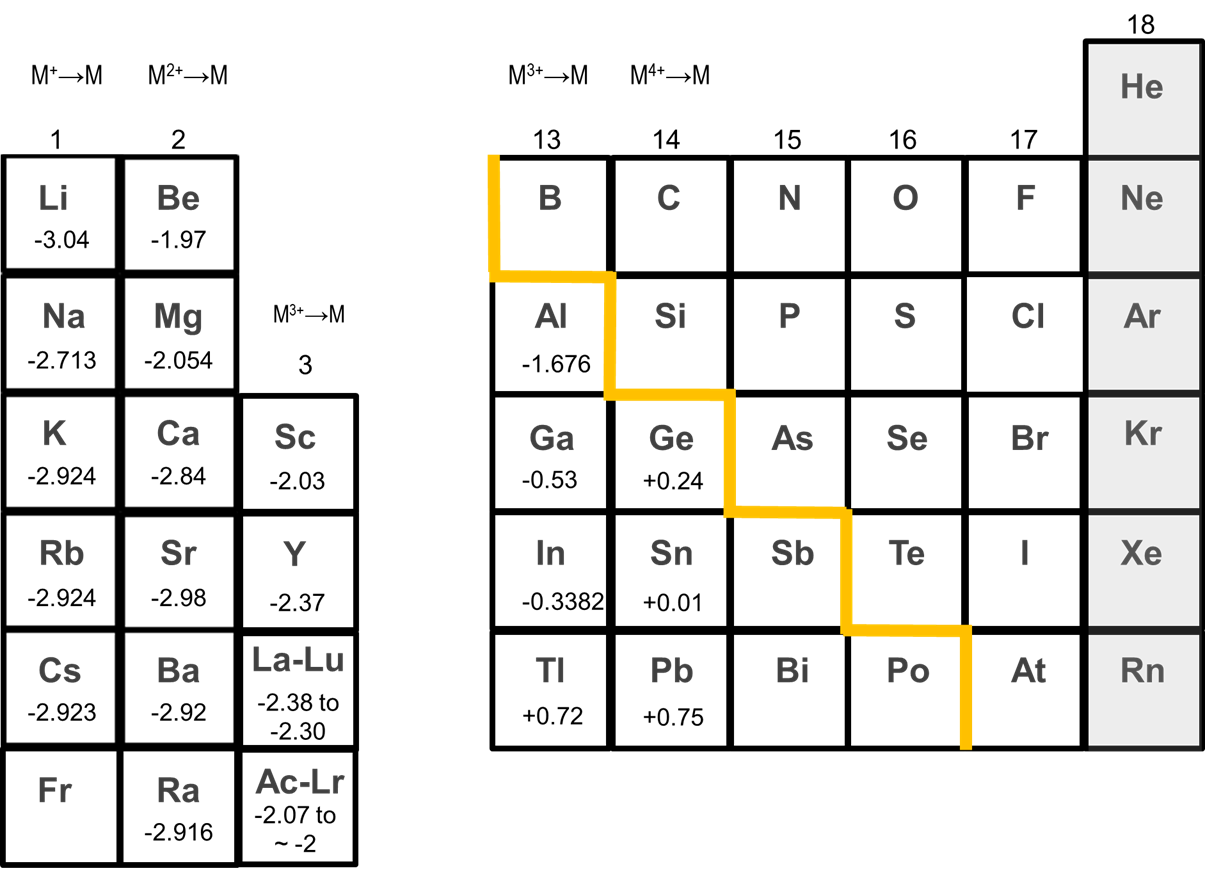
Debido a su tendencia a formar cationes, los metales alcalinos son agentes reductores efectivos.
Debido a su tendencia a formar cationes, los metales alcalinos son altamente reductores. Todos reaccionan vigorosamente con agua para dar hidróxidos.
\[\sf{2~M(s)~~+~~2~H_2O(l)~\rightarrow~2~M^+~~+~~2~OH^-~~+~~H_2(g)~~~~~~(M~=~= Li,~Na,~K,~Rb,~Cs)} \nonumber \]
Todas las reacciones son exotérmicas y a menudo conducen a la combustión del gas H 2 evolucionado. En consecuencia, mientras que Li generalmente simplemente se esfuma a medida que reacciona, Na y K suelen resultar en la formación de una llama coloreada mientras que las reacciones de Rb y Cs resultan en una explosión.
Más útil sintéticamente es la reducción de haluros de alquilo por Li metal para dar reactivos de organolitio.
\[\sf{R-Cl~~+~~2~Li(s)~~\overset{THF}{\longrightarrow}~~RLi~~+~~LiCl} \nonumber \]
Bajo condiciones donde el catión metálico se estabiliza en ausencia de un agente oxidante, incluso es posible formar sales de electrones libres o solvatados. Pequeñas cantidades de sodio pueden disolverse en disolventes donadores secos (amoníaco, aminas terciarias, hexametilfosforamida) para dar soluciones azules paramagénticas que contienen electrones solvatados.
\[\sf{Na(s)~~\overset{NH_3}{\longrightarrow}~~Na(NH_3)_6^+~~+~~e^-(solv.)~~~~(at~low~Na^+~concentrations)} \nonumber \]
A mayores concentraciones de bronce de sodio se forman soluciones que contienen aniones sódicos (e.g. M-).
\[\sf{2~Na(s)~~\overset{NH_3}{\longrightarrow}~~Na(NH_3)_6^+~~+~~Na^-(solv.)~~~~(at~high~Na^+~concentrations)} \nonumber \]
Como los electridos o los sodios las soluciones son excelentes agentes reductores. En algunos casos, incluso se pueden utilizar para reducir los metales a estados de oxidación negativos.
\[\sf{Na(NH_3)_6^+~~+~~e^-(solv.)~~+~~Au(s)~~\longrightarrow~~Na(NH_3)_6^+~~+~~Au^-(solv.)} \nonumber \]
En presencia de un catalizador el electrón solvatado se descompone reduciendo el amoníaco.
\[\sf{2~e^-(solv.)~~+~~2~NH_3~~\overset{catalyst}{\longrightarrow}~~2~NH_2^-~~+~~H_2} \nonumber \]
Sintéticamente, las soluciones de sodio-amoníaco son útiles para la preparación de acetiluros y complejos organometálicos reducidos.
\[\sf{R-C≡C-H~~+~~Na^+(solv.)~~+~~e^-(solv.)~~\longrightarrow~~R-C≡C:^-Na^+~~+~~{\textstyle \frac{1}{2}}~H_2} \nonumber \]
\[\sf{Fe(CO)_5~~+~~2~Na^+(solv.)~~+~~2~e^-(solv.)~~\longrightarrow~~(Na^+)_2[Fe(CO)_5^{2-}]~~+~~{\textstyle \frac{1}{2}}~H_2} \nonumber \]
Las sales eléctricas sólidas, es decir, en las que el anión es un electrón libre, pueden incluso prepararse añadiendo un ligando que encapsula y estabiliza el catión metálico y luego permitiendo que el disolvente se evapore lejos del electrón solvatado.
\[\sf{Na(NH_3)_6^+~~+~~e^-(solv.)~~+~~encapsulating~ligand~~\underset{-6~NH_3}{\longrightarrow}~~Na(encapsulating~ligand)^+e^-(s)} \nonumber \]
La mayoría de las sales eléctricas sólidas resultantes solo son estables a bajas temperaturas. Se cree que la densidad de electrones de los “contraiones” de electrones libres en los electridos cristalinos se localiza en cavidades dentro de la estructura.
El anión de sodio, sodio, Na -, se puede formar reduciendo el metal alcalino en condiciones adecuadas. Entre las sales de aniones metálicos alklai más notables se encuentra el “hidruro de sodio inverso”. El hidruro de sodio inverso es formalmente una sal H + de Na - en la que el ion H + se encapsula en una jaula de adamanzano (Figura\(\sf{\PageIndex{2}}\). Esta encapsulación ralentiza la reducción termodinámicamente favorable de H + por el anión sodio, estabilizando el hidruro de sodio inverso el tiempo suficiente para permitir su aislamiento.
Esquema\(\sf{\PageIndex{I}}\). “Hidruro de sodio inverso” (es decir, H + Na -).
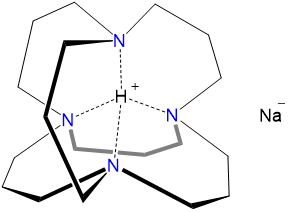
La química de los metales alcalinos depende del tamaño de los cationes de metales alcalinos.
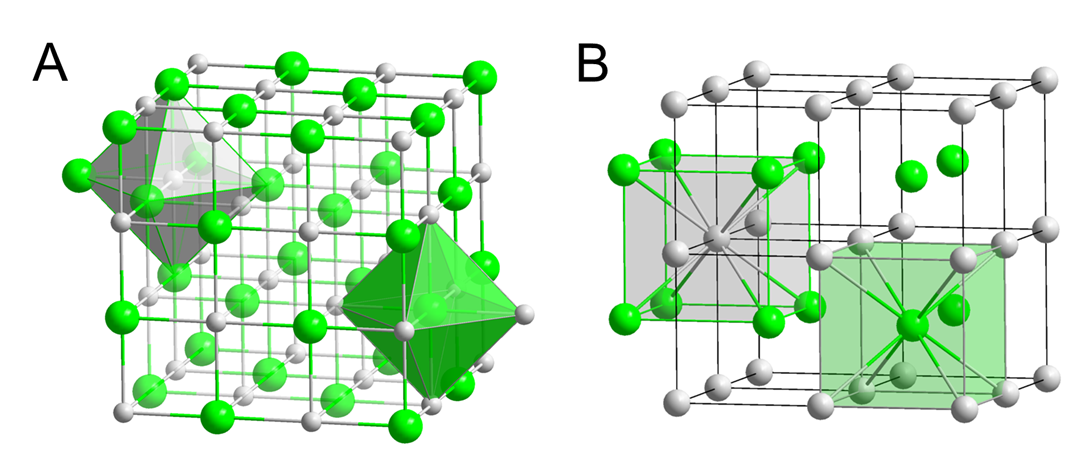
La estabilidad de los compuestos de metales alcalinos depende de la estabilización de sus cationes +1. Esta estabilidad a su vez depende del tamaño de los cationes. El tamaño del catión de metal alcalino ayuda a determinar la estructura y en algunos casos la identidad del compuesto que forma un metal alcalino dado con un nonmental dado. Un ejemplo de esto involucra las estructuras formadas por los haluros de metales alcalinos. Los haluros de cationes de metales alcalinos más pequeños - Li +, Na +, K + y Rb + - cristalizan en la estructura de sal de roca con seis iones haluro alrededor de cada ion (Figura\(\sf{\PageIndex{2A}}\)). En contraste, los cloruros, bromuros y yoduros del ion Cs + más grande cristalizan en la estructura CsCl, en la que hay seis haluros alrededor del ion Cs + más grande (Figura\(\sf{\PageIndex{2B}}\)).
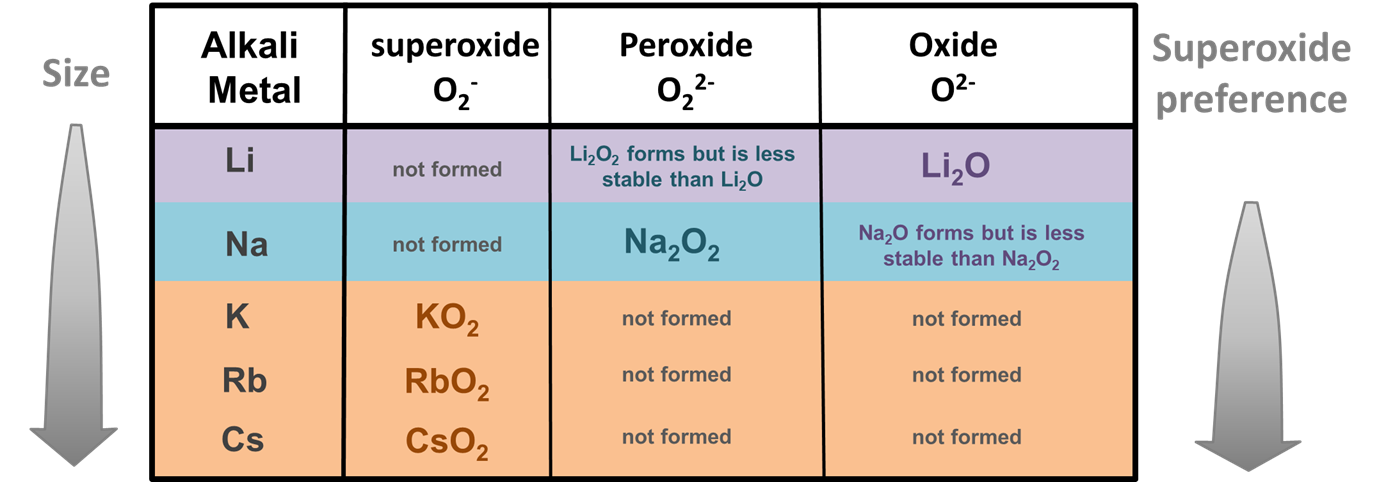
También se cree que los efectos del tamaño son responsables de la tendencia inusual de los metales alcalinos a formar peróxidos y superóxidos cuando se queman en exceso de oxígeno. Mientras que la mayoría de los metales forman óxidos de gallina quemados en exceso de oxígeno, Li y Na también forman sales 2:1 del ion peróxido más grande (O 2 -) y sales K, Rb y Cs 1:1 del ion superóxido igualmente grande (O 2 -) (Figura\(\sf{\PageIndex{3}}\)).
Quizás los ejemplos más llamativos de efectos de tamaño en la química de metales alcalinos involucran complejos de metales alcalinos con ligandos macrocíclicos, particularmente éteres corona y criptandos como los mostrados en la Figura\(\sf{\PageIndex{4}}\).
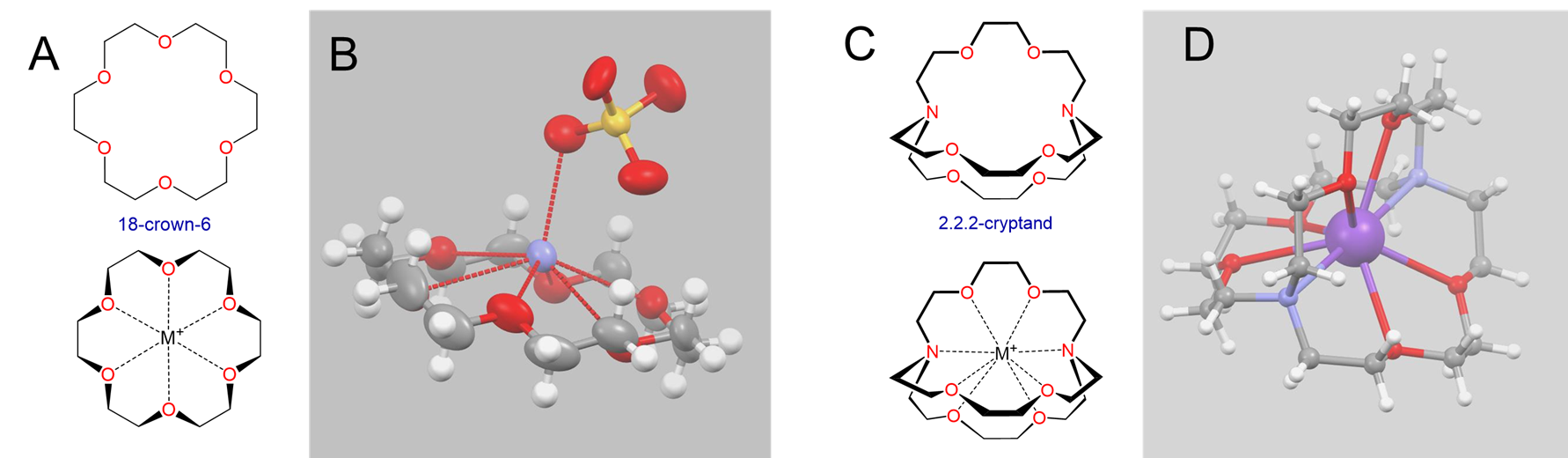
Los éteres corona y criptandos prefieren unir cationes de metales alcalinos con tamaños que coincidan con los de su cavidad de unión. Por ejemplo, como se muestra en la Tabla\(\sf{\PageIndex{2}}\), 14-corona-4 se une preferentemente a Li +, 15-corona-5 se une preferentemente a Na +, 18-corona-6 se une preferentemente a K +, y 21-corona-7 se une preferentemente a Cs +.
Mesa\(\sf{\PageIndex{2}}\). Los éteres corona unen preferentemente cationes con tamaños que coinciden con el tamaño de la cavidad de sus conformadores en forma de corona. Los diámetros de cavidad y catión se toman de la referencia 10.
| Éter de corona |
... con un diámetro de cavidad de (en\(\mathring{\mathrm{A}} \)) |
... preferentemente se une |
... que tiene un diámetro de catión de (en\(\mathring{\mathrm{A}} \)) |
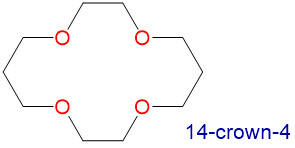 |
1.2-1.5 | Li + | 1.36 |
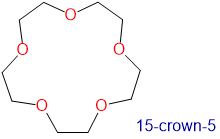 |
1.7-2.2 | Na + | 1.94 |
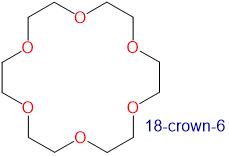 |
2.6-3.2 | K + | 2.66 |
 |
3.4-4.3 | Cs + | 3.34 |
Los ligandos de criptand también se unen preferentemente a iones de metales alcalinos con tamaños que coinciden con el tamaño de sus cavidades de unión. La estructura y tamaños de cavidad aproximados de varios criptandos se dan en el Esquema\(\sf{\PageIndex{II}}\). Use la información de Esquema\(\sf{\PageIndex{II}}\) y Tabla\(\sf{\PageIndex{2}}\) junto con un diámetro de catión de 2.98 Å para Rb + para predecir qué ion de metal alcalino se unirá preferentemente cada cripto.
Esquema\(\sf{\PageIndex{II}}\). Estructuras y diámetros aproximados de la cavidad de unión para varios criptandos.
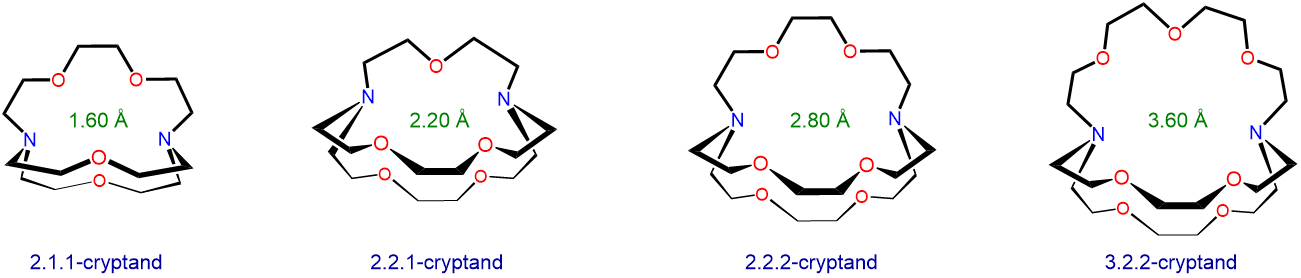
- Responder
-
Se podría esperar que los criptandos se unan selectivamente al ion más grande que encaja dentro de la cavidad. Estas predicciones se resumen en la Tabla\(\sf{\PageIndex{3}}\).
Mesa\(\sf{\PageIndex{3}}\). Selectividad predicha de éteres corona para cationes de metales alcalinos basada en la hipótesis de que se unirán selectivamente al ion más grande que se ajuste a su cavidad de unión.
Criptand ... con un diámetro de cavidad de
(Å)
... serán selectivos para ... con un radio de
(en Å)
2.1.1-criptand 1.60 Li + 1.36 2.1.1-criptand 2.20 Na + 1.96 2.1.1-criptand 2.80 K + 2.66 2.1.1-criptand 3.60 Cs + 3.34 Estas selectividades pronosticadas coinciden con las observaciones experimentales con una excepción. Resulta que 2.1.1-crypt se une preferencialmente al ion Rb + más pequeño sobre Cs +, aunque la diferencia en la constante de unión es pequeña (para más detalles ver referencia 12). Una razón de esto es la flexibilidad del sistema de anillos criptand, que permite que los sitios base de Lewis de oxígeno y nitrógeno de criptand ajusten la posición para adaptarse a las necesidades de cada metal alcalino. De hecho, debido a esta flexibilidad, los cuatro criptandos pueden unir todos los metales alcalinos, incluso aquellos que son nominalmente demasiado grandes para adaptarse al diámetro óptimo de la cavidad del criptand.
La capacidad de los macrociclos flexibles como criptandos y éteres corona para cambiar la conformación cuando se unen a un ácido de Lewis significa que las estimaciones del tamaño de cavidad dadas en Scheme\(\sf{\PageIndex{II}}\) son de utilidad limitada para predecir las fuerzas de unión relativas.
Referencias
1. Dado que las entalpías de solución implican la disolución de un sólido y las energías de ionización, la ionización de los átomos en fase gaseosa, un análisis riguroso también debe dar cuenta de la energía asociada a la sublimación.
2. Las energías de ionización se toman de Emsley, J. Los elementos 2a ed. Oxford University Press, 1991.
3. Las entalpías de hidratación se convierten en kJ/mol a partir de los valores dados en Burgess, J. Metal ions in solution Halsted Press: Chichester
New York, 1978; pp. 182-183.
4. Los éteres corona se denominan x-corona-y después del número total de átomos en el anillo, x, y el número de sitios de ligando de oxígeno, y. Así, el anillo de 18-corona seis contiene un total de 18 átomos, 6 O y 12 C.
5. Los criptandos se denominan x.y.z.-crypt después del número de sitios de unión de oxígeno en cada una de las cadenas que conectan los dos grupos amina. Así 2.2.2-crypt consiste en dos aminas conectadas por tres cadenas de diéter.
6. Bard, A. J.; Parsons, R.; Jordan, J.; Unión Internacional de Química Pura y Aplicada., Potenciales estándar en solución acuosa. 1a ed.; M. Dekker: Nueva York, 1985.
7. Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Tinte, J. L., “Hidruro de sodio inverso”: Una sal cristalina que contiene H+ y Na. Revista de la American Chemical Society 2002, 124 (21), 5928-5929.
8. Braga, D.; Módena, E.; Polito, M.; Rubini, K.; Grepioni, F., Formas cristalinas de complejos altamente “dinámicos” de 18 coronas [6] con M [HSO4] y M [H2PO4] (M+ = NH4+, Rb+, Cs+): comportamiento térmico y preparación en estado sólido. Nueva Revista de Química 2008, 32 (10), 1718-1724.
9. Brennessel, W. W.; Ellis, J. E., (2.2.2-Cryptand) tetra-carbonil-cobaltato de potasio (-I). Acta Crystallogr Secc E Struct Rep Online 2014, 70 (Pt 5), m180-m180.
10. Pederson, C.J. “Compuestos Macrocíclicos Multidentados Sintéticos” en Izatt, R. M.; Christensen, J. J., (eds.) Compuestos macrocíclicos multidentados sintéticos. Prensa académica: Nueva York, 1978; pp. 24-25.
11. Wagner, M. J.; Tinte, J. L., Alcaluros, Electricos y Metales Expandidos. Revisión Anual de Ciencia de Materiales 1993, 23 (1), 223-253.
12. Tinte, J. L., Electricos, Iones Metálicos Cargados Negativamente y Fenómenos Relacionados. En Progreso en Química Inorgánica, Lippard, S. J., Ed. Wiley: 1984; pp 327-441.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

