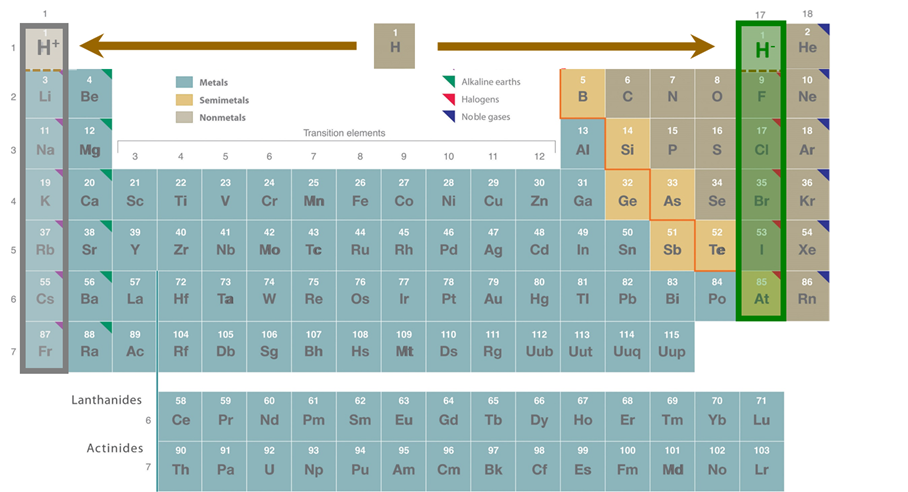
8.4.1: Propiedades Químicas del Hidrógeno
- Page ID
- 81468
Propiedades Químicas
Como se describe en la Sección 8.1.1.2. , el hidrógeno y el helio se distinguen de todos los demás elementos en que su caparazón de valencia solo consiste en el orbital de 1 s. En el caso del hidrógeno atómico neutro este orbital está ocupado por un electrón. En consecuencia, la química del hidrógeno se distingue por disposiciones de enlace estables en las que el orbital de 1 s se “llena” por cualquiera
- pérdida de un electrón para dar ión hidrógeno, H +. En fases condensadas, estos iones H + se estabilizan típicamente como aductos de base de Lewis (por ejemplo, en especies como H 3 O + y NH 4 +)
- ganancia de un electrón para dar ion hidruro, H -. Este tipo de unión explica adecuadamente el comportamiento de muchos hidruros metálicos.
- intercambio por pares de electrones para dar enlaces covalentes E-H que pueden ser descritos adecuadamente por la teoría de Lewis.
- intercambio multicéntrico de electrones en enlaces covalentes multicéntricos, como los de hidruros que unen dos o más átomos.
- aportando electrones y orbitales a la estructura de banda de una red de estado sólido. Esto es común en hidruros intersticiales/metálicos.
Las cuatro primeras de estas posibilidades se resumen en Scheme\(\sf{\PageIndex{I}}\).
Esquema\(\sf{\PageIndex{I}}\). Arreglos de enlace comunes para hidrógeno. Los enlaces E-H y E-E en el hidruro puente representan compartir dos o más electrones entre los tres átomos.

Hidrógeno Elemental
A temperatura y presión ambiente existe hidrógeno elemental en forma de dihidrógeno, H 2. El dihidrógeno es un gas inodoro incoloro que encuentra una amplia aplicación industrial.
Preparación
En el laboratorio H 2 se puede preparar por las reducciones electrolíticas o químicas del agua que impliquen la media reacción.
\[\sf{2H_2O + 2e^- \rightarrow H_2 + OH^-} \nonumber \]
Tales reducciones se llevan a cabo comúnmente en soluciones ácidas ya que los potenciales requeridos son menores, como puede verse en el diagrama de Pourbaix para hidrógeno dado en la Figura\(\sf{\PageIndex{2}}\).

Un método común es agregar Zn a una solución de ácido clorhídrico.
\[ \sf{2~H^+(aq)~~+~~Zn(s)~\rightarrow H_2(g)~~+~~Zn^{2+}(aq) } \nonumber \]
En la electrólisis los electrones provienen de la oxidación del agua en el ánodo para que la producción de hidrógeno implique la división del agua
\[ \sf{2~H_2O(l)~~ \rightarrow~~2~H_2(g)~~+~~O_2(g)} \nonumber \]
Industrialmente es más común producir hidrógeno a través del reformado con vapor de metano y otros hidrocarburos.
\[ \sf{CH_4(g)~~+~~H_2O(g)~\overset{Ni}{\longrightarrow}~CO(g)~~+~~3~H_2(g)~~~~(steam~reforming)} \nonumber \]
En este proceso el formalmente C 4- del metano actúa como reductor. El producto del reformado con vapor es una mezcla de CO y H 2. . Mezclas similares también pueden ser producidas por la descomposición térmica anaeróbica de compuestos orgánicos y en reacciones de gasificación objetivo. En todos los casos se les llama gas de síntesis (es decir, gas de síntesis) ya que pueden ser utilizados en otras síntesis industriales. Su componente de CO es capaz de actuar como reductor por lo que se puede producir hidrógeno adicional a partir de él a través de la reacción de desplazamiento agua-gas.
\[ \sf{CO(g)~~+~~H_2O(g)~\rightarrow~CO_2(g)~~+~~H_2(g)~~~~(water~gas~shift)} \nonumber \]
El “craqueo” de hidrocarburos también sirve como fuente de hidrógeno producido industrialmente, aunque los alquenos así producidos son quizás aún más importantes como fuente de la mayoría de los productos químicos orgánicos básicos.
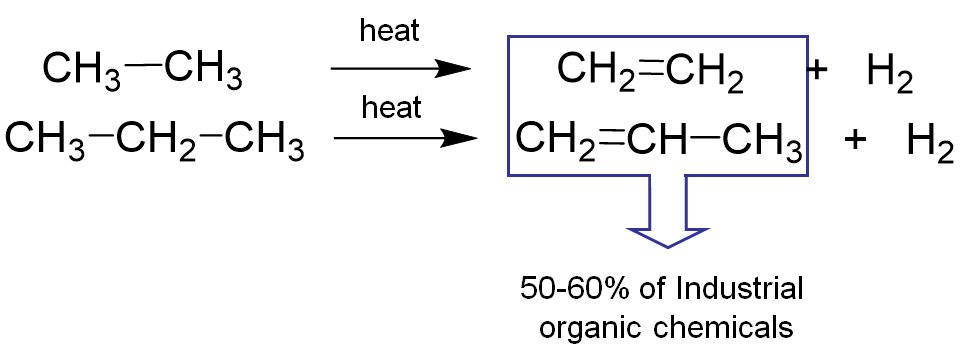
Gran parte del hidrógeno producido industrialmente se consume en la síntesis de amoníaco de Haber-Bosch. Las cantidades involucradas son tales que la producción de hidrógeno para este propósito se ha estimado de diversas maneras para representar 1-2% del consumo global de energía.
\[\sf{N_2(g)~~+~~3~H_2(g)~\rightarrow~2NH_3(g)~~~~(Haber~Bosch~process)} \nonumber \]
También se ha considerado el dihidrógeno para su uso como combustible ya que su combustión es a la vez altamente exotérmica y verde, dando lugar solo al agua.
\[\sf{2~H_2(g)~~+~~O_2(g)~\rightarrow~2H_2O(g)} \nonumber \]
Uno de los principales obstáculos para la implementación del hidrógeno como combustible es que su producción por reforma de vapor y la reacción de desplazamiento agua-gas genera CO & CO 2 y cuesta más energía que la que se obtiene de su combustión. Por esta razón, la división fotocatalítica del agua se considera uno de los griales de bodega de la investigación energética.
Compuestos
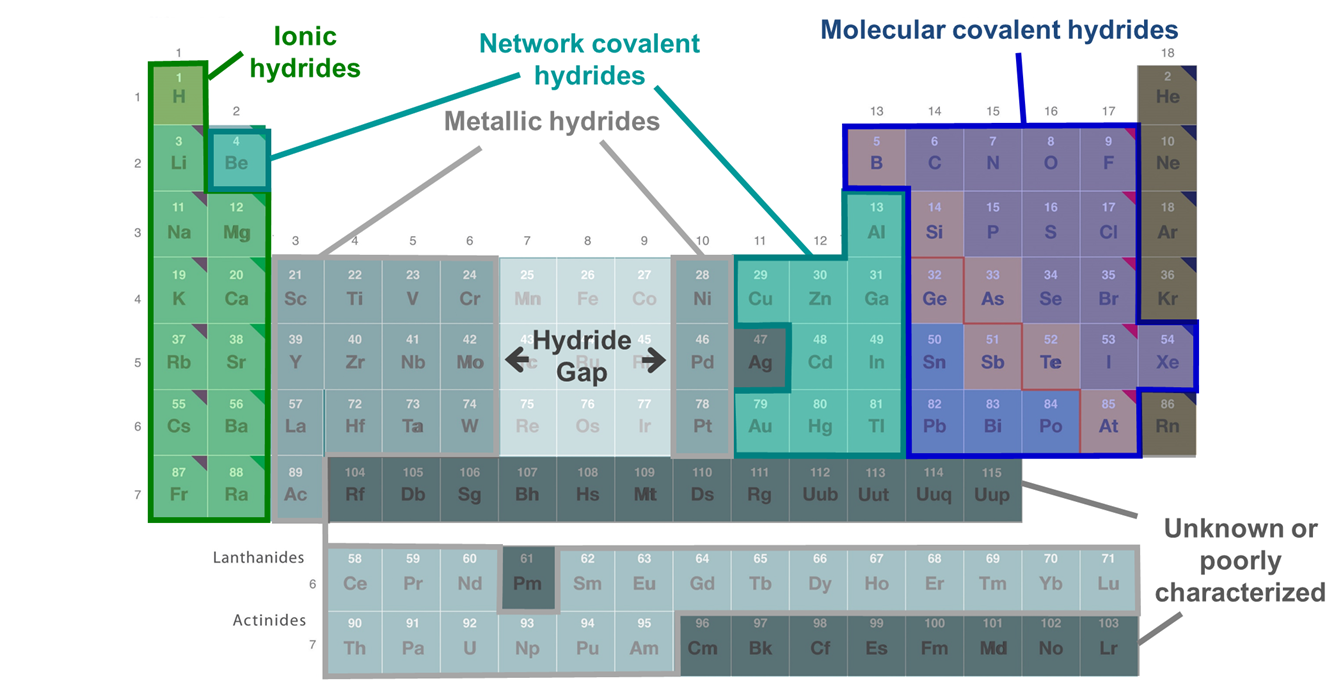
Los compuestos de hidrógeno se denominan hidruros, contengan o no anión hidruro. Hay tres tipos principales de hidruros: hidruros iónicos, covalentes e intersticiales. Como se muestra en la tabla periódica de hidruros dada en la Figura\(\sf{\PageIndex{3}}\), los hidruros intersticiales o metálicos están formados por algunos metales de transición mientras que los hidruros iónicos están formados principalmente por metales más electropositivos e hidruros covalentes por los no metales. Se dice que los hidruros de Be, algunos metaloides y algunos metales posteriores a la transición son hidruros intermedios ya que forman estructuras covalentes de red (a veces además de las moleculares) y tienden a funcionar como bases y donantes de hidruro como los hidruros iónicos. No se sabe que todos los metales de transición forman hidruros. No se conocen hidruros para los metales de transición de los grupos 7-9, que se dice que constituyen el hueco de hidruro.
Hidruros iónicos (también conocidos como hidruros salinos)
Los hidruros iónicos son sales metálicas del anión hidruro, H -. Estos están formados por el álcali y todos los metales alcalinotérreos excepto Be. Estos se preparan típicamente por reacción directa del metal y el hidrógeno.
\[\sf{2~M(s)~~+~~H_2(g)~~\overset{\Delta}{\longrightarrow}~~2~MH(s)~~~~~(M~=~Li,~,Na~,K~Rb)} \nonumber \]
\[\sf{M(s)~~+~~H_2(g)~~\overset{\Delta}{\longrightarrow}~~2~MH_2(s)~~~~~(M~=~Mg,~,Ca~,Sr~Ba)} \nonumber \]
Como sales de hidruros H-iónicos forman redes iónicas (la estructura de NaCl es común para MH, el Rutilo y PbI 2 para MH 2).
Los hidruros químicamente iónicos actúan como
- agentes reductores hacia óxidos metálicos. Por ejemplo
\[\sf{2CaH_2(s)~~+~~TiO_2 (l)~\rightarrow~2CaO(s)~~+~~Ti(s)~~+~~2~H_2(aq)} \nonumber \]
- bases fuertes hacia los enlaces E-H próticos. Todos reaccionan exotérmicamente con el agua para liberar gas hidrógeno.
\[\sf{MH(s)~~+~~H_2O(l)~\rightarrow~M^+(aq)~~+~~H_2(g)~~+~~OH^-(aq)} \nonumber \]
Por esta razón CaH 2 es ampliamente utilizado como agente secante para solventes orgánicos.
También se pueden usar hidruros metálicos reactivos para desprotonar enlaces C-H reactivos
\[\sf{NaH(s)~~+~~CH_3C \equiv C-H(g)~\rightarrow~CH_3C \equiv C:^-Na^+~~+~~H_2(g)} \nonumber \]
El ion H: - en hidruros iónicos puede actuar en principio como nucleófilo. Sin embargo, en la práctica esta aplicación se limita a los hidruros menos reactivos y consecuentemente más selectivos de aluminio y boro, los cuales generalmente se clasifican como hidruros intermedios por el carácter covalente de sus enlaces E-H.
Hidruros covalentes e intermedios
Los hidruros moleculares covalentes están formados por los no metales, metaloides y muchos metales posteriores a la transición. Las propiedades químicas y físicas que poseen varían a través del grupo principal y dependen en cierta medida de la fila y de si el elemento hidruro es deficiente en electrones, rico en electrones o electrónico preciso. Específicamente,
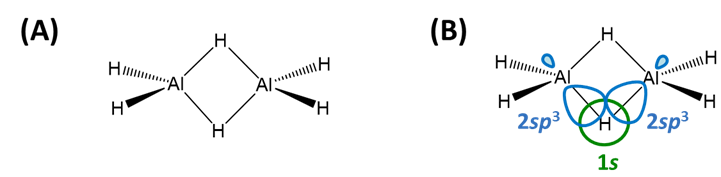
Los hidruros deficientes en electrones son los de Be y los elementos del grupo 13 (B, Al, Ga, In y Tl) para los cuales el elemento monomérico neutro hidruro (BeH 2, BH 3, AlH 3, Gah 3, InH 3 y TLh 3 no posee suficientes electrones para satisfacer la regla del octeto. Por lo tanto, estos hidruros comúnmente forman dímeros (B, Al, Ga, In, Tl) o polímeros (Be) mantenidos juntos por puentes de enlaces E-H-E (Esquema\(\sf{\PageIndex{IIA}}\)). Estos enlaces E-H-E se explican como enlaces tricentrales de dos electrones en la teoría de enlaces de valencia Esquema\(\sf{\PageIndex{IIB}}\) pero también pueden describirse en términos de orbitales moleculares Nota\(\sf{\PageIndex{1}}\).
Esquema\(\sf{\PageIndex{II}}\). (A) Enlace puente E-H-E en Al 2 H 6 y (B) su descripción de enlace de valencia en términos de superposición entre los orbitales H 1 s y Al sp 3.
Los hidruros precisos de electrones y ricos en electrones están formados por C, N, O, F y sus congéneres más pesados. Estos enlaces E-H en estos pueden describirse como enlaces E-H clásicos de dos centrales de dos electrones de la teoría de Lewis. Los hidruros de electrones precisos y ricos en electrones se distinguen en que los hidruros ricos en electrones poseen electrones de pares solitarios mientras que los hidruros de electrones precisos no. En otras palabras
- Los hidruros de electrones precisos son los de los elementos del grupo 14, e incluyen los alcanos, alquenos y alquinos de carbono junto con SiH 4, GeH 4, SnH 4 y PbH 4, de los cuales los aductos de hidruro de compuestos del grupo 13 EH 3 como BH 4 - y AlH 4 - son análogos.
- Los hidruros ricos en electrones son NH 3, H 2 O, HF y sus análogos más pesados (PH 3, H 2 S, HCl, etc.). Independientemente de la clasificación del hidruro, la estabilidad de los hidruros de elementos disminuye en un grupo. Por ejemplo, entre el grupo 14 elementos sigue el orden CH 4 > SiH 4 > GeH 4 > SnH 4 > PbH 4. Lo mismo ocurre con los compuestos que poseen enlaces E-E de manera que si bien se conoce una gran cantidad de alcanos hay relativamente pocos silanos, menos germanos, y solo se conocen los analougues orgánicos del estannano (como (CH 3) 3 Sn-Sn (CH 3) 3).
La distinción entre hidruros precisos de electrones y ricos en electrones es importante principalmente al pensar en las propiedades de base ácida de Lewis de los hidruros del elemento. Como se ilustra en Scheme\(\sf{\PageIndex{III}}\), los hidruros deficientes en electrones tienden a funcionar como ácidos de Lewis e hidruros ricos en electrones como bases de Lewis y ácidos de Brønsted.
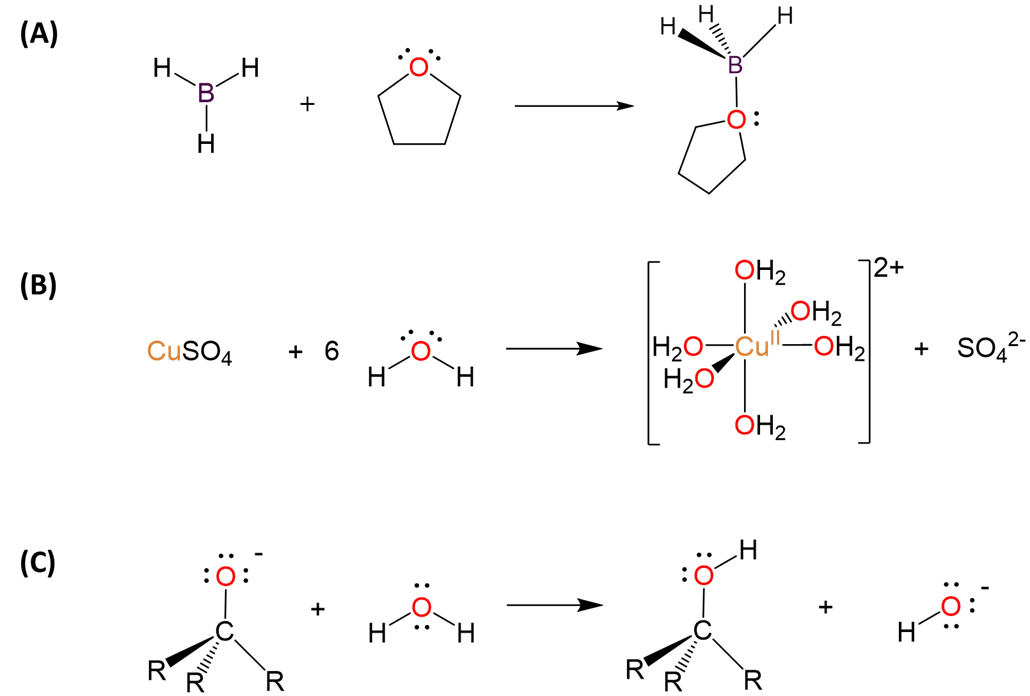
Esquema\(\sf{\PageIndex{III}}\). En ausencia de ácidos o bases extremadamente fuertes (A) hidruros deficientes en electrones como BH 3 tienden a actuar como ácidos de Lewis en la formación de dductos con bases como THF, mientras que hidruros ricos en electrones como pueden actuar como (B) bases de Lewis a través de sus pares solitarios, como agua con Cu 2+ cuando CuSO anhidro 4 se disuelve en agua, o (C) como ácidos de Brønsted, como lo hace el agua cuando se usa para inactivar el producto alcóxido de una reacción de adición nucleofílica.
La reactividad de los hidruros de electrones precisos depende de las características de E. Por ejemplo, mientras que la mayoría de los alcanos no actúan como ácidos de Lewis en el carbono, la fila 3 y los hidruros precisos de electrones más pesados pueden formar aductos bipiramidales trigonales.
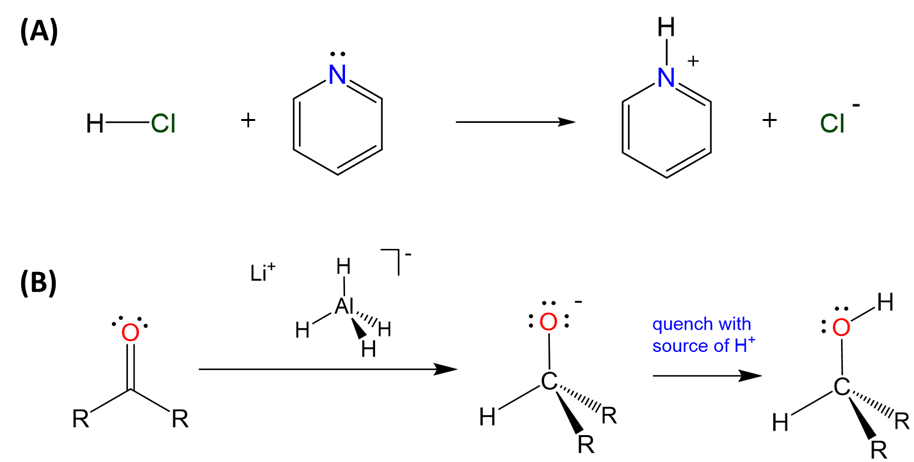
Además, todos los hidruros de elementos, ya sean deficientes en electrones, precisos o ricos, pueden funcionar como ácidos Brønsted débiles o donantes de hidruro dependiendo de la polaridad del enlace E-H. Los hidruros en los que el hidrógeno se une a elementos ricos en electrones y electornegativos tienden a actuar como ácidos de Brønsted, mientras que los que involucran más elementos electropositivos tienden a funcionar como donantes de hidruro, como se ilustra en el Esquema\(\sf{\PageIndex{IV}}\).
Esquema\(\sf{\PageIndex{IV}}\). (A) El hidruro rico en electrones de cloro actúa como ácido de Brønsted en la formación de un complejo de piridinio mientras que (B) el hidruro relativamente electropositivo en tetrahidroaluminato es ampliamente utilizado como donante de hidruro en química orgánica, como lo ilustra el uso de hidruro de litio y aluminio para formar alcoholes de cetonas.
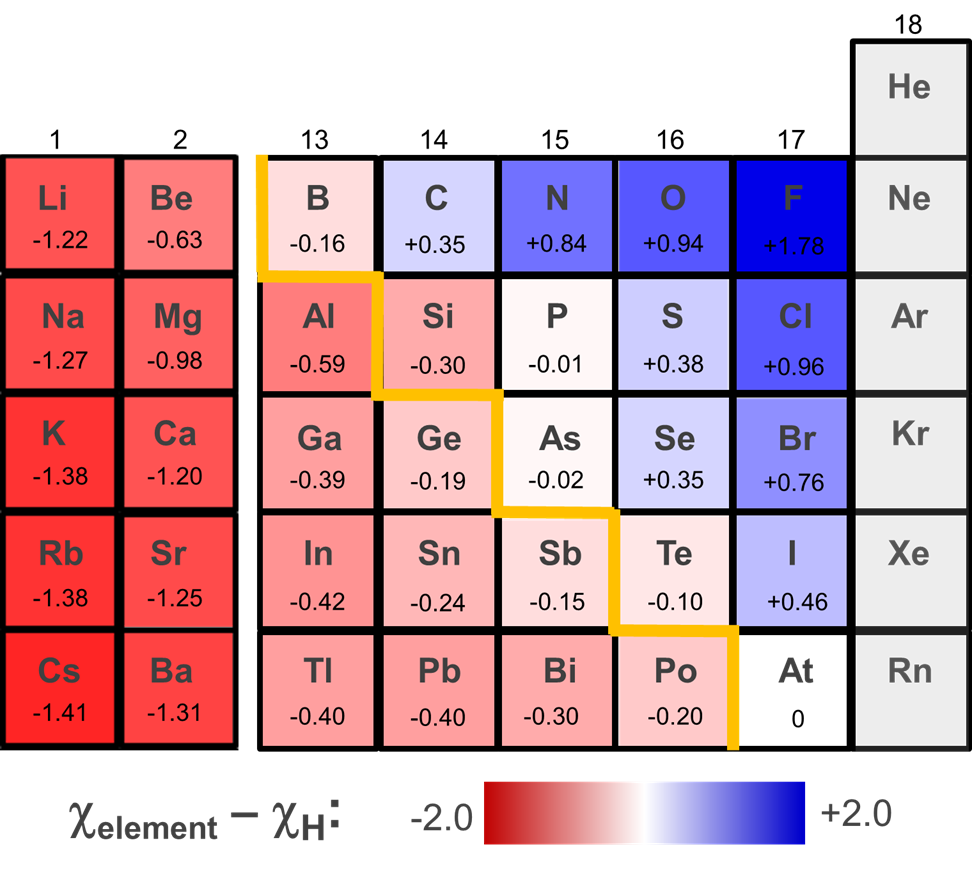
La capacidad de un hidruro de elemento dado para funcionar como un donador de ácido o hidruro puede ser modificada por varios factores. Una de ellas es la energía de solvatación de las especies formadas. Según la Figura\(\sf{\PageIndex{4}}\), podría esperarse que Germana (GeH 4) funcione como donante de hidruro. Sin embargo, se puede desprotonar en amoníaco líquido, probablemente debido a la gran energía de solvatación del ion H + resultante.
\[\sf{GeH_4~~\overset{NH_3(l)}{\longrightarrow}~~H^+(solv.)~~+~~GeH_3^-(solv.)} \nonumber \]
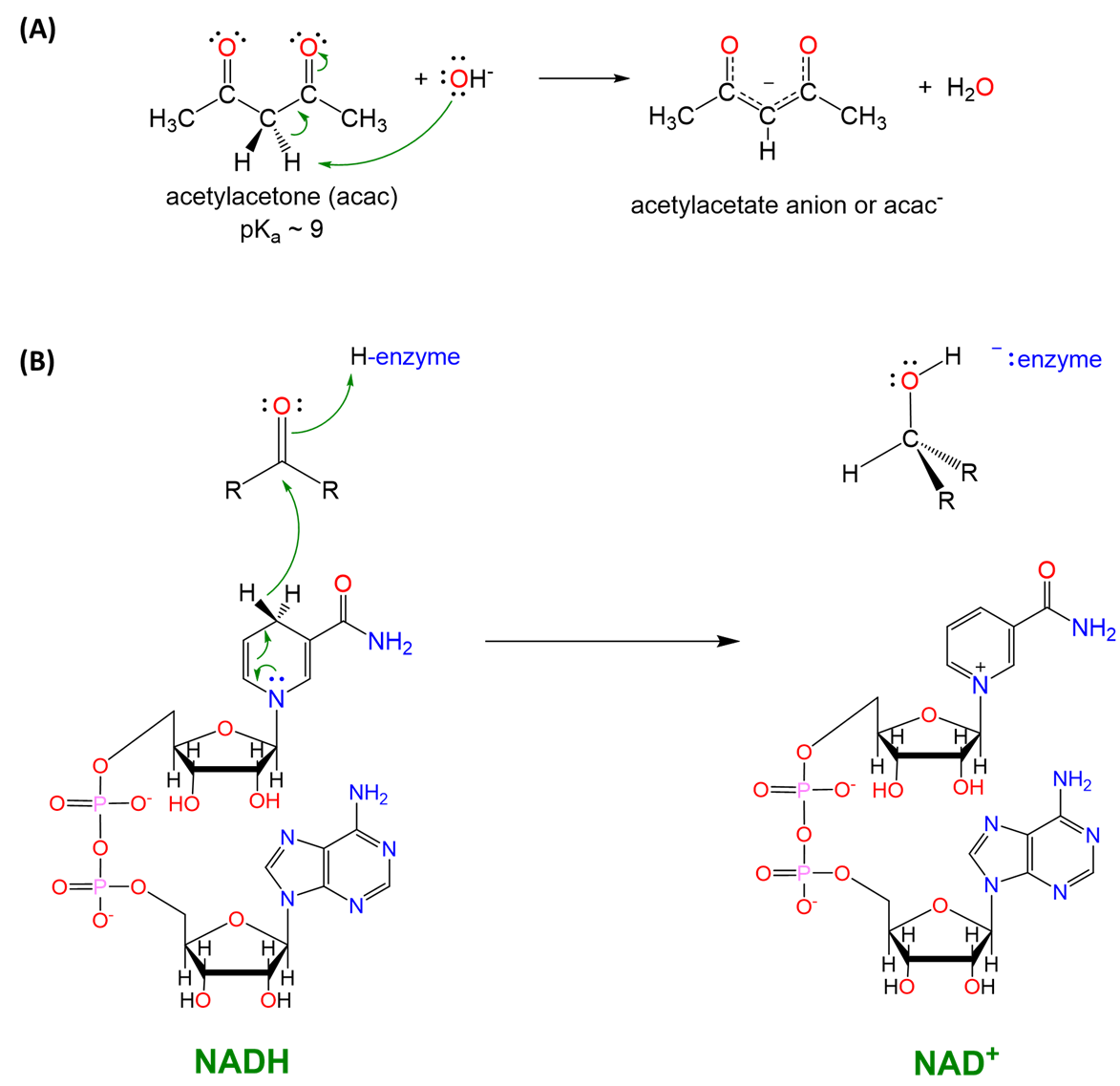
También juegan un papel los factores electrónicos que afectan la estabilidad de las formas conjugadas de ácido o base del hidruro del elemento. Por ejemplo, los enlaces carbono-hidrógeno son normalmente muy débilmente ácidos pero pueden (A) actuar como ácidos de Brønsted fuertes cuando el anión resultante está altamente estabilizado o (B) Esto se ilustra por la capacidad bien conocida de los enlaces C-H para funcionar como ácidos de Brønsted, donantes de hidruro, o ninguno dependiendo de la riqueza de electrones del centro de carbono y la estabilidad de la estructura resultante (Esquema\(\sf{\PageIndex{V}}\)).
Esquema\(\sf{\PageIndex{V}}\). (A) la química del enolato como la utilizada en la formación de ligandos de acetilacetato (acac) se basa en la capacidad de los enlaces C-H\(\sf{\alpha}\) a un carbonilo para actuar como ácidos y (B) un enlace C-H de NADH funciona como donante de hidruro en sistemas bioquímicos. Observe la similitud en la reactividad del hidruro C-H en NADH y el Al-H en LiAlH 4 mostrado en el Esquema\(\sf{\PageIndex{IV}}\).
Aspectos adicionales de la química ácido-base de los hidruros del elemento se describen en 6: Química ácido-base y donador-aceptor, así como la capacidad del hidrógeno para formar enlaces de hidrógeno.
Hidruros intersticiales (también conocidos como hidruros metálicos)
En hidruros intersticiales o metálicos el hidrógeno se disuelve en un metal para formar compuestos no estequiométricos (soluciones sólidas) de fórmula MH n. Se denominan hidruros metálicos ya que poseen las propiedades metálicas típicas de brillo, dureza y conductividad y se denominan hidruros intersticiales porque el H ocupa intersticios en una red metálica FCC, HCP o BCC, como se ilustra esquemáticamente en la Figura\(\sf{\PageIndex{5}}\).
El proceso de formación de hidruro intersticial es reversible y los metales pueden disolver cantidades variables de hidrógeno dependiendo del número de intersticios disponibles. Debido a esto, los hidruros intersticiales han sido considerados como materiales de almacenamiento para hidrógeno.
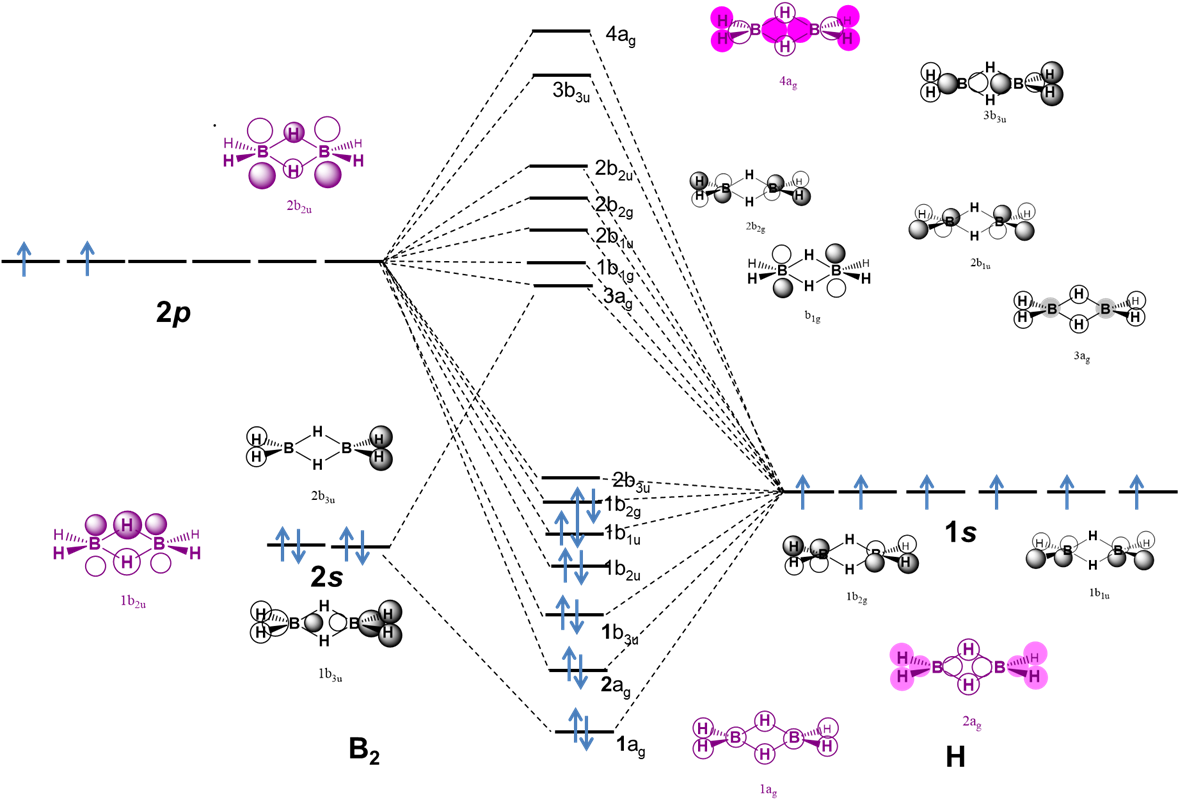
Los enlaces B-H-B en diborano también pueden explicarse usando una descripción orbital molecular, como se ilustra por el diagrama MO cualitativo en la Figura\(\sf{PageIndex{6}}\).
Referencias
1. Møller, K. T.; Jensen, T. R.; Akiba, E.; Li, H.-w., Hidrógeno - Un portador de energía sustentable. Avances en Ciencias Naturales: Internacional de Materiales 2017, 27 (1), 34-40.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

