8.7.1: Los Elementos del Grupo 14 y los muchos Alótropos del Carbono
- Page ID
- 81521
Como elementos, la capacidad del carbono para formar enlaces múltiples fuertes le permite formar muchos alótropos mientras que los elementos restantes son sólidos covalentes de red o metálicos.
Las propiedades seleccionadas de los elementos del Grupo 14 se dan en la Tabla\(\sf{\PageIndex{1}}\).
| Propiedad | Carbono | Silicio | Germanio | Estaño | Plomo |
|---|---|---|---|---|---|
| *La configuración mostrada no incluye subcarcasas d y f rellenas. | |||||
| † Los valores citados son para iones de seis coordenadas +4 en el estado de oxidación más común, excepto para C 4 + y Si 4 +, para lo cual se estiman valores para el ion de cuatro coordenadas. | |||||
| ‡ X es Cl, Br o I. La reacción con F 2 da los tetrafluoruros (EF 4) para todos los elementos del grupo 14, donde E representa cualquier elemento del grupo 14. | |||||
| símbolo atómico | C | Si | Ge | Sn | Pb |
| número atómico | 6 | 14 | 32 | 50 | 82 |
| masa atómica (amu) | 12.01 | 28.09 | 72.64 | 118.71 | 207.2 |
| configuración de electrones de valencia | 2s 2 2p 2 | 3s 2 3p 2 | 4s 2 4p 2 | 5s 2 5p 2 | 6s 2 6p 2 |
| punto de fusión/punto de ebullición (°C) | 4489 (a 10.3 MPa) /3825 | 1414/3265 | 938/2833 | 232/2586 | 327/1749 |
| densidad (g/cm 3) a 25°C | 2.2 (grafito), 3.51 (diamante) | 2.33 | 5.32 | 7.27 (blanco) | 11.30 |
| radio atómico (Å) | 1.70 | 2.10 | 2.11 | 2.17 | 2.02 |
| radio covalente (Å) | 0.75 | 1.14 | 1.20 | 1.40 | 1.45 |
| primera energía de ionización (kJ/mol) | 1086 | 787 | 762 | 709 | 716 |
| afinidad electrónica (kJ/mol) | −122 | −134 | −119 | −107 | −35 |
| Electronegatividad Pauling | 2.55 | 1.90 | 2.01 | 1.96 | 1.8 |
| producto de reacción con O 2 | CO 2, CO | SiO 2 | GeO 2 | SnO 2 | PbO |
| tipo de óxido | ácido (CO 2) | ácido neutro (CO) | anfóteras | anfótero | anfótero |
| producto de reacción con N 2 | ninguno | Si 3 N 4 | ninguno | Sn 3 N 4 | ninguno |
| producto de reacción con X 2 ‡ | CX 4 | SiX 4 | GeX 4 | SNx 4 | PBx 2 |
| producto de reacción con H 2 | CH 4 | ninguno | ninguno | ninguno | ninguno |
Como puede verse a partir de los datos de la Tabla\(\sf{\PageIndex{1}}\), consistente con las tendencias generales de las propiedades atómicas, los radios atómicos aumentan en el grupo mientras que las afinidades electrónicas, las energías de ionización y las electronegatividades generalmente disminuyen. Las tendencias no siempre son monótonas, sin embargo, probablemente debido al impacto de la contracción del bloque d en las propiedades atómicas de Ge y también las contracciones de lantánidos y actínidos sobre las de Sn y Pb.
A partir de las formas elementales comunes del grupo se evidencian 14 elementos en la Tabla\(\sf{\PageIndex{1}}\) dos tendencias:
- De acuerdo con el principio de unicidad de la segunda fila, el carbono forma una variedad más amplia de alótropos que los otros elementos del grupo 14. Específicamente, la capacidad del carbono para formar\(\pi\) enlaces fuertes le permite formar estructuras laminares deslocalizadas en forma de grafito y grafeno (láminas planas) y nanotubos y fullerenos, que pueden considerarse como láminas enrolladas para formar tubos y estructuras tipo bola, respectivamente.
- Hay una tendencia decreciente hacia la covalencia en el grupo. Mientras que C, Si y Ge forman estructuras covalentes de red y Pb una metálica. El estaño forma estructuras tanto covalentes de red como metálicas, que difieren tan ligeramente en su estabilidad que la forma metálica se interconvierte en la red covalente por encima de 13\(^{\circ}\) C.
La capacidad de Carbon para formar enlaces múltiples fuertes le permite formar una gran cantidad de alótropos moleculares y covalentes de red
La capacidad de Carbon para formar enlaces múltiples fuertes le permite formar una gran cantidad de alótropos moleculares y covalentes de red. Algunos de estos alótropos se conocen desde la antigüedad; algunos son un foco de investigación muy activa. Las principales clases de alótropos incluyen:
1. \(\alpha\)- y\(\beta\) - Grafito. La\(\alpha\) forma del grafito es el alótropo de carbono más estable. Se forma naturalmente a través de la descomposición de material carbonoso en sedimentos, pero también se puede hacer sintéticamente vaporizando el Si fuera de SiC.
\[\sf{SiC~~\overset{\Delta}{\longrightarrow}~~6~C(s)~~+~~Si(g)} \nonumber \]
La estructura de\(\alpha\) -grafito consiste en capas hexagonales de anillos interconectados de láminas de grafeno, cuya estructura se muestra en Esquema\(\sf{\PageIndex{I}}\).
Esquema\(\sf{\PageIndex{I}}\). Una representación de la estructura de resonancia de parte de una lámina de grafeno.
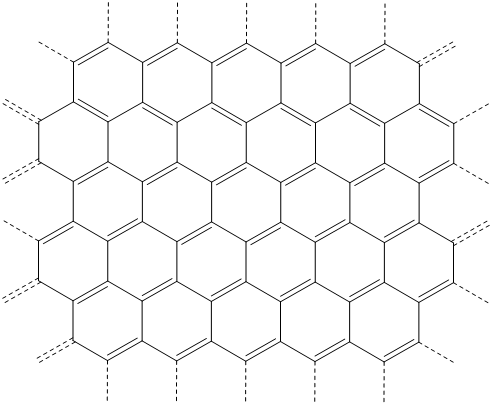
Todos los carbonos en la lámina de grafeno son planos trigonales y están conectados por una red de enlaces covalentes que pueden describirse adecuadamente como que involucran solapamientos sigma entre orbitales sp 2 y una red de\(\pi\) enlaces deslocalizados. Este sistema de\(\pi\) unión deslocalizado implica una banda de valencia medio llena de orbitales\(\pi\) tipo y es responsable de la buena conductividad eléctrica del grafito.
En términos del impacto de los\(pi\) enlaces deslocalizados en la estructura del grafito, asegura que las láminas de grafeno sean planas con\(\pi\) nubes deslocalizadas por encima y por debajo del plano de carbono. Debido a esto, las láminas pueden apilarse juntas en diversas disposiciones en las que los carbonos en las capas adyacentes pueden eclipsarse o escalonarse entre sí, como se muestra en la Figura\(\sf{\PageIndex{1}}\). La forma estable\(\alpha\) de grafito posee capas escalonadas alternando un patrón AB mientras que en el\(\beta\) grafito ligeramente menos estable las capas están escalonadas en una disposición ABC (Figura\(\sf{\PageIndex{1b}}\)).
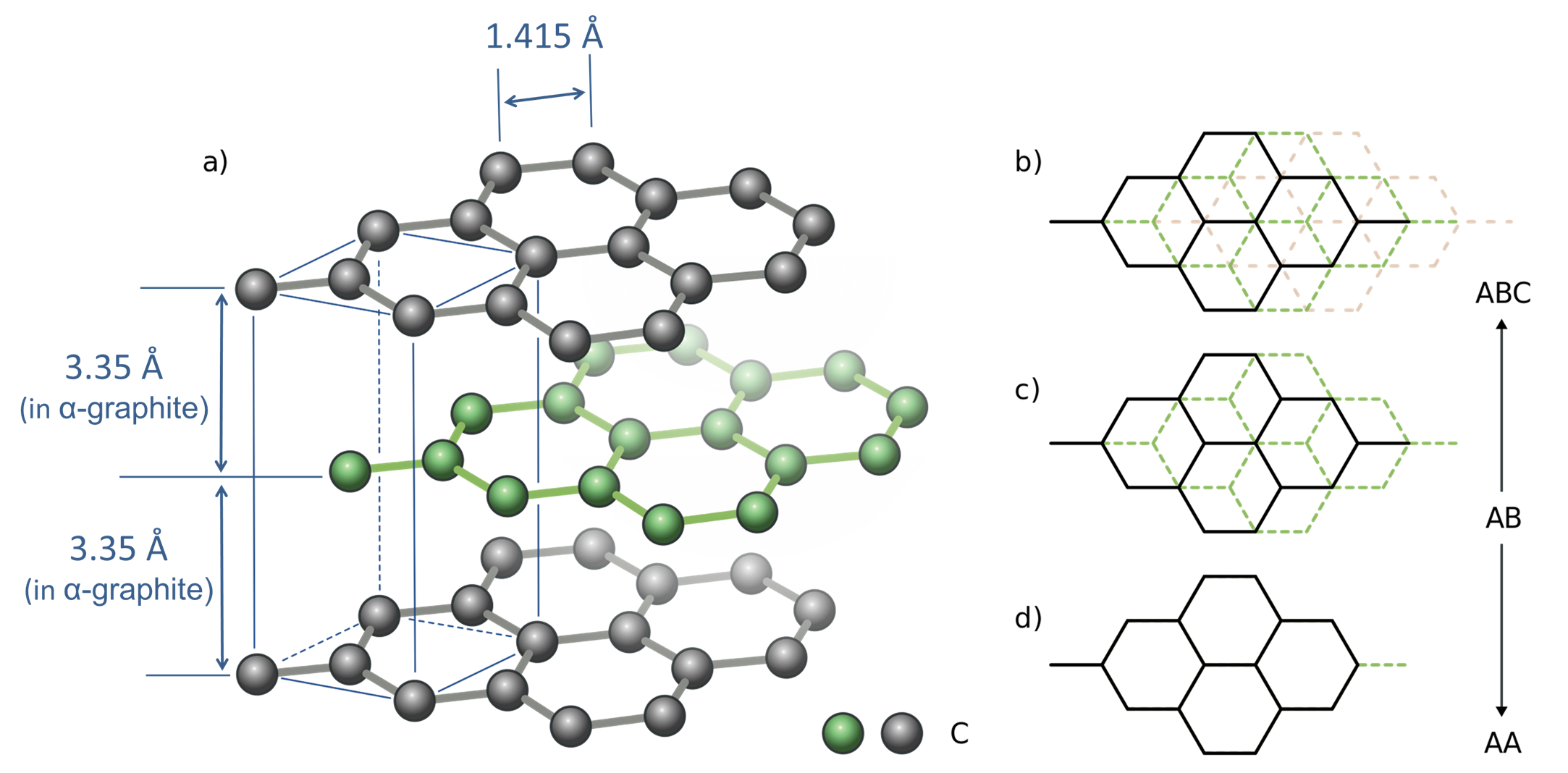
Dado que las fuerzas entre las capas de grafeno no varían mucho a medida que las láminas se mueven una junto a la otra, es relativamente fácil que se produzca el deslizamiento de la capa y el grafito funciona efectivamente como lubricante. Además, es posible exfoliar láminas de grafeno individuales utilizando cinta adhesiva y métodos de exfoliación química.
2. Grafeno. Las láminas individuales de grafeno como la representada en Scheme\(\sf{\PageIndex{I}}\) han sido objeto de una intensa investigación experimental y teórica como nanomaterial 2D. Debido a los fuertes enlaces carbono-carbono que mantienen unida la lámina, el grafeno libre de defectos es el material más fuerte conocido, aunque quebradizo; y una estructura de banda que lo convierte en un buen conductor de electricidad y conduce a propiedades ópticas inusuales. Entre estos últimos, incluso una sola capa de grafeno es visible a simple vista, como se muestra en la Figura\(\sf{\PageIndex{2}}\).

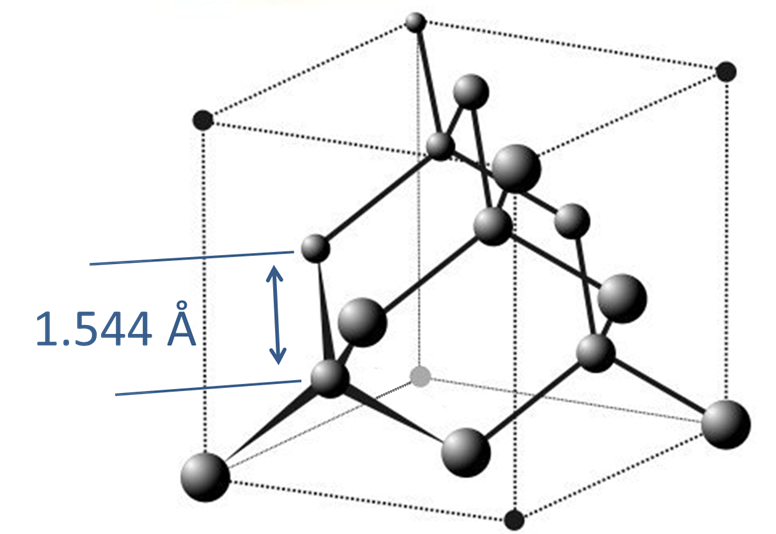
3. Diamante y Lonsdaleita. Cuando se somete a extremos de calor y presión, el grafito se convierte en su alótropo de diamante más denso, en el que todos los carbonos son tetraédricos y se mantienen unidos por enlaces sigma, como se muestra en la Figura\(\sf{\PageIndex{3}}\). En esta estructura todos los carbonos son tetraédricos y conectados en anillos de conformación de silla. Como cabría esperar de un diamante tan estrechamente interconectado, es extremadamente duro, aunque las estructuras análogas que también poseen anillos en forma de silla, específicamente BN hexagonal tipo Wurtzita y su análogo de carbono Lonsdaleita son aún más duras. Como podría esperarse de la\(\sigma\) estructura total del diamante, es un conductor eléctrico deficiente y la longitud de unión C-C de 1.544 Å en el diamante es más larga que la longitud de enlace C-C de 1.415 Å en grafito (1.415 Å).
4. Fullerenos. Desde el descubrimiento de finales de la década de 1980 del buckminsterfullereno en forma de fútbol europeo de sesenta carbonos que se muestra en la Figura,\(\sf{\PageIndex{4A}}\) se reconoce que tales moléculas han estado presentes durante mucho tiempo en hollín, negro de humo y materiales relacionados. Producidas hoy por ablación electrolítica o láser o pirólisis, se han producido un gran número de tales estructuras, algunas de las cuales se muestran en la Figura\(\sf{\PageIndex{4B}}\).
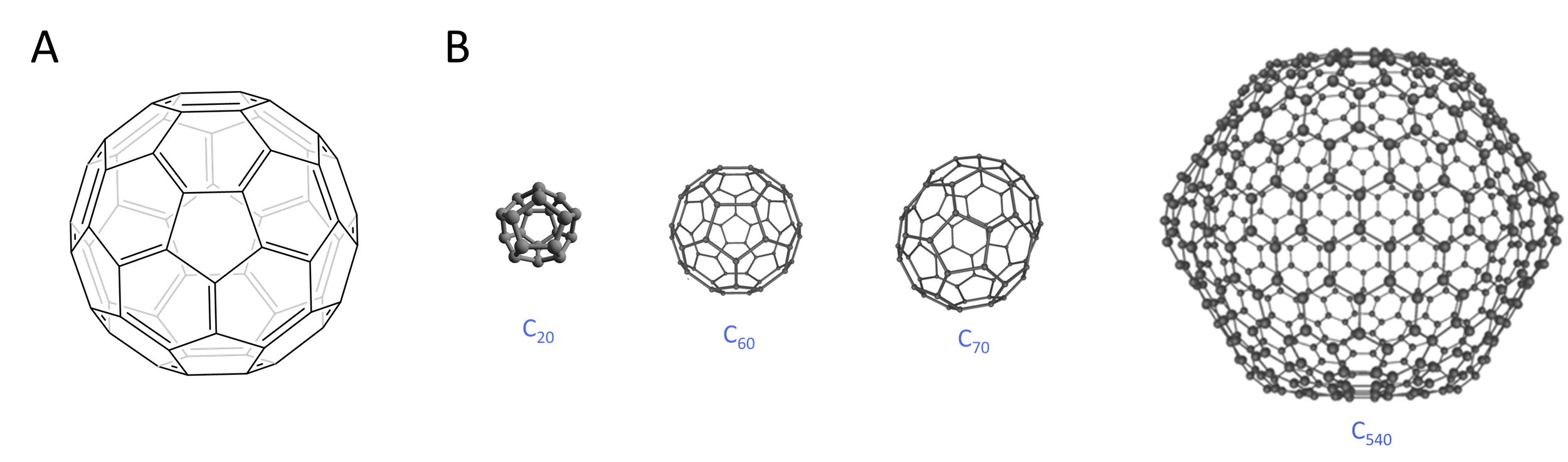 Figura\(\sf{\PageIndex{4}}\). Estructuras de varios fullerenos: (A) buckminsterfullereno, C 60, llamado así por el architecht estadounidense Buckminster Fuller, quien popularizó el uso de cúpulas geodésicas; (B) C 70, y (C) C 540 La imagen de C 20 está tomada de By Perditax - Obra propia, CC0, commons.wikimedia.org/w/inde... curid=15480223; las imágenes 3D de C 60, C 70 y C 540 se remezclan a partir de la imagen Creado por Michael Ströck (mstroeck) - Creado por Michael Ströck (mstroeck), CC BY-SA 3.0, commons.wikimedia.org/w/inde... p? curid=584786
Figura\(\sf{\PageIndex{4}}\). Estructuras de varios fullerenos: (A) buckminsterfullereno, C 60, llamado así por el architecht estadounidense Buckminster Fuller, quien popularizó el uso de cúpulas geodésicas; (B) C 70, y (C) C 540 La imagen de C 20 está tomada de By Perditax - Obra propia, CC0, commons.wikimedia.org/w/inde... curid=15480223; las imágenes 3D de C 60, C 70 y C 540 se remezclan a partir de la imagen Creado por Michael Ströck (mstroeck) - Creado por Michael Ströck (mstroeck), CC BY-SA 3.0, commons.wikimedia.org/w/inde... p? curid=584786
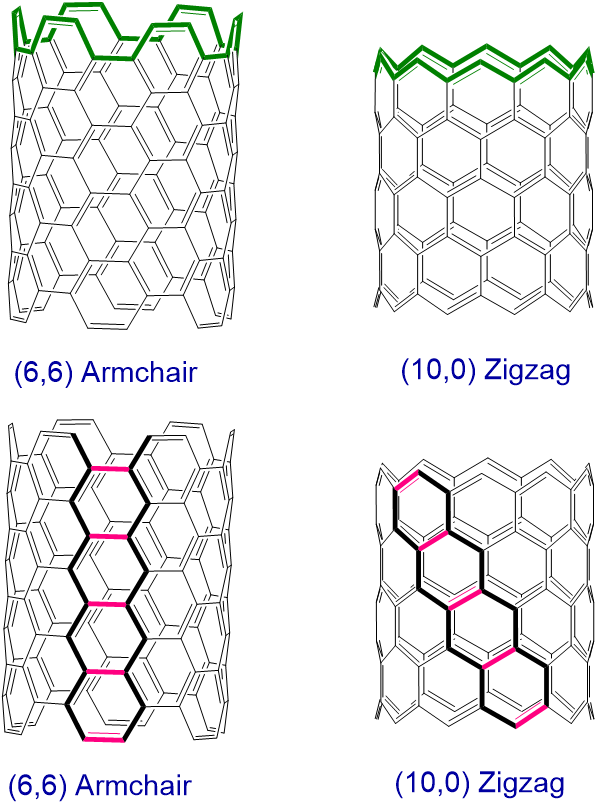
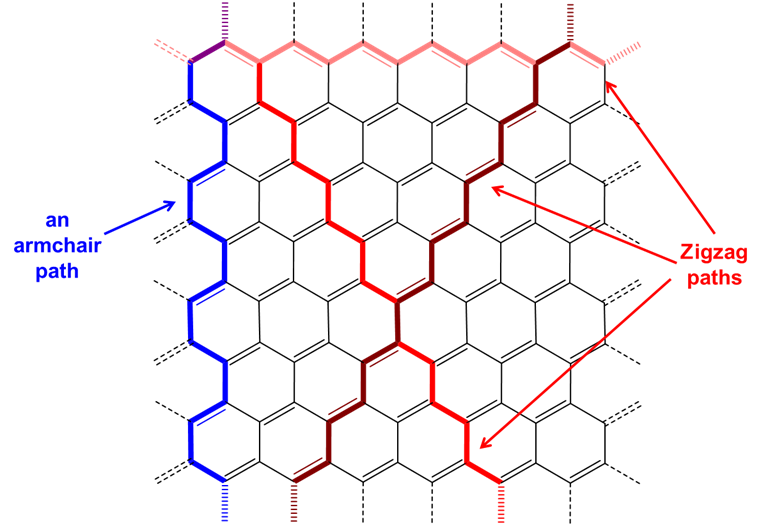
Como se muestra en la Figura\(\sf{\PageIndex{6}}\), las cadenas lineales globales de átomos de carbono conectados dentro de una lámina de grafeno se pueden clasificar como tomando una disposición en zigzag o sillón. Luego, los nanotubos se clasifican como sillón o zigzag en función de la disposición de los enlaces perpendiculares al eje del tubo (Figura\(\sf{\PageIndex{7}}\), arriba). Alternativamente, los nanotubos de sillón pueden imaginarse como formados conectando los extremos de la trayectoria en zigzag de una lámina de grafeno en la que la dirección de la trayectoria en zigzag se orienta a lo largo del eje del nanotubo mientras que en los nanotubos en zigzag las trayectorias en zigzag conectadas están anguladas con respecto al eje de hélice (Figura\(\sf{\PageIndex{7}}\), parte inferior) ).
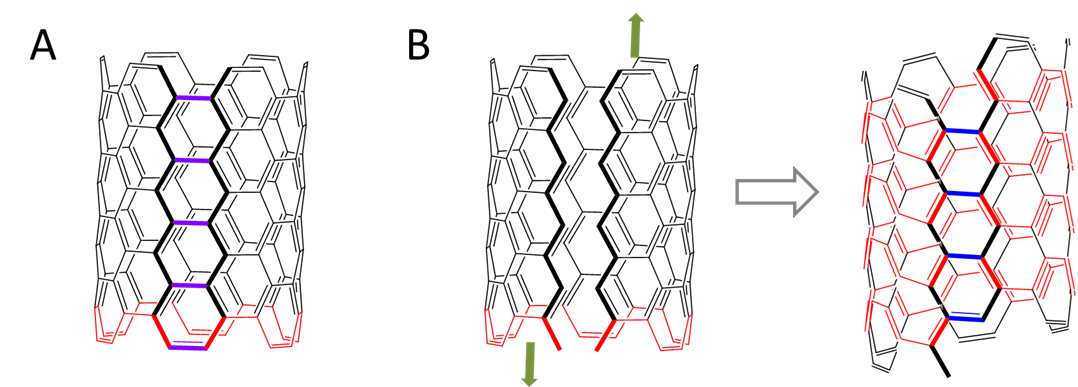
En los nanotubos de carbono ordinarios, el sillón o el camino en zigzag alrededor del tubo forman un bucle cerrado. Dichos nanotubos de carbono son relativamente lineales. En nanotubos helicoidales como el que se muestra en la Figura\(\sf{\PageIndex{7}}\). las trayectorias de sillón o zigzag forman una espiral helicoidal alrededor de la superficie del nanotubo en su lugar. Para que esto tenga lugar, los anillos de carbono no pueden ser perfectamente hexagonales, sino que están retorcidos y para aliviar la tensión resultante, los nanotubos helicoidales adquieren una forma enrollada.
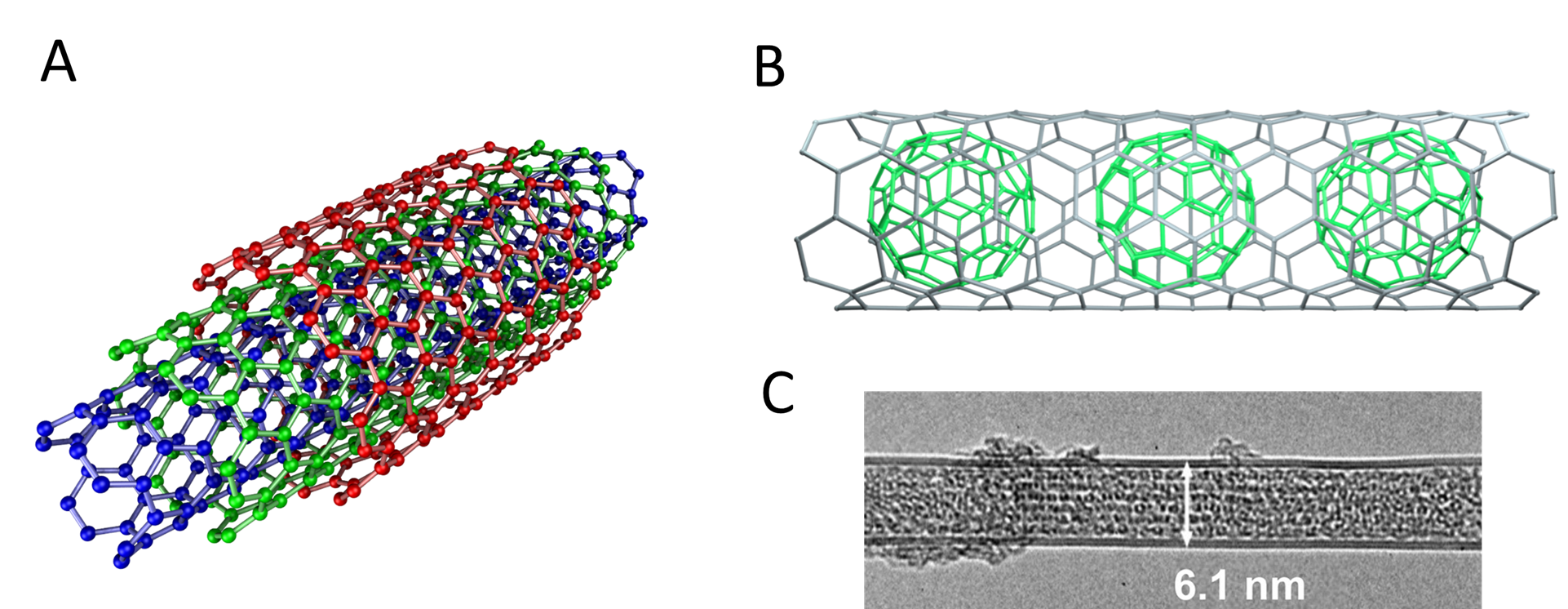
Dependiendo del tamaño del nanotubo a veces incluso es posible anidar múltiples nanotubos uno dentro del otro, “brotar” fullerenos del costado de un nanotubo, o incluso encajar fullerenos en su interior para dar un “peapod de carbono”. Algunas de las posibilidades se representan en la Figura\(\sf{\PageIndex{8}}\).
Las propiedades químicas de los fullerenos y nanotubos reflejan su estructura de las siguientes maneras
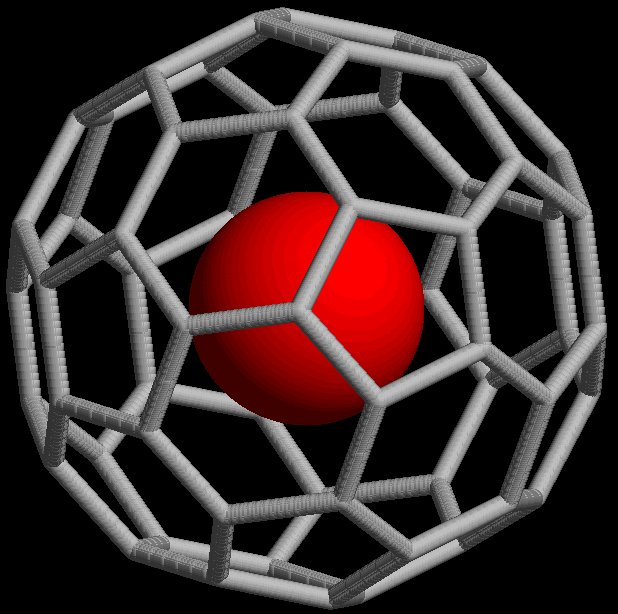
- Poseen una\(\pi\) estructura delcoalizada y, por lo tanto, pueden sufrir reacciones de oxidación y reducción fáciles. Por ejemplo, el buckminsterfullereno se puede reducir electroquímicamente en seis etapas sucesivas de un electrón para dar C 60 6 -. Reducciones similares pueden ocurrir haciendo reaccionar un fullereno con un metal activo. En muchos casos esto simplemente da como resultado una sal de un anión fulleride pero en algunos casos el metal va dentro de la jaula de fullereno para dar un fullereno endoédrico, designado M @C 60. Un modelo de tal fullereno se da en la Figura\(\sf{\PageIndex{9}}\).
- Los carbonos en estos sistemas son todos cuaternarios y por lo general solo experimentan reacciones de adición, no sustituciones.
- Mientras que las láminas planas de grafito contienen carbonos planos trigonales, los carbonos en fullerenos y naotubos deben estar ligeramente doblados en forma piramidal para acomodar la concavidad de esas estructuras. Esto da como resultado una tensión estérica considerable que se puede aliviar cuando se produce la adición en un carbono para volverlo tetraédrico. Debido a esto, los fullerenos experimentan una variedad de reacciones nueclofílicas y cicloadditonas, principalmente en los enlaces C=C que unen dos anillos de seis miembros.
Se invita a los lectores que desean una presentación más exhaustiva de la química de los fullerenos a leer este resumen de nanomateriales de carbono de Andrew Barron de la Universidad Rice.
6. Carbono vítreo. Se cree que el carbono similar al vidrio, comúnmente conocido como carbono vítreo o vítreo, consiste en una mezcla de láminas cóncavas similares a grafeno, similares a las de los naotubos y fullerenos pero no completamente envueltas para formar bolas o tubos cerrados. Tales formas de carbono se usan comúnmente en materiales de electrodos en electroquímica (por ejemplo, electrodos de carbono vítreo).
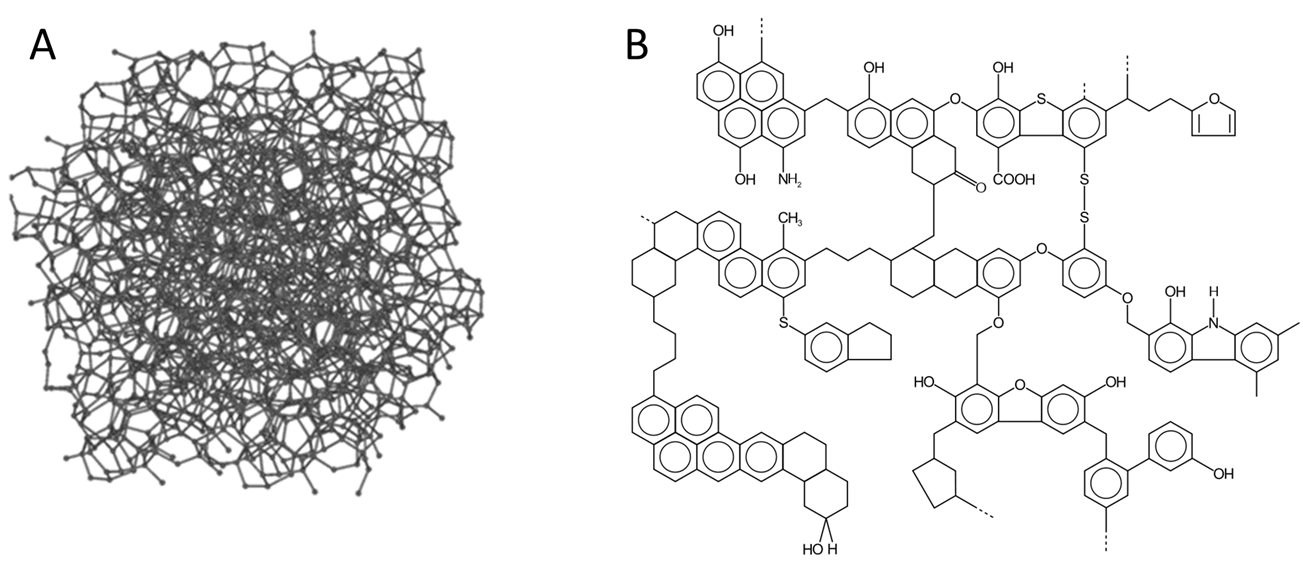
7. Materiales amorfos con alto contenido de carbono. Técnicamente, no son una sola forma o un alótropo puro, sino más bien una familia de materiales con alto contenido de carbono que incluyen carbono amorfo, negro de humo, hollín, carbón pirolizado, carbón y carbón vegetal. Estos contienen cantidades variables de hidrocarburos (particularmente hidrocarburos aromáticos policíclicos) y otros materiales orgánicos. Muchos de estos materiales contienen pequeños cristalitos de diamante y regiones similares a grafito interconectadas por una matriz amorfa de material rico en carbono. Algunas estructuras representativas se dan en la Figura\(\sf{\PageIndex{10}}\).
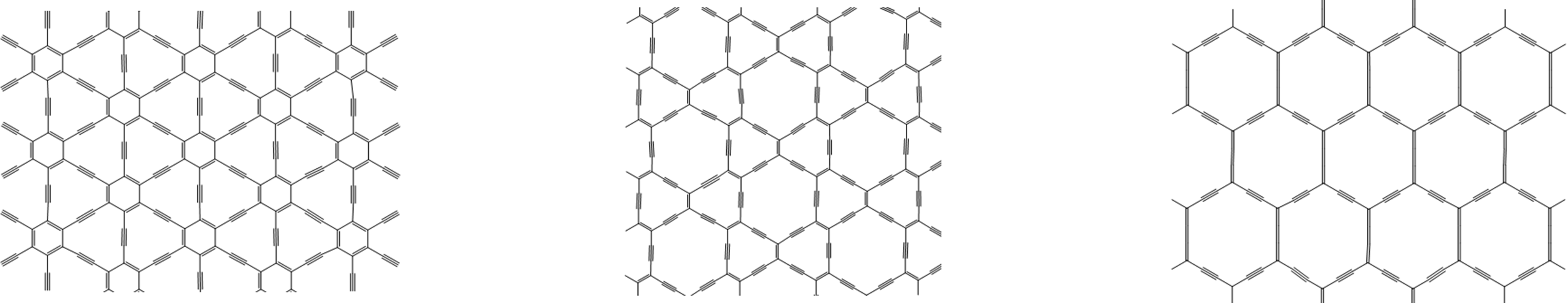
8. Graphyne - ¿un posible futuro alótropo de carbono? El descubrimiento de estructuras de fullereno y nanotubos de carbono unidas exclusivamente por enlaces C-C y C=C interconectados plantea la cuestión de si podría ser posible construir formas de carbono que incluyan o incluso estén compuestas principalmente por enlaces C=C. Estos materiales, llamados graphynes, por analogía con la estructura de doble unión del grafeno, se predice que son teóricamente estables pero hasta el momento no se han observado en la naturaleza de hechos experimentalmente. En la Figura se presenta una selección de estructuras de grafina propuestas\(\sf{\PageIndex{11}}\).
Varios isótopos del grupo 14 encuentran uso en aplicaciones analíticas. Estos incluyen:
13 C, un isótopo activo de RMN de espín 1/2 que comprende 1% de carbono natural. Es ampliamente utilizado en la RMN de carbono-13 para caracterizar estructuralmente compuestos orgánicos y organometálicos. Para más información sobre la RMN de carbono 13 y su uso en química orgánica consulte esta página.
14 C, un isótopo inestable que ocurre a ~ 1 partes por billón en la atmósfera y sufre desintegración radiactiva con una vida media de 5730 años. Dado que el nivel de 14 C en los organismos es aproximadamente igual a los niveles atmosféricos en su momento de la muerte y se descompone después de que la relación de 14 C a 12 C en una muestra derivada biológica se puede utilizar para estimar la edad de los objetos de ~60,000 años o menos. Para obtener más información sobre la datación por radiocarbono consulte esta página de textos de química libre.
29 Si, un isótopo activo de RMN de espín 1/2 que comprende ~ 5% de silicio natural. La RMN de Silicio 29 es útil como herramienta estructural para caracterizar compuestos de silicio que van desde vidrios hasta organosilanos. Aunque todavía no existe una página de textos de Chem Libre que describa la técnica, se puede encontrar una breve introducción aquí.
73 Ge, un núcleo de espín 9/2 y un spin 1/2 115 Sn, 117 Sn, 119 Sn y 207 Pb también son isótopos activos de RMN que pueden usarse para caracterizar estructuralmente compuestos de estos elementos. Su uso está fuera del alcance de este texto introductorio pero para los interesados se dispone de más información sobre el uso de estos núcleos en RMN para Ge, Sn y Pb. Además 73 Ge es activo Mössbauer, aunque existen relativamente pocos ejemplos de su uso en la caracterización de Ge en materiales que contienen GE.
Referencias
1. Los datos de propiedad atómica y física son tomados de los listados por la Royal Society of Chemistry en https://www.rsc.org/periodic-table. Muchos se redondean a un número menor de cifras significativas. Las imágenes de la estructura están tomadas de
2. Lee, C.; Wei, X.; Kysar, J. W.; Hone, J., Medición de las propiedades elásticas y la fuerza intrínseca del grafeno monocapa. Ciencia 2008, 321 (5887), 385-388.
3. Barzegar, H. R.; Gracia-Espino, E.; Yan, A.; Ojeda-Aristizabal, C.; Dunn, G.; Wågberg, T.; Zettl, A., C60/Híbridos de Nanotubos de Carbono Colapsado: Una Variante de Peapods. Nano Letras 2015, 15 (2), 829-834.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

