8.14.8: Química del Criptón (Z=36)
- Page ID
- 81491
El kriptón es uno de los seis elementos del Gas Noble (Grupo 18), los cuales son ampliamente conocidos por su relativa “inercia” y dificultad para formar compuestos químicos con cualquier otro elemento, debido a que estos elementos tienen conchas de valencia completa. Contrario al pensamiento original, sin embargo, Krypton se ha hecho reaccionar con los elementos altamente electronegativos y se utiliza en iluminación y otros fines comerciales.
Hechos
-
- Número de elemento: 36

- Configuración electrónica: [Ar] 3d 10 4s 2 4p 6
- Peso atómico: 83.798g/mol
- Color: incoloro, inodoro, insípido
- Luz: gran número de líneas espectrales, siendo la más fuerte la emisión verde y amarillo/ blanquecina
- Solidificado: estructura cristalina cúbica blanca y cristalina/centrada en la cara
- Punto de fusión: 115.79K
- Punto de ebullición: 119.92K
- Punto crítico: 209.41K
- Capacidad calorífica específica: 20.786 J/mol K
- 0.000108-0.000114% de la atmósfera
- 6 Isótopos estables
- Producido por descomposición de uranio y plutonio en la corteza terrestre en un% muy pequeño

- Número de elemento: 36
El origen y la historia
El kriptón se encuentra en los elementos del Grupo 18, también conocidos como los Gases Noble. En 1785, Henry Cavendish sugirió que el aire contenía gases no reactivos después de que no logró que una muestra de aire reaccionara. Un siglo después, los químicos británicos John Rayleigh y William Ramsey comenzaron a aislar estos gases inertes (comenzando por el argón) y los separaron en su propio grupo en la tabla periódica ya que cada uno de estos elementos tenía conchas de valencia completa de electrones. Uno de estos gases, Krypton, fue descubierto junto con Neón y Xenon por Rayleigh y su compañero químico Morris Travers en 1898 en un residuo que quedó por evaporar casi todos los componentes del aire líquido. El nombre Krypton se deriva de la palabra griega “kryptos”, que significa “oculto”. Sin embargo, la calidad inerte de estos gases fue desmentida cuando se crearon compuestos de xenón en 1962 y un compuesto de Krypton (KrF2) se sintetizó con éxito un año después. Esto demostró que este grupo de gases no es necesariamente inerte. Aunque tanto Kr como Xe tienen conchas de valencia completa, ambas son las más fácilmente ionizadas del grupo. Simplemente se necesitó un elemento de alta electronegatividad, en este caso Flúor, para obligar a Xe y Kr a reaccionar bajo altas temperaturas.
Aislamiento
Ocupa el sexto lugar en abundancia en la atmósfera. Al igual que con los otros gases nobles, el kriptón se aísla del aire por licuefacción.
Compuestos e isótopos
Aunque Krypton es naturalmente químicamente no reactivo, el difluoruro de kriptón se sintetizó en 1963.
\[Kr_{(g)}+F_{2(g)} \rightarrow KrF_{2(g)}\]
It has also been discovered that Krypton can bond with other atoms besides Fluorine, however such compounds are much more unstable than krypton difluoride. For example, KrF2 can bond with nitrogen when it reacts with [HC≡NH]+[AsF−6] under -50°C to form [HC≡N–Kr–F]+. There have been other reports of successfully synthesizing additional Krypton compounds, but none have been verified. Krypton has 6 stable isotopes: 78Kr, 80Kr, 82Kr, 83Kr, 84Kr, and 86Kr. There are a total of 31 isotopes of Krypton, and the only isotope besides the six given that occur naturally is 81Kr which is a product of atmospheric reactions between the other natural isotopes.
Applications
Krypton gas is used in various kinds of lights, from small bright flashlight bulbs to special strobe lights for airport runways. Due to Krypton's large number of spectral lines, it's ionized gas is white, which is why light bulbs that are krypton based are used in photography and studio lighting in the film industry. In neon lights, Krypton reacts with other gases to produce a bright yellow light as well. The isotope 85Kr can also be used in combination with phosphors to produce materials that shine in the dark due to the fact that this particular isotope of Krypton reflects off of phosphors. Krypton is also used in lasers as a control for a desired wavelength, especially in red lasers because Krypton has a much higher light density in the red spectral region than other gases such as Neon, which is why krypton-based lasers are used to produce red light in laser-light shows.
Perhaps one of the most significant uses of Krypton is in the krypton-fluoride laser which is used in nuclear fusion energy research.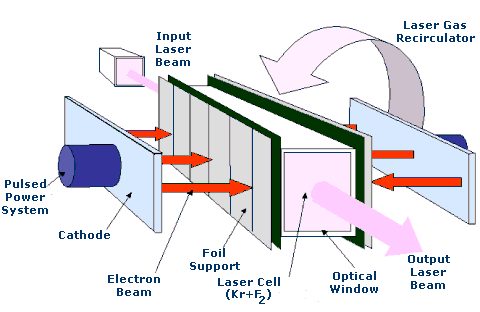
Isótopos de Criptón
Otra aplicación importante del Krypton, específicamente 83 Kr, es en la Imagen por Resonancia Magnética (MRI), que se usa en lugar de otros gases debido a su alto espín y su nube de electrones más pequeña/menos polar en comparación con otros gases nobles como el Xenon. Se utiliza para distinguir regiones hidrofóbicas e hidrofílicas que contienen una vía aérea.
En 1960 se realizó un acuerdo internacional para basar la longitud del medidor en la longitud de onda de la luz emitida por 86 Kr (605.78 nm). Sin embargo, esto se cambió en 1983 cuando la Oficina Internacional de Pesos y Medidas determinó que el medidor era la distancia que recorre la luz en vacío en 1/299,792,458 s.Problemas
- ¿Cómo se aísla el elemento Krypton?
- ¿Por qué el flúor puede reaccionar con Krypton para formar un compuesto?
- ¿Cuál es la configuración electrónica de Krypton?
- ¿Qué colores son más pronunciados en la emisión espectral de Krypton?
- ¿Cuántos isótopos estables de Krypton hay?
Soluciones
- Al evaporar los componentes del aire líquido.
- Porque el flúor es altamente electronegativo y Krypton es fácilmente ionizable.
- [Ar] 3d 10 4s 2 4p 6
- Verde y amarillo
- 6
Referencias
- Newton, David E. Elementos Químicos: Del Carbono al Criptón .2 nd Volumen. Detriot, MI: UXL, 1999. Imprimir.
- Codd, Sarah L. y Joseph D. Seymour. Microscopía de Resonancia Magnética: Técnicas y Aplicaciones de RMN Resuelta Esp Bozeman, MT: Wiley, John & Sons, Incorporated, 2009. Imprimir.
- Sykes, A.G. Avances en Química Inorgánica. 46. San Diego, CA: Prensa Académica, 1999. Imprimir.
Colaboradores y Atribuciones
- Megan Meadows (UCD)

