9.1: Preludio a la Química de Coordinación I - Estructura e Isómeros
- Page ID
- 81566
¿Qué es un complejo de coordinación?
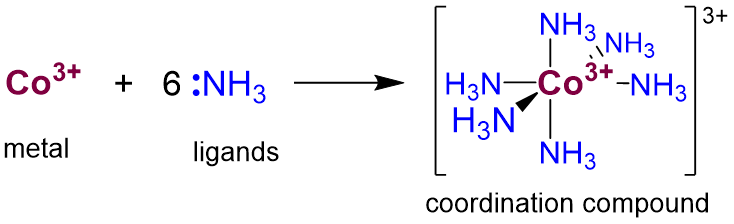
Los compuestos de coordinación consisten en uno o más metales unidos a uno o más ligandos de base de Lewis. Por ejemplo, el ion hexaminerutenio (3+) es un complejo de coordinación en el que seis ligandos de amoníaco coordinan un ion Co 3 +, como se muestra en el Esquema\(\sf{\PageIndex{1}}\).
Dichos complejos se denominan complejos de coordinación porque el enlace ligando-metal puede considerarse como un enlace covalente coordinado en el que ambos electrones de unión provienen del ligando, que luego se dice que coordina el metal. Este modelo covalente coordinado es un formalismo muy útil para comprender las características básicas de la química de coordinación, aunque no siempre refleja con precisión los detalles reales del vínculo en cada complejo de coordinación. Sin embargo, incluso en aquellos casos en los que se descompone el modelo de enlace covalente coordinado simple, el concepto de enlace covalente coordinado suministra el lenguaje que emplean los modelos sofisticados para describir la unión más compleja involucrada.
Términos adicionales importantes
Algunos de los términos comúnmente utilizados que se derivan del modelo covalente coordinado de unión en complejos de coordinación incluyen:
- Los compuestos de coordinación también se denominan complejos de coordinación, complejos metálicos o simplemente complejos. El término complejo se refiere a la naturaleza compuesta de los compuestos de coordinación, en el sentido de que se puede considerar que comprenden múltiples partes de ligando e iones metálicos que pueden restaurarse rompiendo los enlaces covalentes coordinados que mantienen el complejo unido. Esto contrasta con las moléculas inorgánicas u orgánicas que se consideran más comúnmente como moléculas enteras mantenidas unidas por el intercambio de electrones aportados por todos los átomos.
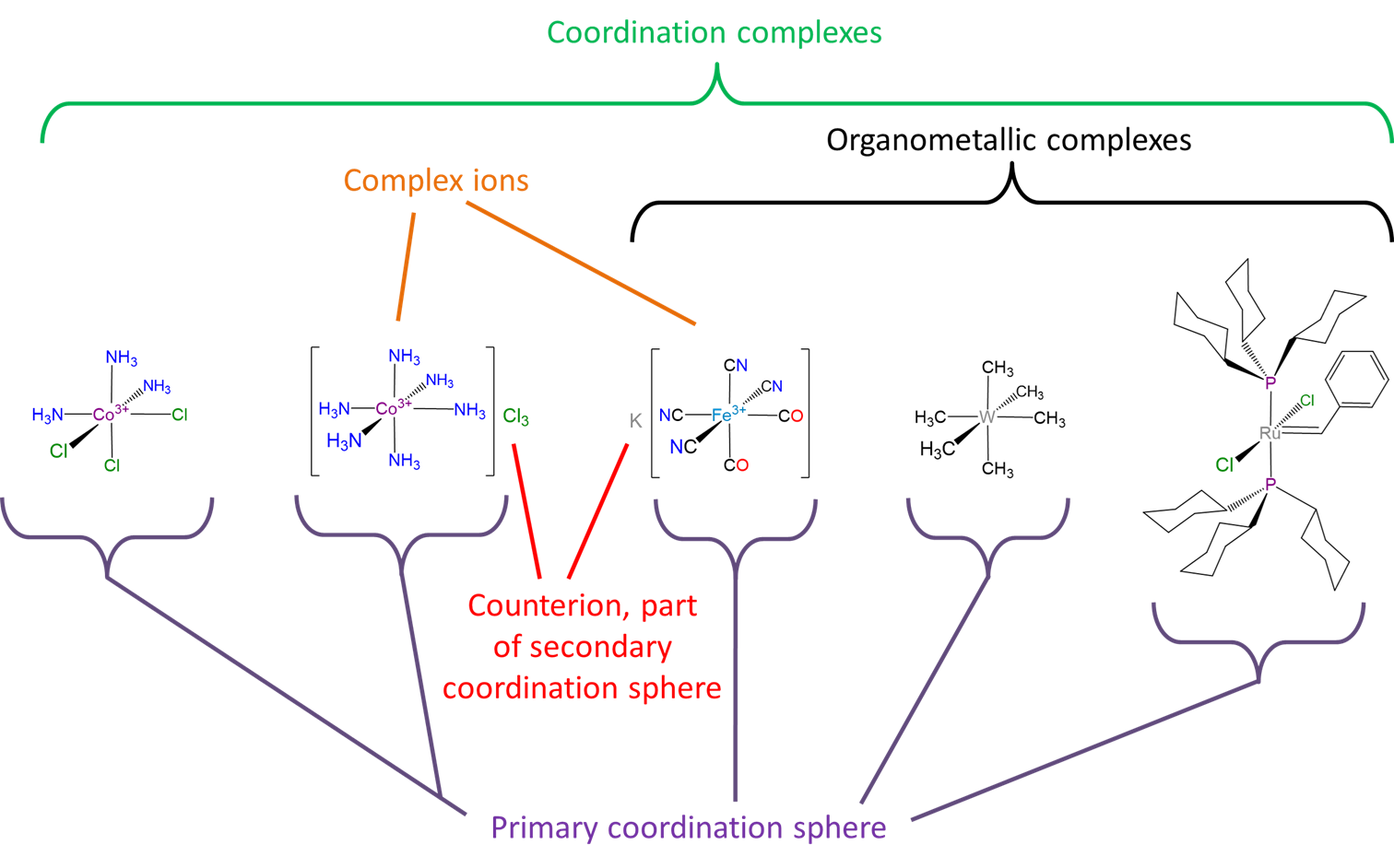
- Los complejos de coordinación que son iones se llaman iones complejos.
- Se dice que los ligandos unidos al complejo de coordinación residen en la esfera de coordinación primaria o interna. Estos ligandos unidos no son fácilmente intercambiables, en contraste con los contrailones cercanos y las moléculas de disolvente, que se dice que residen en la esfera de coordinación secundaria o externa.
- Se dice que la porción del complejo que aporta los pares de electrones es el donador y la porción que los recibe el aceptor. En los compuestos de coordinación convencionales el ligando es el donador y el metal el aceptor. En estos casos sería igualmente conveniente referirse al donante de ligando como la base de Lewis y al aceptor de metal como el ácido de Lewis. Sin embargo, en escenarios de unión más complejos puede haber múltiples pares de electrones de donación y aceptación interacciones que tienen lugar entre cada par de átomos y el lenguaje donador-aceptor será más conveniente.
- El número de sitios de ligandos que donan pares solitarios al átomo central se conoce como el número de coordinación. Para la mayoría de los complejos esto solo será igual al número de átomos de ligando unidos al metal. En complejos simples es igual al número de ligandos. Por ejemplo, el cobalto en Scheme\(\sf{\PageIndex{1}}\) tiene un número de coordinación de seis.
- Aunque técnicamente los compuestos con enlaces metal-carbono son complejos de coordinación, el término complejo de coordinación a veces se usa para referirse a complejos que no poseen enlaces metal-carbono en su esfera de coordinación primaria. Los complejos que poseen enlaces metal-carbono se denominan compuestos organometálicos en su lugar. El uso de los términos organometálico y coordinación para distinguir compuestos organometálicos de otros tipos de compuestos de coordinación suele ser conveniente ya que muchos ligandos organometálicos se involucran en más que la simple formación de enlaces covalentes coordinados\(\sigma\) donador-aceptor con el centro metálico. Sin embargo, esto también es cierto para algunos ligandos totalmente inorgánicos, por lo que siempre se debe tener en cuenta que los compuestos organometálicos son solo un tipo de compuesto de coordinación y que los ligandos inorgánicos pueden, en principio, sintonizarse para interactuar con un centro metálico de la misma manera que lo hace un ligando orgánico.
Un resumen de algunos de los conceptos y términos utilizados para describir los compuestos de coordinación se da en Scheme\(\sf{\PageIndex{2}}\).
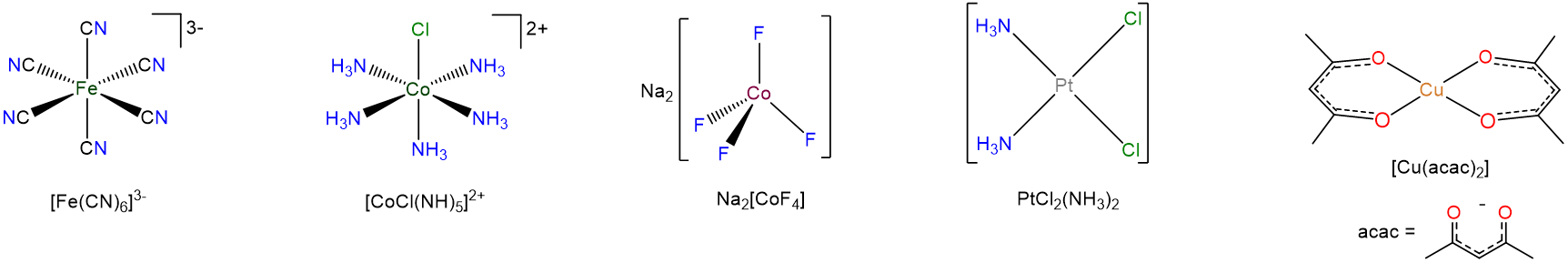
Las fórmulas de los complejos de coordinación
La forma en que se escriben las fórmulas de los complejos de coordinación refleja el hecho de que a menudo es conveniente pensar en los compuestos de coordinación como un compuesto de metales y ligandos. Al escribir la fórmula de un complejo
- los átomos de un ligando no se añaden a los del resto del compuesto. En cambio, los átomos del ligando se mantienen juntos, si es necesario encerrando la fórmula del ligando entre paréntesis o dando una abreviatura para el ligando.
- Para los iones complejos, el metal y los ligandos están encerrados entre corchetes. A veces esto también se hace para compuestos neutros de coordinación también. En cualquier caso los corchetes encierran aquellas partes del recinto que comprenden la esfera de coordinación primaria; cualquier otra cosa está en la esfera secundaria de coordinación exterior.
Una cuidadosa lectura de los ejemplos en Scheme\(\sf{\PageIndex{3}}\) debería dejar claras las características importantes de este sistema.