9.2: Historia
- Page ID
- 81542
Historia de los Compuestos de Coordinación
Los compuestos de coordinación se conocen y utilizan desde la antigüedad; uno de los pigmentos sintéticos más antiguos es el pigmento azul azul egipcio, un complejo de cobre de fórmula CaCuSi 4 O 10 utilizado por los egipcios desde el tercer Millenium B.C. (en la antigua China el análogo de Ba, Han blue, era descubierto de forma independiente). El color azul del azul egipcio se debe al entrelazado de Cu (Si 2 O 7) 4 unidades en las que cada cobre está coordinado por cuatro átomos de O en una disposición plana cuadrada. Posteriormente, en 1706, el pintor berlinés Diesbach descubriría otro pigmento azul profundo, el azul prusiano:\(\ce{KFe2(CN)6}\).
A pesar de su uso prolongado, la naturaleza química de los compuestos de coordinación no estaba clara por varias razones. Por ejemplo, se conocían muchos compuestos llamados “sales dobles”, tales como\(\ce{AlF3·3KF}\),\(\ce{Fe(CN)2·4KCN}\), y\(\ce{ZnCl2·2CsCl}\), que eran combinaciones de sales simples en proporciones fijas y aparentemente arbitrarias. ¿Por qué debería\(\ce{AlF3·3KF}\) existir pero no\(\ce{AlF3·4KF}\) o\(\ce{AlF3·2KF}\)? Y ¿por qué una\(\ce{AlF3}\) mezcla 3:1 KF: debe tener diferentes propiedades químicas y físicas que cualquiera de sus componentes? De igual manera, también se conocían aductos de sales metálicas con moléculas neutras como el amoníaco, por ejemplo\(\ce{CoCl3·6NH3}\), que se preparó por primera vez antes de 1798. Al igual que las sales dobles, las composiciones de estos aductos exhibieron proporciones fijas y aparentemente arbitrarias de los componentes. Por ejemplo,\(\ce{CoCl3·6NH3}\),\(\ce{CoCl3·5NH3}\),\(\ce{CoCl3·4NH3}\), y todos\(\ce{CoCl3·3NH3}\) eran conocidos y tenían propiedades muy diferentes, pero a pesar de todos los intentos, los químicos no podían preparar\(\ce{CoCl3·2NH3}\) o\(\ce{CoCl3·NH3}\).
Aunque la composición química de dichos compuestos se estableció fácilmente por los métodos analíticos existentes, su naturaleza química fue desconcertante y altamente controvertida. El principal problema era que se pensaba que lo que ahora llamamos valencia (es decir, el estado de oxidación) y el número de coordinación eran idénticos. Como resultado, se propusieron estructuras altamente inverosímiles (al menos a los ojos modernos) para tales compuestos. De estos, el más influyente fue la teoría de la cadena Blomstrand-Jørgensen de unión en compuestos de coordinación, que predijo el modelo “Chattanooga choo-choo” para CoCl 3 ·4NH 3 mostrado en el Esquema\(\sf{\PageIndex{I}}\).
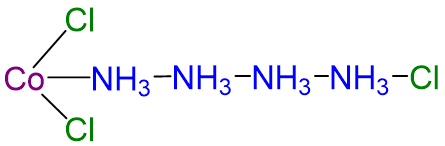
Sin embargo, esta teoría no era del todo ilógica y, de hecho, explicaba gran parte de los datos analíticos sobre compuestos de coordinación disponibles para los químicos de la época. Estos datos incluyeron la conductividad eléctrica de las soluciones acuosas de estos compuestos, la cual fue aproximadamente proporcional al número de iones formados por mol, y el número de iones cloruro libres presentes, que se pudo determinar precipitándolos gravimétricamente como AgCl. En el caso del CoCl 3·4NH 3, se produjeron dos iones y un cloruro cuando el compuesto se disolvió en agua, lo que Jørgensen pudo explicar usando la estructura de cadena mostrada anteriormente al postular que los cloruros unidos a NH 3 podrían disociarse mientras que los unidos a Co no pudo. La teoría moderna de la química de coordinación, que derrocó a la teoría de las cadenas, se basa en gran parte en la obra de Alfred Werner (1866—1919; Premio Nobel de Química en 1913). En una serie de cuidadosos experimentos realizados a fines de la década de 1880 y principios de la década de 1890, examinó las propiedades de varias series de complejos de halogenuros metálicos con amoníaco. Por ejemplo, en ese momento se conocían cinco “aductos” diferentes de amoníaco con PtCl 4: PtCl 4 ·NnH3 (n = 2—6). Algunos de los datos originales de Werner sobre estos compuestos se muestran en la Tabla\(\PageIndex{1}\). Los datos de Werner sobre PTCL 4·6NH 3 en la Tabla\(\PageIndex{1}\) mostraron que todos los iones cloruro estaban presentes como cloruro libre. En contraste, PtcL 4·2NH 3, fue una molécula neutra que no dio iones cloruro libres al disolverse en agua.
Werner, hijo de un obrero de fábrica, nació en Alsacia. Desarrolló un interés por la química a una edad temprana, e hizo sus primeros experimentos de investigación independientes a los 18 años. Mientras hacía su servicio militar en el sur de Alemania, asistió a una serie de conferencias de química, y posteriormente recibió su doctorado en la Universidad de Zúrich en Suiza, donde fue nombrado profesor de química a los 29 años. Ganó el Premio Nobel de Química en 1913 por su trabajo en compuestos de coordinación, que realizó como estudiante de posgrado y presentó por primera vez a los 26 años. Al parecer, Werner estaba tan obsesionado con resolver el enigma de la estructura de los compuestos de coordinación que su cerebro siguió trabajando en el problema incluso mientras estaba dormido. En 1891, cuando apenas tenía 25 años, se despertó a mitad de la noche y, en apenas unas horas, había sentado las bases para la química de coordinación moderna.
| Complejo | Conductividad (ohmios −1) | Número de iones por unidad de fórmula | Número de Cl − Iones Precipitados por Ag + |
|---|---|---|---|
| PtcL 4 ·6NH 3 | 523 | 5 | 4 |
| PtcL 4 ·5NH 3 | 404 | 4 | 3 |
| PtcL 4 ·4NH 3 | 299 | 3 | 2 |
| PtCl 4 ·3NH 3 | 97 | 2 | 1 |
| PtcL 4 ·2NH 3 | 0 | 0 | 0 |
Estos datos llevaron a Werner a postular que los iones metálicos tienen dos tipos diferentes de valencia: (1) una valencia primaria (estado de oxidación) que corresponde a la carga positiva sobre el ión metálico y (2) una valencia secundaria (número de coordinación) que es el número total de ligandos unidos al ión metálico. Si Pt tuviera una valencia primaria de 4 y una valencia secundaria de 6, Werner podría explicar las propiedades de los aductos PtCl 4·NH 3 mediante las siguientes reacciones, donde el complejo metálico está encerrado entre corchetes:
\ [\ begin {align}\ mathrm {[Pt (NH_3) _6] Cl_4} &\ fila derecha\ mathrm {[Pt (NH_3) _6] ^ {4+} (aq) +4Cl^- (aq)}\\ [4pt]
\ mathrm {[Pt (NH_3) _5Cl] Cl_3} &\ fila derecha\ mathrm {[Pt (NH_3) _5Cl] ^ {3+} (aq) +3Cl^- (aq)}\\ [4pt]
\ mathrm {[Pt (NH_3) _4Cl_2] Cl_2} &\ fila derecha\ mathrm {[Pt (NH_3) _4Cl_2] ^ {2+} (aq) +2Cl^- (aq)}\\ [4pt]
\ mathrm {[Pt (NH_3) _3Cl_3] Cl} &\ fila derecha\ mathrm {[Pt (NH_3) _3Cl_3] ^+ (aq) + Cl^- (aq)}\\ [4pt]
\ mathrm {[Pt (NH_3) _2Cl_4]} &\ fila derecha\ mathrm {[Pt (NH_3) _2Cl_4] ^0 (aq)}\ end {align}\ nonumber\]
Otros trabajos mostraron que los dos miembros faltantes de la serie, [Pt (NH 3) Cl 5] − y [PtCl 6] 2−, podrían prepararse como sus sales mono y dipotásicas, respectivamente. Estudios similares establecieron números de coordinación de 6 para Co 3 + y Cr 3 + y 4 para Pt 2 + y Pd 2 +.
La serie CoCl 3 ·xNH 3 fue particularmente importante para establecer la corrección de la teoría de la coordinación de Werner sobre la teoría de la cadena rival. Por ~1900 las mediciones de conductividad sugirieron que los miembros de la serie dieron el número de iones mostrados en la Tabla\(\sf{\PageIndex{1}}\).
| Compuesto | Color | Formulación Werner | Formulación de la teoría de la cadena de Blomstrand-Jørgensen | Número de iones en solución |
|---|---|---|---|---|
| CoCl 3 ·6NH 3 | amarillo | [Co (NH 3) 6] Cl 3 |  |
4 |
| CoCl 3 ·5NH 3 | violeta | [Co (NH 3) 5 Cl] Cl 2 |  |
3 |
| CoCl 3 ·4NH 3 | verde | [Co (NH 3) 4 Cl 2] Cl | 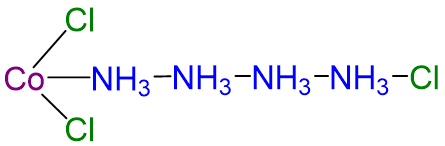 |
2 |
| CoCl 3 ·3NH 3 | naranja | [Co (NH 3) 4 Cl 3] | 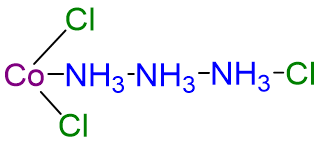 |
0 |
¿Qué sugieren estos datos sobre el poder explicativo relativo de la teoría de la coordinación de Werner y la teoría de cadenas? Explique.
- Contestar
-
Recuerda que
- la teoría de la cadena predice que el número de iones es el número formado cuando los átomos de Cl unidos en una cadena con NH 3 se disocian.
- la teoría de la coordinación predice el número de iones en función del número de iones complejos y sus contraiones.
En base a esto, las predicciones de la teoría de la coordinación y la teoría de cadenas se pueden comparar con los datos experimentales, como se hace en la Tabla\(\sf{\PageIndex{2}}\).
Cuadro\(\sf{\PageIndex{2}}\): C omparison de iones predichos para la serie COCl 3 ·xNH 3 por teoría de coordinación y teoría de cadenas con el número observado experimentalmente. Compuesto Color Iones predichos por la teoría de la coordinación de Werner Número de iones predicho por la teoría de la coordinación Iones predichos por la teoría de la cadena de Blomstrand-Jørgensen N número de iones predichos por la teoría de la cadena Número observado de iones en solución CoCl 3 ·6NH 3 amarillo [Co (NH 3) 6] 3+
Cl -
Cl -
Cl -
4 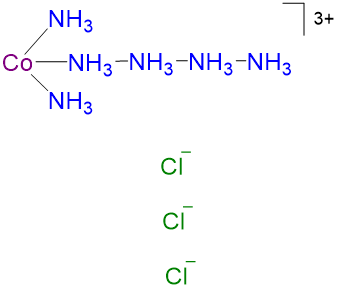
4 4 CoCl 3 ·5NH 3 violeta [Co (NH 3) 5 Cl] 2+
Cl -
Cl -
3 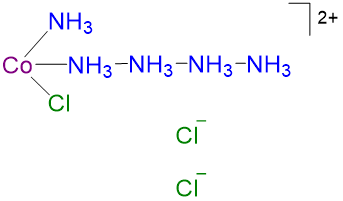
3 3 CoCl 3 ·4NH 3 verde [Co (NH 3) 4 Cl 2] +
Cl -
2 
2 2 CoCl 3 ·3NH 3 naranja Ninguno 0 
2 0 - Como se puede observar comparando el número de iones predichos por coordinación y teoría de cadenas en el Cuadro\(\sf{\PageIndex{2}}\), coordination theory successfully explains all the observed ion counts, while chain theory fails to explain the lack of ions observed for COCl 3·3NH 3.
- Sin embargo, como suele ser el caso al desarrollar modelos teóricos utilizando datos de investigaciones experimentales reales, estas observaciones no convencieron a Jørgensen, quien podría señalar la dificultad experimental de determinar el número de iones presentes a partir de los datos de conductividad de la solución.
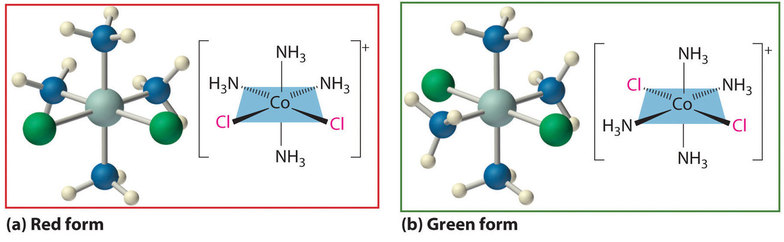
Lo que finalmente convenció a Jørgensen de la corrección del modelo de coordinación de Werner sobre su propia teoría de cadenas fue cómo la explicación de Werner de la estructura de los complejos de coordinación de cobalto utilizando una geometría de coordinación octaédrica explicó la existencia de isómeros en complejos de Co que contienen Cl y NH 3 ligandos. En el caso de [Co (NH 3) 4 Cl 2] Cl se conocían dos isómeros: uno rojo y otro verde. Debido a que ambos compuestos tenían la misma composición química y el mismo número de grupos del mismo tipo unidos al mismo metal, tenía que haber algo diferente en la disposición de los ligandos alrededor del ión metálico. La visión clave de Werner fue que los seis ligandos en [Co (NH 3) 4 Cl 2] Cl tuvieron que estar dispuestos en los vértices de un octaedro porque esa era la única estructura consistente con la existencia de dos, y solo dos, estereoisómeros (Figura\(\PageIndex{1}\)). Su conclusión también fue corroborada por la existencia de dos y sólo dos estereoisómeros del siguiente compuesto de la serie: Co (NH 3) 3 Cl 3.
En la época de Werner se conocían muchos complejos de fórmula general MA 4 B 2, pero no se habían preparado más de dos compuestos diferentes con la misma composición para ningún metal. Para confirmar el razonamiento de Werner de que esto sugiere que estos complejos poseen una geometría octaédrica, calcule el número máximo de diferentes estructuras posibles para complejos MA 4 B 2 de seis coordenadas con cada una de las tres estructuras más simétricas posibles que los ligandos formarán sobre el metal central: un hexágono, un prisma trigonal y un octaedro.
Suponiendo que la ausencia de evidencia de compuestos adicionales en este caso sirve como evidencia circunstancial razonable para su ausencia, ¿qué sugiere el hecho de que no se conocieran más de dos formas de cualquier complejo MA 4 B 2 sobre las estructuras tridimensionales de estos complejos?
Solución
En este problema se le da
- la estequiometría de los complejos, MA 4 B 2
- tres posibles geometrías de coordinación: hexagonal, prismática trigonal y octaédrica.
Para calcular el número de isómeros que podrían estar presentes para cada geometría lo mejor es seguir un enfoque sistemático. Dado que hay menos ligandos de tipo B que ligandos de tipo A, la forma más fácil de hacer esto para cada geometría es comenzar colocando un ligando B en un vértice y luego determinar cuántas posiciones diferentes están disponibles para el segundo ligando B.
Aquí se muestran las tres estructuras regulares de seis coordenadas, con cada posición de coordinación numerada para que podamos realizar un seguimiento de los diferentes arreglos de ligandos. Para cada estructura, todos los vértices son equivalentes. Comenzamos con un complejo MA 6 simétrico y simplemente reemplazamos dos de los ligandos A en cada estructura para dar un complejo MA 4 B 2:
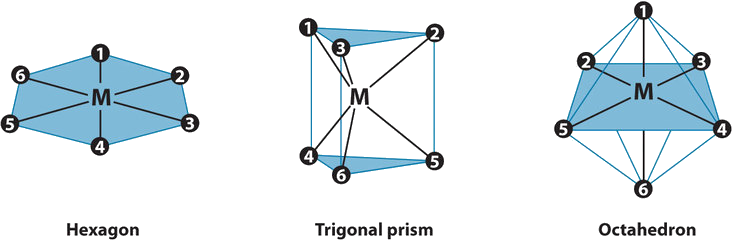
Para el hexágono, colocamos el primer ligando B en la posición 1. Ahora hay tres posibles lugares para el segundo ligando B:
- posición 2 (o 6)
- posición 3 (o 5)
- posición 4
Las disposiciones (1, 2) y (1, 6) son químicamente idénticas porque los dos ligandos B son adyacentes entre sí. Las disposiciones (1, 3) y (1, 5) también son idénticas porque en ambos casos los dos ligandos B están separados por un ligando A. Aquellos de ustedes que recuerden su química ogránica podrían reconocer que esta situación es formalmente análoga al orto -, meta -, y para - isomería en bencenos disustituidos.
Volviendo al prisma trigonal, colocamos el primer ligando B en la posición 1. Nuevamente, hay tres opciones posibles para el segundo ligando B:
- en la posición 2 o 3 en la misma cara triangular
- posición 4 (en la otra cara triangular pero adyacente a 1)
- posición 5 o 6 (en la otra cara triangular pero no adyacente a 1).
Los arreglos (1, 2) y (1, 3) son químicamente idénticos, al igual que los arreglos (1, 5) y (1, 6).
En el octaedro, sin embargo, si colocamos el primer ligando B en la posición 1, entonces solo tenemos dos opciones para el segundo ligando B:
- posición 2 (o 3 o 4 o 5)
- posición 6.
En este último, los dos ligandos B se encuentran en vértices opuestos del octaedro, estando el metal directamente entre ellos. Aunque existen cuatro arreglos posibles para los primeros, son químicamente idénticos porque en todos los casos los dos ligandos B son adyacentes entre sí.
El número de posibles arreglos MA 4 B 2 para las tres geometrías es así: hexágono, 3; prisma trigonal, 3; y octaedro, 2. El hecho de que solo se conocieran dos formas diferentes para todos los complejos MA 4 B 2 que se habían preparado sugiere que la estructura correcta era el octaedro pero no lo probó. Por alguna razón uno de los tres arreglos posibles para las otras dos estructuras podría haber sido menos estable o más difícil de preparar y simplemente aún no se había sintetizado. Sin embargo, cuando se combinaron con resultados análogos para otros tipos de complejos (p. ej., MA 3 B 3), los datos se explicaron mejor por una estructura octaédrica para complejos metálicos de seis coordenadas.
Determinar el número máximo de estructuras que son posibles para un complejo MA 2 B 2 de cuatro coordenadas con una estructura plana cuadrada o simétrica tetraédrica.
- Contestar
-
plano cuadrado, 2; tetraédrico, 1
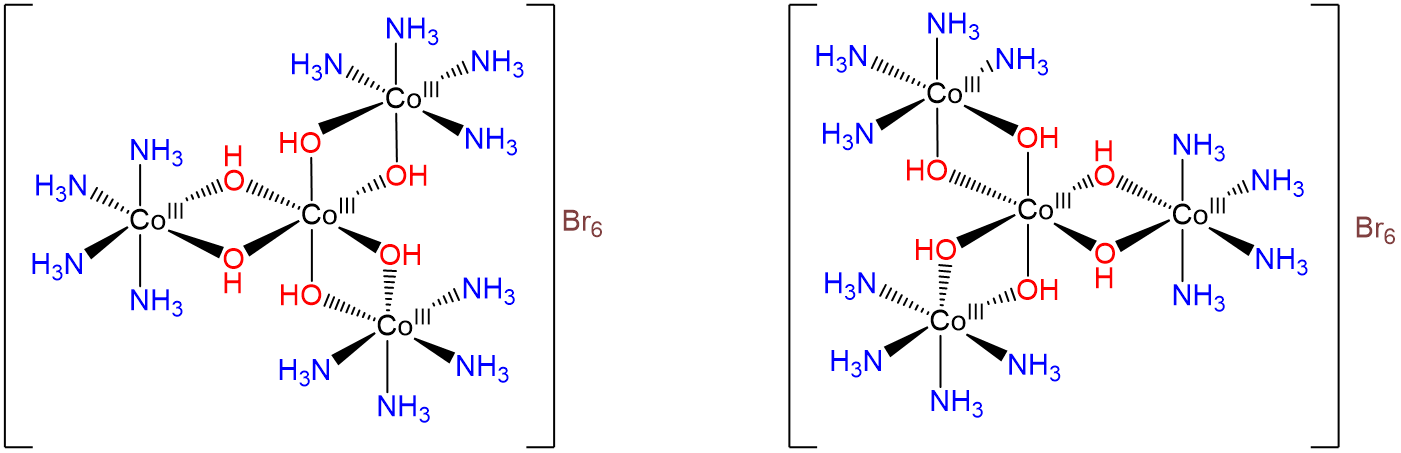
Incluso la explicación de Werner sobre el isomería en los complejos de coordinación en términos de geometrías octaédricas y otras reconocidas de coordinación no convenció a todos los químicos hasta que pudo resolver una mezcla racémica de d - y l - [Co {Co (NH3) 4 (OH) 2} 3] en sus enantiómeros, los cuales se muestran en el Esquema\(\sf{\PageIndex{II}}\). Al hacerlo Werner demostró a los químicos de su tiempo (prácticamente ninguno de los cuales conocía la teoría de grupos) que los átomos de carbono tetraédricos no eran necesarios para la quiralidad; los complejos octaédricos D 3 también eran quirales.