9.P: Problemas
- Page ID
- 81541
19.1: Ocurrencia, preparación y propiedades de los metales de transición y sus compuestos
Q19.1.1
Escriba las configuraciones de electrones para cada uno de los siguientes elementos:
- Sc
- Ti
- Cr
- Fe
- Ru
S19.1.1
La configuración electrónica de un átomo es la representación de la disposición de los electrones distribuidos entre las conchas orbitales y subconchas. La configuración electrónica de cada elemento es única a su posición en la tabla periódica donde el nivel de energía está determinado por el período y el número de electrones viene dado por el número atómico del elemento. Hay cuatro tipos diferentes de orbitales (s, p, d y f) que tienen diferentes formas y cada orbital puede contener un máximo de 2 electrones, pero los orbitales p, d y f tienen diferentes subniveles, lo que significa que son capaces de contener más electrones.
La tabla periódica se divide en grupos que podemos usar para determinar orbitales y así, escribir configuraciones de electrones:
Grupo 1 y 2: Orbital S
Grupo 13 - 18: P orbital
Grupo 3 - 12: D orbital
Lantánidos y actínidos: F orbital
Cada orbital (s, p, d, f) tiene un número máximo de electrones que puede contener. Una manera fácil de recordar el máximo de electrones de cada uno es mirar la tabla periódica y contar el número de periodos en cada colección de grupos.
Grupos 1 y 2:2 (2 electrones totales = 1 orbital x máx de 2 electrones = 2 electrones)
Grupo 13 - 18:6 (6 electrones totales = 3 orbitales x 2 electrones max = 6 electrones)
Grupo 3 - 12:10 (10 electrones totales = 5 orbitales x 2 electrones max = 10 electrones)
Lantánidos y actínidos: 14 (14 electrones totales = 7 orbitales x 2 electrones max = 14 electrones)
Electron llena los orbitales en un patrón específico que afecta el orden en el que se escriben las versiones de mano larga:
Patrón de relleno de electrones: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f
Una forma más fácil y rápida de escribir configuraciones de electrones es usar configuraciones de gas noble como atajos. Podemos hacer esto porque las configuraciones electrónicas de los gases nobles siempre han llenado todos los orbitales.
Él: 1s 2 2s 2
Ne: 1s 2 2s 2 2p 6
Ar: 1s 2 2s 2 2p 6 3s 2 3p 6
Kr: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6
Xe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6
Rn: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6
La configuración de gas noble más común utilizada es Ar. Cuando desee utilizar el atajo de configuración de gas noble, coloque el símbolo del gas noble dentro de los soportes:
[Ar]
y luego escribirlo precediendo al resto de la configuración, que es únicamente los orbitales el proceder después del del gas noble.
a. sc
Comencemos identificando dónde se sienta Scandium en la tabla periódica: fila 4, grupo 3. Esta identificación es la base crítica que necesitamos para escribir su configuración electrónica.
Al observar el número atómico de Scandium, 21, nos da tanto el número de protones como el número de electrones. Al final de escribir su configuración electrónica, los electrones deben sumar 21.
En la fila 4, el grupo 3 Sc, es un metal de transición; lo que significa que su configuración electrónica incluirá el orbital D.
Ahora, podemos comenzar a asignar los 21 electrones de Sc a los orbitales. A medida que asigna electrones a sus orbitales, se mueve directamente a través de la tabla periódica.
Sus primeros 2 electrones están en el orbital 1s que se denota como
1s 2
donde el “1" que precede a la s denota el hecho de que es de la fila uno, y tiene un exponente de 2 porque cumple con el número máximo de electrones del orbital s. Ahora tenemos 21-2=19 electrones más para asignar.
Sus siguientes 2 electrones están en el orbital 2s que se denota como
2s 2
donde el “2" que precede a la s indica que es de la fila dos, y tiene un exponente de 2 porque cumple con el número máximo de electrones del orbital s. Ahora tenemos 19-2=17 electrones más para asignar.
Sus siguientes 6 electrones están en el orbital 2p que se denota como
2p 6
donde el “2" que precede a la p indica que es de la fila dos, y tiene un exponente de 6 porque cumple con el número máximo de electrones del orbital p. Ahora tenemos 17-6=11 electrones más para asignar.
Sus siguientes 2 electrones están en el orbital 3s que se denota como
3s 2
donde el “3" que precede a la s indica que es de la fila tres, y tiene un exponente de 2 porque cumple con el número máximo de electrones del orbital s. Ahora tenemos 11-2=9 electrones más para asignar.
Sus siguientes 6 electrones están en el orbital 3p que se denota como
3p 6
donde el “3" que precede a la p indica que es de la fila tres, y tiene un exponente de 6 porque cumple con el número máximo de electrones del orbital p. Ahora tenemos 9-6=3 electrones más para asignar.
Sus siguientes 2 electrones están en el orbital 4s que se denota como
4s 2
donde el “4" que precede a la s indica que es de la fila cuatro, y tiene un exponente de 2 porque cumple con el número máximo de electrones del orbital s. Ahora tenemos 3-2=1 más electrón para asignar.
Su último electrón estaría solo en el orbital de 3 d que se denota como
3d 1
donde el “3" que precede a la d indica que, aunque técnicamente es de fila 4, al desatender la primera fila de H y He, esta es la tercera fila y tiene un exponente de 1 porque solo hay 1 electrón para ser colocado en el orbital d. Ahora hemos asignado todos los electrones a los orbitales y suborbitales apropiados, de manera que la configuración final, completa del electrón se escribe como:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1
Esta es la versión de mano larga de su configuración electrónica.
Entonces, para Sc, su versión de mano corta de su configuración electrónica sería, por lo tanto:
[Ar] 4s 2 3d 1
b. Ti
Comience identificando dónde se asienta el Titanio en la tabla periódica: fila 4, grupo 4, lo que significa que tiene 22 electrones en total. El titanio es un elemento a la derecha del Sc del problema anterior, por lo que básicamente usaremos el mismo método excepto que, al final, quedarán 2 electrones restantes, por lo que el orbital final se denotará como:
3d 2
Si es necesario, mire arriba los pasos exactos sobre cómo hacerlo en detalle nuevamente; la configuración de electrones de mano larga para Titanium será:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
Entonces, para Ti, su versión de mano corta de su configuración electrónica sería, por lo tanto:
[Ar] 4s 2 3d 2
c. Cr
Comience identificando dónde se sienta el Cromo en la tabla periódica: fila 4, grupo 6, eso significa que tiene un total de 24 electrones. Pero primero, Cr, junto con Mo, Nb, Ru, Rh, Pd, Cu, Sg, Pt y Au, es un caso especial. Se pensaría que como tiene 24 electrones que su configuración se vería así:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4
que es como lo aprendimos antes. Sin embargo, esta configuración electrónica es muy inestable debido a que hay 4 electrones en su orbital de 3 d. Las configuraciones más estables son los orbitales medio llenos (d 5) y completos (d 10), por lo que los elementos con electrones que resultan en terminar con el d 4 o d 9 son tan inestables que escribimos su forma estable en su lugar, donde un electrón del orbital s anterior será se movió para llenar el orbital d, resultando en un orbital estable.
Si es necesario, mire arriba los pasos exactos sobre cómo hacer el inicio de la configuración en detalle nuevamente. Sin embargo tenemos que apaciguar la nueva regla para lograr la estabilidad de manera que la configuración electrónica de mano larga para Chromium sea:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Entonces, para Cr, su versión de mano corta de su configuración electrónica sería, por lo tanto:
[Ar] 4s 1 3d 5
d. Fe
Comience identificando dónde se sienta Hierro en la tabla periódica: fila 4, grupo 8, es decir, tiene 26 electrones en total. Se trata de 5 elementos a la derecha del Sc del problema anterior, por lo que básicamente usaremos el mismo método excepto que, al final, quedarán 6 electrones restantes, por lo que el orbital final se denotará como:
3d 6
Si es necesario, mire arriba a los pasos exactos de cómo hacerlo en detalle nuevamente; la configuración de electrones de mano larga para Iron será:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Entonces, para Fe, su versión de mano corta de su configuración electrónica sería, por lo tanto:
[Ar] 4s 2 3d 6
e. Ru
Comience identificando dónde se sienta Rutenio en la tabla periódica: fila 5, grupo 8, eso significa que tiene un total de 44 electrones. Pero primero, como se dijo anteriormente, Ru, junto con Cr, Mo, Nb, Rh, Pd, Cu, Sg, Pt y Au, es un caso especial. Se pensaría que como tiene 44 electrones que su configuración se vería así:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 6
que es como lo aprendimos antes. Sin embargo, esta configuración electrónica es muy inestable debido a que, a pesar de que hay 4 electrones emparejados, también hay 4 electrones desapareados. Esto da como resultado una configuración muy inestable, por lo que para restaurar la estabilidad, tenemos que usar una configuración que tenga los electrones más emparejados, que sería tomar un electrón del orbital s y colocarlo en el orbital d para crear:
5s 1 4d 7
Si es necesario, mire arriba los pasos exactos sobre cómo hacer el inicio de la configuración en detalle nuevamente. Sin embargo tenemos que apaciguar la nueva regla para lograr la estabilidad de manera que la configuración electrónica de mano larga para Ru sea:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1 4d 7
Entonces, para Cr, su versión de mano corta de su configuración electrónica sería, por lo tanto:
[Kr] 5S 1 4d 7
A19.1.1
- Sc: [Ar] 4 s 2 3 d 1
- Ti: [Ar] 4 s 2 3 d 2
- Cr: [Ar] 4 s 1 3 d 5
- Fe: [Ar] 4 s 2 3 d 6
- Ru: [Kr] 5 s 1 4 d 7 (configuración anómala)
Q19.1.2
Escribe las configuraciones de electrones para cada uno de los siguientes elementos y sus iones:
- Ti
- Ti 2+
- Ti 3+
- Ti 4+
S19.1.2
Los electrones se distribuyen en orbitales moleculares, los\(s, p, d, and f\) bloques. Un orbital tendrá un número delante de él y una letra que corresponda al bloque. El bloque s contiene dos electrones, el bloque p tiene seis, el bloque d tiene diez y el bloque f tiene catorce. Entonces, con base en el número de electrones que tiene un átomo, los orbitales moleculares se llenan de cierta manera. El orden de los orbitales es\(1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p\). Se pondrá un exponente después de la letra para cada orbital para indicar cuántos electrones hay en ese orbital. La notación de gas noble también se puede utilizar poniendo el gas noble antes del elemento para el que está escribiendo la configuración, y luego proceder escribiendo los orbitales llenos después del gas noble. Los iones metálicos del bloque d tendrán los dos electrones eliminados del bloque s antes de que se eliminen los electrones del bloque d en curso.
Soluciones:
1. \(Ti\)
El titanio tiene un número atómico de 22, lo que significa que tiene 22 electrones. El gas noble previo al Titanio es Argón. Al mirar la fila 4 de la tabla periódica, el Titanio aún tiene 4 electrones para ser colocados en orbitales ya que el Argón tiene 18 electrones que ya están colocados. Los electrones restantes llenarán el\(4s\) orbital y los dos electrones restantes entrarán en el\(3d\) orbital. [Ar] 4s 2 3d 2
2. \(Ti^{+2}\)
Este es un ion con una carga más 2, lo que significa que se han eliminado 2 electrones. Los electrones se eliminarán del\(4s\) orbital y los 2 electrones restantes se colocarán en el\(3d\) orbital. Al igual que el número 1, el gas noble anterior es Argón. [Ar] 3d 2
3. \(Ti^{+3}\)
Este es un ion con una carga más 3, lo que significa que se han eliminado 3 electrones. Los 2 primeros electrones se eliminarán del\(4s\) orbital, y el tercero se tomará del\(3d\) orbital, y el 1 electrón restante se colocará en el orbital 3d. Al igual que el número 1, el gas noble anterior es Argón. [Ar] 3d 1
4. \(Ti^{+4}\)
Este es un ion con una carga más 4, lo que significa que se han eliminado 4 electrones. Los 2 primeros electrones serán removidos del\(4s\) orbital y los segundos 2 serán removidos del\(3d\) orbital. Esto da como resultado que el ion tenga la misma configuración electrónica que el Argón. [Ar]
Respuestas:
- \([Ar]4s^23d^2\)
- \([Ar]3d^2\)
- \([Ar]3d^1\)
- \([Ar]\)
A19.1.2
- \([Ar]4s^2 3d^2\)
- \([Ar]3d^2\)
- \([Ar]3d^1\)
- \([Ar]\)
Q19.1.3
Escribe las configuraciones de electrones para cada uno de los siguientes elementos y sus iones 3+:
- La
- Sm
- Lu
S19.1.3
Para escribir la configuración electrónica, comenzamos por encontrar el elemento en la tabla periódica. Dado que La, Sm y Lu están todos un período por debajo del gas noble Xenon, podemos abreviar\({1s^2}{2s^2}{2p^6}{3s^2}{3p^6}{3d^{10}}{4s^2}{4p^6}{4d^{10}}{5s^2}{5p^6}\) como [Xe] al escribir las configuraciones orbitales. Luego encontramos el resto de las configuraciones orbitales utilizando el Principio de Aufbau. Para otros elementos no sólo los del periodo 6, la notación taquigráfica utilizando gases nobles sería el gas noble en el periodo por encima del elemento dado.
1. La tiene tres electrones adicionales. Dos de ellos llenan el caparazón 6s y el otro solo electrón se coloca en el caparazón 5d.
\(La:\)[Xe]\({6{s}^2} {5{d}^1}\)
2. Sm tiene ocho electrones más. El orbital 6s se llena como antes y el orbital 4f recibe 6 electrones porque el emparejamiento de electrones requiere menor energía en la carcasa 4f que en la capa 5d.
\(Sm:\)[Xe]\({6{s}^2} {4{f}^6}\)
3. Lu tiene diecisiete electrones más. Dos electrones llenan el orbital 6s, 14 electrones llenan el orbital 4f y el electrón único extra va al orbital 5d.
\(Lu:\)[Xe]\({6s^2}{4f^{14}}{5d^1}\)
Para encontrar la configuración de electrones de iones 3+, eliminamos 3 electrones de la configuración neutra, comenzando con el orbital 6s.
1. La ionización de La 3+ elimina los tres electrones adicionales. Por lo que vuelve a la configuración estable de Xenon.
\({La^{3+}:}\)[Xe]
2. La ionización de Sm 3+ elimina dos electrones de la carcasa 6s y uno de la capa más externa (4f)
\({Sm^{3+}}:\)[Xe]\({4f^5}\)
3. La ionización de Lu 3+ elimina su caparazón de dos 6s y uno del caparazón más externo (5d), dejando solo un caparazón 4f completo
\(Lu^{3+}:\)[Xe]\(4f^{14}\)
A19.1.3
La: [Xe] 6 s 2 5 d 1, La 3+: [Xe]; Sm: [Xe] 6 s 2 4 f 6, Sm 3+: [Xe] 4 f 5; Lu: [Xe] 6 s 2 4 f 14 5 d 1, Lu 3+: [Xe] 4 f 14
Q19.1.4
¿Por qué los elementos lantanoides no se encuentran en la naturaleza en sus formas elementales?
A19.1.4
Los lantánidos rara vez se encuentran en sus formas elementales porque fácilmente dan sus electrones a otros elementos más electronegativos, formando compuestos en lugar de permanecer en una forma elemental pura. Tienen propiedades químicas muy similares entre sí, a menudo se encuentran en lo profundo de la tierra, y son difíciles de extraer. Son los elementos de transición internos y tienen d orbitales parcialmente llenos que pueden donar electrones. Debido a esto, son muy reactivos y electropositivos.
Q19.1.5
¿Cuál de los siguientes elementos es más probable que se utilice para preparar La por la reducción de La 2 O 3: Al, C o Fe? ¿Por qué?
S19.1.5
Una serie de actividades es una lista de elementos en orden decreciente de su reactividad. Los elementos en la parte superior de la lista son buenos agentes reductores porque fácilmente renuncian a un electrón, y los elementos en la parte inferior de la serie son buenos agentes oxidantes porque son altamente electronegativos realmente querrían aceptar un electrón.
Paso 1: Compara Aluminio, Carbono y Hierro en una serie de actividades. Muchas series de actividades incluyen carbono e hidrógeno como referencias. Una serie de actividades se puede encontrar aquí
La serie de actividades va en el orden (de arriba a abajo): Aluminio, Carbono y Hierro.
Paso 2: Identificar qué elemento es el mejor agente reductor.
Los elementos en la parte superior de la lista son los mejores agentes reductores, porque renuncian mejor a los electrones.
El aluminio es el mejor agente reductor de las opciones disponibles.
Por lo tanto, el aluminio será el mejor agente reductor para preparar La mediante la reducción de La 2 O 3 porque es el más reactivo de la serie entre los tres elementos.
A19.1.5
El Al se usa porque es el agente reductor más fuerte y la única opción listada que puede proporcionar suficiente fuerza impulsora para convertir La (III) en La.
Q19.1.6
¿Cuál de los siguientes es el agente oxidante más fuerte:\(\ce{VO4^{3-}}\),\(\ce{CrO4^2-}\), o\(\ce{MnO4-}\)?
S19.1.6
Los agentes oxidantes oxidan otras sustancias. En otras palabras, ganan electrones o se reducen. Estos agentes deben estar en su estado de oxidación más alto. Para determinar, la fuerza de los compuestos anteriores como agentes oxidantes, determinar los números de oxidación de cada elemento constituyente.
\(\\\mathrm{VO_4^{3-}}\)
Sabemos que\(\mathrm{O}\) tiene un estado de oxidación -2 y la carga general del ion es -3. Solo necesitamos determinar el número de oxidación de Vanadato en este compuesto.
\(\\\mathrm{V} + \mathrm{-2(4)} = \mathrm{-3}\)
\(\\\mathrm{V} = \mathrm{+5}\)
El vanadato tiene un número de oxidación de +5, que es su estado de oxidación más alto posible.
\(\\\mathrm{CrO_4^{2-}}\)
Al igual que en el cálculo anterior,\(\mathrm{O}\) tiene un estado de oxidación -2. El cargo general es -2. Así que calcule para el cromo.
\(\\\mathrm{Cr} + \mathrm{-2(4)} = \mathrm{-2}\)
\(\\\mathrm{Cr} = \mathrm{+6}\)
El cromo se encuentra en su estado de oxidación más alto posible de +6 en este compuesto.
\(\\\mathrm{MnO_4^-}\)
\(\mathrm{O}\)tiene un estado de oxidación -2 y la carga total es -1.
\(\\\mathrm{Mn} + \mathrm{-2(4)} = \mathrm{-1}\)
\(\\\mathrm{Mn} = \mathrm{+7}\)
El manganeso también se encuentra en su estado de oxidación más alto, +7.
Un agente oxidante tiene que ser capaz de ganar electrones que, a su vez, reduce su estado de oxidación. Aquí el manganeso tiene el mayor estado de oxidación lo que le permite experimentar una mayor disminución en su estado de oxidación si es necesario, lo que significa que puede ganar la mayor cantidad de electrones. Entonces, entre los tres compuestos,\(\mathrm{MnO_4^-}\) está el agente oxidante más fuerte. Este método supone que los metales tienen electronegatividades similares.
Alternativamente, consultar una tabla redox.
A19.1.6
\(MnO_4^-\)
Q19.1.7
¿Cuál de los siguientes elementos es más probable que forme un óxido con la fórmula MO 3: Zr, Nb o Mo?
S19.1.7
Mo porque Zr tiene un estado de oxidación de +4 y Nb tiene un estado de oxidación de +5 y esos no equilibrarían la carga de 3 oxígenos en el estado de -2 lo que crea una carga de -6. Mo sin embargo tiene múltiples estados de oxidación, siendo el más común +6 que equilibra la carga -6 creada por 3 iones de oxígeno. Es por ello que es más probable que se forme un óxido con la fórmula MO 3 o\(\ce{MoO3}\).
A19.1.7
Mo
Q19.1.8
Todas las siguientes reacciones ocurren en un alto horno. ¿Cuáles de estas son reacciones redox?
- \(\ce{3Fe2O3}(s)+\ce{CO}(g)⟶\ce{2Fe3O4}(s)+\ce{CO2}(g)\)
- \(\ce{Fe3O4}(s)+\ce{CO}(g)⟶\ce{3FeO}(s)+\ce{CO2}(g)\)
- \(\ce{FeO}(s)+\ce{CO}(g)⟶\ce{Fe}(l)+\ce{CO2}(g)\)
- \(\ce{C}(s)+\ce{O2}(g)⟶\ce{CO2}(g)\)
- \(\ce{C}(s)+\ce{CO2}(g)⟶\ce{2CO}(g)\)
- \(\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g)\)
- \(\ce{CaO}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l)\)
S19.1.8
o identificar la reacción redox, tenemos que determinar si hay que ver si la ecuación es una reacción de oxidación-reducción, lo que significa que las especies están cambiando los estados de oxidación durante la reacción, lo que implica la transferencia de electrones entre dos especies. Si una especie está perdiendo electrones, entonces esa especie está siendo oxidada. Si una especie está ganando electrones, entonces esa especie se está reduciendo. Una forma de recordar esto es usando las siglas OIL RIG. O xidación I s L oss, y R educción I s G ain, refiriéndose a los electrones. Ambos deben ocurrir para que una ecuación sea una reacción redox. Veamos si estas ecuaciones son reacciones redox o no:
a. En el lado de los reactivos\(\ce{Fe2O3}\), el Fe es tiene un número de oxidación de +3. En el producto\(\ce{Fe3O4}\), el Fe tiene un número de oxidación de +2.67. Dado que el Fe cambió de +3 a +2.67, podemos decir que el Fe había ganado electrones y, por lo tanto, se había reducido. En el reactivo, el CO, el carbono tiene un número de oxidación de +2, y en el carbono\(\ce{CO2}\) (producto) tiene un número de oxidación de +4. Por lo tanto, el carbono ha perdido electrones y se ha oxidado. Dado que hay oxidación y reducción de especies- podemos concluir que se trata de una reacción redox.
b. en el reactivo\(\ce{Fe3O4}\), el Fe tiene un número de oxidación de +2.67. En el producto, FeO, Fe tiene un número de oxidación de +2. Dado que la oxidación del Fe ha cambiado de +2.67 a +2, se han agregado electrones por lo que el Fe se ha reducido. En el reactivo, el CO, el carbono tiene un número de oxidación de +2, y en el carbono\(\ce{CO2}\) (producto) tiene un número de oxidación de +4. Por lo tanto, el carbono ha perdido electrones y se ha oxidado. Dado que hay oxidación y reducción de especies- podemos concluir que se trata de una reacción redox.
c. En el lado reactivo, en FeO, el Fe tiene un número de oxidación de +2 y en el lado de los productos el Fe tiene un número de oxidación de 0. Dado que el número de oxidación del Fe cambió de +2 a 0, se han ganado electrones y por lo tanto el Fe se ha reducido. En el reactivo, el CO, el carbono tiene un número de oxidación de +2, y en el carbono\(\ce{CO2}\) (producto) tiene un número de oxidación de +4. Por lo tanto, el carbono ha perdido electrones y se ha oxidado. Dado que hay oxidación y reducción de especies- podemos concluir que se trata de una reacción redox.
d. En los reactivos C tiene un número de oxidación de 0, y en el lado de productos en\(\ce{CO2}\), C tiene un número de oxidación de +4. Dado que el número de oxidación de C ha cambiado de 0 a +4, podemos decir que el C se ha oxidado. En los reactivos, en el\(\ce{O2}\) oxígeno tiene un número de oxidación de 0, y en los productos CO2, el oxígeno tiene un número de oxidación de -2. Dado que el número de oxidación del oxígeno ha cambiado de 0 a -2, el oxígeno se ha reducido. Dado que hay oxidación y reducción de especies- podemos concluir que se trata de una reacción redox.
e. En los reactivos\(\ce{CO2 }\) tiene un número de oxidación de +4, y en el lado de productos en CO, C tiene un número de oxidación de +2. Desde que el carbono pasó de +4 a +2, el carbono se ha reducido. En los reactivos, en el\(\ce{CO2 }\) oxígeno tiene un número de oxidación de -4 y en los productos el carbono CO tiene un número de oxidación de -2. Desde que el oxígeno pasó de -4 a -2, se ha oxidado. Dado que hay oxidación y reducción de especies- podemos concluir que se trata de una reacción redox.
f. en los reactivos,\(\ce{CaCO3}\) Ca tiene un número de oxidación de +2, y en los productos CaO Ca tiene un número de oxidación de +2. Dado que el número de oxidación no cambia- podemos concluir que esta ecuación no es una reacción redox.
g. en los productos CaO Ca tiene un número de oxidación de +2, y en los productos\(\ce{CaSiO3}\) Ca tiene un número de oxidación de +2. Dado que el número de oxidación no cambia- podemos concluir que esta ecuación no es una reacción redox.
A19.1.8
a, b, c, d, e
Q19.1.9
¿Por qué es útil la formación de escoria durante la fundición de hierro?
S19.1.9
La escoria es una sustancia formada como subproducto del mineral de hierro o pellets de hierro que se funden juntos en un alto horno. La escoria es también el subproducto que se forma cuando un metal deseado se ha separado de su mineral en bruto. Es importante señalar que la escoria de las acerías se crea de una manera que reduce la pérdida del mineral de hierro deseado. La\(\ce{CaSiO3}\) escoria es menos densa que el hierro fundido, por lo que se puede separar fácilmente. Además, la capa de escoria flotante crea una barrera que evita que el hierro fundido se exponga a\(\ce{O2}\), lo que oxidaría la\(\ce{Fe}\) parte posterior a\(\ce{Fe2O3}\). Dado que el Fe tiene un bajo potencial de reducción de -0.440 esto significa que tiene un alto potencial de oxidación por lo que se oxidaría fácilmente en presencia de O2. Crear una barrera entre el hierro y el oxígeno permite obtener el máximo producto de hierro al final de la fundición.
A19.1.9
La escoria CasIO 3 es menos densa que el hierro fundido, por lo que se puede separar fácilmente. Además, la capa de escoria flotante crea una barrera que evita que el hierro fundido se exponga a O 2, lo que oxidaría el Fe de nuevo a Fe 2 O 3.
Q19.1.10
¿Esperaría que una solución acuosa de óxido de manganeso (VII) tenga un pH mayor o menor que 7.0? Justifica tu respuesta.
S19.1.10
Óxido de manganeso (VII), se puede escribir como Mn 2 O 7.
En relación con la teoría ácido-base de Lewis, un ácido de Lewis acepta electrones de pares solitarios, y también se conoce como el aceptor de pares de electrones. Con base en esta teoría, la acidez se puede medir por la capacidad del elemento para aceptar pares de electrones. Al hacer las matemáticas, encontramos que el Manganeso tiene un estado de oxidación de +7 (el Oxígeno tiene un estado de oxidación de -2, y 2x-7=-14 o esto se puede mostrar como\(-7(2)+2(x)=0\) y\(x=7\) dado que todo el compuesto tiene una carga de cero, para equilibrar la carga del ion, Mn debe ser +7). Por lo tanto, el Mn tiene una alta capacidad de aceptar electrones debido a su alta carga positiva. Para la mayoría de los metales, a medida que aumenta el número de oxidación, también lo hace su acidez, debido a su mayor capacidad para aceptar electrones.
A19.1.10
En relación con la teoría ácido-base de Lewis, el ácido de Lewis acepta electrones de pares solitarios; así, también se le conoce como el aceptor de pares de electrones. Esta puede ser cualquier especie química. Los ácidos son sustancias que deben ser inferiores a 7. Por lo tanto, lo más probable es que los óxidos de manganeso se vuelvan más ácidos en las soluciones (ac) si aumenta el número de oxidación.
Q19.1.11
El hierro (II) se puede oxidar a hierro (III) mediante el ion dicromato, el cual se reduce a cromo (III) en solución ácida. Se disuelve una muestra de 2.5000-g de mineral de hierro y el hierro se convierte en hierro (II). Exactamente 19.17 mL de 0.0100 M Na 2 Cr 2 O 7 se requieren en la titulación. ¿Qué porcentaje de la muestra de mineral fue hierro?
S19.1.11
Para responder a esta pregunta, primero debemos identificar la ecuación neta iónica a partir de las medias reacciones dadas. Podemos escribir las medias reacciones de oxidación y reducción:
\[ \text{ oxidation:} \text{ Fe}^\text{ 2+} \rightarrow \text{ Fe}^\text{ 3+} \]
\[ \text{ reduction: }\ce{Cr2O7^2-} \rightarrow \text{ Cr}^\text{ 3+} \]
Podemos equilibrar rápidamente la media reacción de oxidación agregando el número apropiado de electrones para obtener
\[ \text{ Fe}^\text{ 2+} \rightarrow \text{ Fe}^\text{ 3+}+\text{ e}^- \]
El primer paso para equilibrar la media reacción de reducción es equilibrar elementos en la ecuación distintos de O y H. Al hacerlo, obtenemos
\[\ce{Cr2O7^2-} \rightarrow 2 \text{ Cr}^\text{ 3+} \]
El segundo paso sería agregar suficientes moléculas de agua para equilibrar el oxígeno.
\[ \ce{Cr2O7^2-} \rightarrow 2 \text{ Cr}^\text{ 3+}+ \ce{7H2O} \]
A continuación, agregamos la cantidad correcta de H + para equilibrar los átomos de hidrógeno.
\[ \ce{Cr2O7^2-}+14 \text{ H}^+ \rightarrow 2 \text{ Cr}^\text{ 3+}+ \ce{7H2O} \]
Por último, agregamos suficientes electrones para equilibrar la carga.
\[ \ce{Cr2O7^2-}+14 \text{ H}^++6 \text{ e}^- \rightarrow 2 \text{ Cr}^\text{ 3+}+ \ce{7H2O} \]
Los electrones involucrados en ambas medias reacciones deben ser iguales para que podamos combinar los dos para obtener la ecuación iónica neta. Esto se puede hacer multiplicando cada ecuación por el coeficiente apropiado. Escalando la media reacción de oxidación por 6, obtenemos
\[ 6 \text{ Fe}^\text{ 2+} \rightarrow 6 \text{ Fe}^\text{ 3+}+6 \text{ e}^- \]
Ahora podemos combinar ambas medias reacciones para conseguir
\[ 6 \text{ Fe}^\text{ 2+}+\ce{Cr2O7^2-}+14 \text{ H}^++6 \text{ e}^- \rightarrow 6 \text{ Fe}^\text{ 3+}+6 \text{ e}^-+2 \text{ Cr}^\text{ 3+}+ \ce{7H2O}\]
Los electrones se cancelan, así que obtienes:
\[ 6 \text{ Fe}^\text{ 2+}+\ce{Cr2O7^2-}+14 \text{ H}^+ \rightarrow 6 \text{ Fe}^\text{ 3+}+2 \text{ Cr}^\text{ 3+}+ \ce{7H2O}\]
De esto podemos ver que la relación molar de Cr 2 O 7 2- a Fe 2+ es 1:6. Dado que para la titulación se necesitaron 19.17 mL (o 0.01917 L) de 0.01 M Na 2 Cr 2 O 7, sabemos que
\[ 0.01917\text{ L} \times 0.01 \text{ M} = 1.917 \times 10^{-4} \text{ mol} \]
de Na 2 Cr 2 O 7 reaccionó. Además, dado que cualquier número de moles de Na 2 Cr 2 O 7 produce el mismo número de moles de Cr 2 O 7 2- en solución
\[ 1.917 \times 10^{-4} \text{ mol} \text{ of } \ce{Na2Cr2O7} =1.917 \times 10^{-4} \text{ mol} \text{ of } \ce{Cr2O7^2-}\]
Podemos usar la relación molar de Cr 2 O 7 2- a Fe 2+ para determinar cuántos moles de hierro (ii) había en la solución. El número de moles de hierro (ii) es el mismo que el número de moles de hierro puro en la muestra ya que todo el hierro se convirtió en hierro (ii).
\[ 1.917 \times 10^{-4} \text{ mol} \text{ of } \ce{Cr2O7^2-}\times \frac{6\text{ mol}\text{ of } \text{ Fe}^\text{ 2+}}{1\text{ mol}\text{ of }\ce{Cr2O7^2-}} = 0.0011502\text{ mol}\text{ of } \text{ Fe}^\text{ 2+} \]
\[ 0.0011502\text{ mol}\text{ of } \text{ Fe}^\text{ 2+} = 0.0011502\text{ mol}\text{ of } \text{ Fe} \]
Ahora podemos encontrar el número de gramos de hierro que estuvieron presentes en la muestra de mineral de hierro de 2.5 g.
\[ 0.0011502\text{ mol}\text{ of } \text{ Fe}\times\frac{55.847\text { g}}{1\text{ mol}} = 0.0642352194\text{ g}\text{ of }\text{ Fe} \]
Finalmente, podemos responder a la pregunta y encontrar qué porcentaje de la muestra de mineral fue hierro.
\[ \frac{0.0642352194\text{ g}}{2.5\text{ g}} \times 100 \approx 2.57\text{%} \]
Entonces 2.57% de la muestra de mineral era hierro.
A19.1.11
2.57%
Q19.1.12
¿Cuántos pies cúbicos de aire a una presión de 760 torr y 0 °C se requieren por tonelada de Fe 2 O 3 para convertir ese Fe 2 O 3 en hierro en un alto horno? Para este ejercicio, supongamos que el aire es 19% de oxígeno por volumen.
S19.1.12
Esta pregunta utiliza una serie de conversiones unitarias y la\(PV=nRT\) ecuación.
El primer paso es escribir la ecuación química equilibrada para la conversión de Fe 2 O 3 a hierro puro.
\[2\;Fe_2O_3(s)\rightarrow 4\;Fe(s)+3\;O_2(g)\]
A continuación, necesitamos analizar la pregunta original para determinar el valor que necesitamos resolver. Debido a que la pregunta pide un valor de pies cúbicos, sabemos que necesitamos resolver por volumen. Podemos manipular\(PV=nRT\) para resolver por volumen.
\[V={nRT}/P\]
Ahora determina las variables conocidas y conviértalas en unidades que serán fáciles de manejar.
\[n = 2000\:lbs\; Fe_2O_3\frac{453.592\: grams\: Fe_2O_3}{1\: lb \:Fe_2O_3}\frac{1\: mole \:Fe_2O_3}{159.69\: grams \:Fe_2O_3}\frac{3 \;moles\: O_2}{2\; moles \:Fe_2O_3}\]
\[n=8521\: moles\: of \:O_2\]
Convertir a atm para facilitar los cálculos
\[R=\frac{.0821\:L\:atm}{mol\:K}\]
\[T=0^{\circ}C=273\:K\]
\[P=760 \:torr= 1 \:atm\]
Ahora enchufa los números a la ley de gas manipulado para llegar a una respuesta para V.
\[V=190991.8\: liters \:of\: O_2\]
De aquí convertimos litros a pies cúbicos.
utilizar la conversión
\[1\;L=.0353 ft^3\]
así tenemos 6744.811 ft 3 de O 2
Luego nos referimos de nuevo a la pregunta inicial y recordamos que este valor es solo del 19% del volumen del aire total. Así que usa una ecuación simple para determinar el volumen total de aire en pies cúbicos.
\[6744.811ft^3=.19x\]
x=35499 ft 3 de aire
A19.1.12
35499 ft 3 de aire
Q19.1.13
Encuentre los potenciales de la siguiente celda electroquímica:
Cd | Cd 2+ (M = 0.10)” Ni 2+ (M = 0.50) | Ni
S19.1.13
Paso 1 Escriba sus dos medias reacciones e identifique cuál es la oxidación y cuál es la reducción usando el acrónimo OIL RIG para recordar que la oxidación es pérdida de electrones y la reducción es ganancia de electrones
Cd (s) Cd 2+ (aq) +2e - (oxidación)
Ni 2+ (aq) +2e - Ni (s) (reducción)
Paso 2 Escribe la ecuación balanceada completa
Cd (s) + Ni 2+ (aq) Cd 2+ (aq) +Ni (s)
Paso 3 Encuentra E o celda
E o celda = ánodo E cátodo -E
oxidación: Cd (s) Cd 2+ (aq) +2e - E o =-0.40V
reducción: Ni 2+ (aq) +2e - Ni (s) E o =-0.26V
* Los valores E provienen de la tabla de potenciales de reducción estándar dada anteriormente. Además, recuerde que el ánodo es donde ocurre la oxidación, y el cátodo es donde ocurre la reducción.
E o celda=-0.26- (-.40)
E o celda = 0,14 V
Paso 4 Encuentra Q
Q= [productos]/[reactivos] (mira la ecuación equilibrada completa) (recuerda que [x] significa la concentración de x típicamente dada en molaridad y que ignoramos sólidos o líquidos)
Q= [Cd 2+]/[Ni 2+]
Q=0.10/0.50
Q=0.2
Paso 5 Calcular E usando E= E o celda - (.0592/n) logQ (n es el número de moles de electrones transferidos y en nuestro caso la reacción equilibrada transfiere 2 electrones)
E= 0.14- (.0592/2) log (0.2)
E= 0.14- (-.207)
E=0.16 V
A19.1.13
0.16 V
Q19.1.14
Una muestra de 2.5624 g de un cloruro de metal alcalino sólido puro se disuelve en agua y se trata con exceso de nitrato de plata. El precipitado resultante, filtrado y secado, pesa 3.03707 g. ¿Cuál fue el porcentaje en masa de ion cloruro en el compuesto original? ¿Cuál es la identidad de la sal?
S19.1.14
Una muestra de 2.5624 g de un cloruro de metal alcalino sólido puro se disuelve en agua y se trata con exceso de nitrato de plata. El precipitado resultante, filtrado y secado, pesa 3.03707 g. ¿Cuál fue el porcentaje en masa de ion cloruro en el compuesto original? ¿Cuál es la identidad de la sal?
Suponiendo que el cloruro metálico es XCl
La ecuación de balance para la reacción sería:
\[XCl(aq)+AgNO_{3}(aq)\rightarrow XNO_{3}(aq) +AgCl(s)\]
La masa de AgCl = 3.03707g
Para encontrar los moles de AgCl presentes:
A continuación, podemos determinar los moles de AgCl presentes en la reacción ya que 1) se nos da la masa del precipitado y 2) este valor puede ayudarnos a determinar los moles de compuesto de cloruro de metal alcalino presentes. Dado que la masa de AgCl es de 3.03707g en el problema y la masa molecular de AgCl por mol es de 143.32g, podemos resolver para cuántos moles de AgCl hay en la reacción:
\[moles of Agcl=\tfrac{3.03707g}{143.32g/mol}=0.0211 mol\]
Dado que la relación molar de los compuestos es 1:1 por lo que el número de moles de XCl usados = 0.0211 mol
Podemos calcular el peso de Cl - con la ecuación:
\[0.0211 mol \times 35.5g/mol = 0.7490g\]
la cantidad de metal presente en el compuesto original es el peso del compuesto restado en peso del ion Cl:
\[(2.5624- 0.7490)g= 1.8134g\]
Y el porcentaje se puede calcular por
\[\frac{0.7490}{2.5624}\times 100= 29.23 \%\]
la relación molar de XCl es 1:1 así que entonces
Masa atómica del metal =\(=\frac{1.8134\;g\; metal}{0.0211\; mol\; RbCl}=85.943g/mol\)
Entonces la masa atómica es 85.943 g/mol que es de Rb por lo tanto la identidad de la sal es RbCl
Q19.1.15
El potencial de reducción estándar para la reacción\(\ce{[Co(H2O)6]^3+}(aq)+\ce{e-}⟶\ce{[Co(H2O)6]^2+}(aq)\) es de aproximadamente 1.8 V. El potencial de reducción para la reacción\(\ce{[Co(NH3)6]^3+}(aq)+\ce{e-}⟶\ce{[Co(NH3)6]^2+}(aq)\) es +0.1 V. Calcular los potenciales celulares para mostrar si los iones complejos, [Co (H 2 O) 6] 2+ y/o [Co (NH 3) 6] 2+, puede ser oxidado al complejo de cobalto (III) correspondiente por oxígeno.
S19.1.15
Para calcular el potencial celular, necesitamos conocer los potenciales para cada media reacción. Después de hacerlo, necesitamos determinar cuál se está oxidando y cuál se está reduciendo. El que se oxida es el ánodo y el que se reduce es el cátodo. Para encontrar el potencial de celda, usa esta fórmula y los valores de potencial de reducción que se encuentran en una tabla de potencial de reducción. Si la célula E° es positiva,\(\Delta\) G es negativa y la reacción es espontánea.
E° celda = E°cátodo - E°ánodo
Debido a que afirma que se\([Co(H_{2}O)_{6}]^{3+}\) oxidará, esto quiere decir que es el ánodo.
\(O_{2}(g) + 4 H^{+}(aq) + 4 e^{-} \rightarrow 2 H_{2}O\)+1.229 V
\(O_{2}\)se está reduciendo, por lo que es el cátodo.
1.229V - 1.8V= -.571 V, o -0.6 V usando cifras significativas. Esto no puede suceder espontáneamente porque la célula E° es negativa.
Porque\([Co(NH_{3})_{6}]^{3+}\), de nuevo se está oxidando, es decir, es el ánodo.
1.229-.1= 1.129 V o 1.1 V usando cifras significativas. Esta reacción es espontánea porque la célula E° es positiva.
A19.1.15
a) E° = −0.6 V, E° es negativo por lo que esta reducción no es espontánea.
b) E° = +1.1 V, E° es positivo por lo que esta reducción es espontánea.
Q19.1.16
Predecir los productos de cada una de las siguientes reacciones. (Nota: Además de utilizar la información de este capítulo, utilice también los conocimientos que haya acumulado en esta etapa de su estudio, incluyendo información sobre la predicción de los productos de reacción.)
- \(\ce{MnCO3}(s)+\ce{HI}(aq)⟶\)
- \(\ce{CoO}(s)+\ce{O2}(g)⟶\)
- \(\ce{La}(s)+\ce{O2}(g)⟶\)
- \(\ce{V}(s)+\ce{VCl4}(s)⟶\)
- \(\ce{Co}(s)+xs\ce{F2}(g)⟶\)
- \(\ce{CrO3}(s)+\ce{CsOH}(aq)⟶\)
S19.1.16
Hay una miríada de reacciones que pueden ocurrir, que incluyen: reemplazo simple, reemplazo doble, combustión, ácido-base/neutralización, descomposición o síntesis. El primer paso para determinar los productos de una reacción es identificar el tipo de reacción. A partir de entonces, los siguientes pasos que tome para predecir los productos variarán según el tipo de reacción.
- Esta reacción es una reacción de doble desplazamiento, en la que los cationes y aniones de los reactivos cambian de lugar para formar nuevos compuestos. Escribir la ecuación en términos de sus iones acuosos te ayudará a visualizar qué es exactamente lo que se está moviendo:
\[2H^{+}(aq)+2I^{-}(aq)\rightarrow 2H^{+}(aq)+CO_{3}^{2-}(aq)+Mn^{2+}(aq)+2I^{-}(aq)\]
En este caso, los cationes de hidrógeno se recombinarán con aniones carbonato mientras que los cationes de manganeso se recombinarán con aniones yoduro dándonos la siguiente ecuación: Sin embargo,
\[\ce{MnCO3}(s)+\ce{2HI}(aq)⟶\ce{MnI2}(aq)+\ce{H2CO3}(aq)\]
esta aún no es la respuesta final, ya que el ácido carbónico es inestable y se descompone en dióxido de carbono y agua en condiciones estándar. Teniendo esto en cuenta, nuestra ecuación final es:
\[\ce{MnCO3}(s)+\ce{2HI}(aq)⟶\ce{MnI2}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\] - Esta reacción es una reacción de síntesis, en la que dos o más reactivos se combinan para formar un compuesto más complejo. En este caso también estamos haciendo reaccionar un óxido metálico con oxígeno lo que resultaría en otro óxido metálico como producto. El producto resultante sería el óxido de valencia mixto Co 3 O 4 en el que un átomo de cobalto tiene un estado de oxidación +2 mientras que los otros dos tienen un estado de oxidación +3. Ahora todo lo que queda es equilibrar la ecuación:
\[\ce{6CoO}(s)+\ce{O2}(g)⟶\ce{2Co3O4}(s)\] - Al igual que la ecuación 2, esta reacción es también una reacción de síntesis que involucra un metal y oxígeno que debería dar como resultado la formación de un óxido metálico. Ahora se trata de equilibrar los estados de oxidación para lograr un compuesto neutro. El oxígeno siempre mantendrá un estado de oxidación -2 en los compuestos, mientras que el lantano siempre exhibirá un estado de oxidación +3. Como tal, una combinación de 2 átomos de lantano con un estado de oxidación +3 y 3 átomos de oxígeno con un estado de oxidación -2 nos dará una molécula con una carga global de 0 (3 (-2) +2 (+3) =0). Conocemos nuestro producto ahora, La 2 O 3, y ahora solo necesitamos equilibrar la ecuación general, dándonos:
\[\ce{4La}(s)+\ce{3O2}(g)⟶\ce{2La2O3}(s)\] - Esta reacción es ligeramente más difícil de definir ya que encapsula tanto las propiedades de síntesis como las reacciones de descomposición, en las que el vanadio reacciona con tetracloruro de vanadio para producir tricloruro de vanadio. Sin embargo, esta reacción es principalmente una reacción de síntesis ya que estamos combinando dos reactivos para producir un compuesto complejo. Con el tricloruro de vanadio como nuestro producto, podemos equilibrar la ecuación:
\[\ce{V}(s)+\ce{3VCl4}(s)⟶\ce{4VCl3}(s)\] - Esta es otra reacción de síntesis que combina cobalto y flúor. Esta ecuación incluye la notación “xs” frente al flúor que es la abreviatura de 'exceso', lo que significa más flúor del que realmente se requiere está presente en los reactivos, asegurando que la reacción llegue a su finalización. Encontrar los productos si es una simple cuestión de combinar el cobalto y el flúor en una molécula, lo que ya nos deja con una ecuación equilibrada:
\[\ce{Co}(s)+xs\ce{F2}(g)⟶\ce{CoF2}(s)\] - Puede que no sea obvio aquí, pero la reacción que nos han dado aquí es en realidad una reacción de base ácida/neutralización, con trióxido de cromo actuando como ácido e hidróxido de cesio como base. El trióxido de cromo se conoce como un óxido ácido, lo que significa que reaccionará con el agua para formar un ácido. Tenga en cuenta que esta reacción aún puede continuar aunque los reactivos no estén en las mismas fases. La regla básica para las reacciones ácido-base/neutralización es que forman una sal (siendo sal el término general para cualquier compuesto iónico formado a partir de reacciones ácido-base) y agua. Como sabemos que el agua es uno de nuestros productos, nuestro otro producto debe ser una sal compuesta de cesio, cromo y oxígeno. Así, nuestro otro producto debería ser el cromato de cesio, y ahora puedes equilibrar la ecuación en consecuencia:
\[\ce{CrO3}(s)+\ce{2CsOH}(aq)⟶\ce{Cs2CrO4}(aq)+\ce{H2O}\]
A19.1.16
- \(\ce{MnCO3}(s)+\ce{2HI}(aq)⟶\ce{MnI2}(aq)+\ce{CO2}(g)+\ce{H2O}(l)\)
- \(\ce{6CoO}(s)+\ce{O2}(g)⟶\ce{2Co3O4}(s)\)
- \(\ce{4La}(s)+\ce{3O2}(g)⟶\ce{2La2O3}(s)\)
- \(\ce{V}(s)+\ce{3VCl4}(s)⟶\ce{4VCl3}(s)\)
- \(\ce{Co}(s)+xs\ce{F2}(g)⟶\ce{CoF2}(s)\)
- \(\ce{CrO3}(s)+\ce{2CsOH}(aq)⟶\ce{Cs2CrO4}(aq)+\ce{H2O}\)
Q19.1.17
Predecir los productos de cada una de las siguientes reacciones. (Nota: Además de utilizar la información de este capítulo, utilice también los conocimientos que haya acumulado en esta etapa de su estudio, incluyendo información sobre la predicción de los productos de reacción.)
- \(\ce{Fe}(s)+\ce{H2SO4}(aq)⟶\)
- \(\ce{FeCl3}(aq)+\ce{NaOH}(aq)⟶\)
- \(\ce{Mn(OH)2}(s)+\ce{HBr}(aq)⟶\)
- \(\ce{Cr}(s)+\ce{O2}(g)⟶\)
- \(\ce{Mn2O3}(s)+\ce{HCl}(aq)⟶\)
- \(\ce{Ti}(s)+xs\ce{F2}(g)⟶\)
S19.1.17
Predecir los productos de cada una de las siguientes reacciones.
- Fe (s) +H 2 SO 4 (aq) ⟶?
Siempre que un metal reacciona con un ácido, los productos son sal e hidrógeno. Debido a que el Fe es menor en la serie de actividad, sabemos que cuando reacciona con un ácido dará como resultado la formación de gas hidrógeno. Para simplificar la ecuación es:
\[Metal + Acid ⟶ Salt + Hydrogen\]
La sal producida dependerá del metal y en este caso, el metal es hierro (Fe) por lo que la ecuación resultante sería:
\[\ce{Fe}(s)+\ce{H2SO4}(aq)⟶ \ce{FeSO4}(aq) + \ce{H2}(g)\]
Esta ecuación funciona a medida que el H2 se elimina de H 2 SO 2, dando como resultado un ion SO 4 2- donde Fe tomará un estado de oxidación de Fe +2 para formar FESO 4 que será la sal en este ejemplo.
Pero como FESO 4 y H2SO 4 son acuosos, los reactivos y productos también se pueden escribir como sus iones donde la ecuación general puede ser:
\[\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{SO2^{−4}}(aq)⟶\ce{Fe2+}(aq)+\ce{SO2^{−4}}(aq)+\ce{H2}(g)+\ce{2H2O}(l)\]
- FeCl 3 (aq) +NaOH (aq) ⟶?
En este caso, agregar un hidróxido metálico (NaOH) a una solución con un ion de metal de transición (Fe) formará un hidróxido de metal de transición (XOH). Como el hierro está unido a tres átomos de cloro en el lado de los reactivos, tiene el estado de oxidación de +3 donde se necesitan tres iones hidróxido (OH -) para equilibrar las cargas cuando se unen en los productos. Los iones restantes son Na + y Cl - donde se unen entre sí en una proporción 1:1 donde hay 3 moléculas de NaCl una vez que la reacción está equilibrada.
La reacción general será:
\[\ce{FeCl3}(aq)+\ce{NaOH}(aq)⟶ \ce{Fe(OH)3}(s) + \ce{3NaCl}(aq)\]
NOTA: Fe (OH) 3 (s) es un sólido ya que es una regla que todos los hidróxidos de metales de transición son insolubles y se forma un precipitado.
Dado que el NaOH (aq) y el NaCl (aq) son acuosos, podemos escribirlos en sus formas iónicas:
\[\ce{FeCl3}(aq)+\ce{3Na+}(aq)+\ce{3OH^{−}}(aq)+\ce{Fe(OH)3}(s)+\ce{3Na+}(aq)+\ce{3Cl+}(aq)\]
- Mn (OH) 2 (s) +HBr (aq) ⟶?
Este es un ejemplo de un hidróxido metálico que reacciona con un ácido donde siempre se formará una sal metálica y agua:
\[Metal Hydroxide + Acid ⟶ Metal Salt + Water\]
Cuando se aplique esta regla a esta ecuación, obtendremos lo siguiente:
\[\ce{Mn(OH)2}(s)+\ce{HBr}(aq)⟶ \ce{MnBr2}(aq)+\ce{2H2O}(l)\]
Pero para seguir adelante con esta pregunta, las soluciones acuosas como HBr (aq) y MnBr 2 (aq) se pueden reescribir como:
\[\ce{Mn(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2Br-}(aq)⟶\ce{Mn2+}(aq)+\ce{2Br-}(aq)+\ce{4H2O}(l)\]
- Cr (s) +O 2 (g) ⟶?
Esta es la reacción general de un metal que reacciona con oxígeno que siempre resultará en un óxido metálico. Sin embargo, el óxido metálico está determinado por el estado de oxidación del metal por lo que puede haber varios resultados de esta reacción como:
\[\ce{4Cr}(s)+\ce{3O2}(g)⟶\ce{2Cr2O3}(s)\]
\[\ce{Cr}(s)+\ce{O2}(g)⟶\ce{2CrO}(s)\]
\[\ce{Cr}(s)+\ce{O2}(g)⟶\ce{CrO2}(s)\]
\[\ce{2Cr}(s)+\ce{3O2}(g)⟶\ce{CrO3}(s)\]
Sin embargo, Cr 2 O 3 es el principal óxido de cromo por lo que se puede suponer que este es el producto general de esta reacción.
- Mn 2 O 3 (s) +HCl (aq) ⟶?
Esto sigue a la reacción general de un óxido metálico y un ácido siempre dará como resultado una sal y agua
\[Metal Oxide + Acid ⟶ Salt + Water\]
Usando esta reacción general, similar a las reacciones generales anteriores, la reacción dará como resultado:
\[\ce{Mn2O3}(s)+\ce{HCl}(aq)⟶\ce{2MnCl3}(s)+\ce{9H2O}(l)\]
Sin embargo, dado que el HCl es una solución acuosa, la ecuación general también se puede reescribir como:
\[\ce{Mn2O3}(s)+\ce{6H3O+}(aq)+\ce{6Cl-}(aq)⟶\ce{2MnCl3}(s)+\ce{9H2O}(l)\]
- Ti (s) +xSF 2 (g) ⟶?
El titanio es capaz de reaccionar con los halógenos donde hay dos estados de oxidación que el titanio puede ser: +3 y +4. Las siguientes reacciones siguen cada estado de oxidación en consecuencia:
\[\ce{2Ti}(s)+\ce{3F2}(g)⟶ \ce{2TiF3}(s)\]
\[\ce{Ti}(s)+\ce{2F2}(g)⟶\ce{TiF4}(s)\]
Sin embargo, dado que existe el símbolo “xs”, esto indica que F 2 se agrega en exceso por lo que se favorece más la segunda reacción ya que impulsa la reacción a su finalización.
EN GENERAL:
\[\ce{Ti}(s)+\ce{xsF2}(g)⟶\ce{TiF4}(g)\]
A19.1.17
- \(\ce{Fe}(s)+\ce{2H3O+}(aq)+\ce{SO4^2-}(aq)⟶\ce{Fe^2+}(aq)+\ce{SO4^2-}(aq)+\ce{H2}(g)+\ce{2H2O}(l)\);
- \(\ce{FeCl3}(aq)+\ce{3Na+}(aq)+\ce{3OH-}(aq)+\ce{Fe(OH)3}(s)+\ce{3Na+}(aq)+\ce{3Cl+}(aq)\);
- \(\ce{Mn(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2Br-}(aq)⟶\ce{Mn^2+}(aq)+\ce{2Br-}(aq)+\ce{4H2O}(l)\);
- \(\ce{4Cr}(s)+\ce{3O2}(g)⟶\ce{2Cr2O3}(s)\);
- \(\ce{Mn2O3}(s)+\ce{6H3O+}(aq)+\ce{6Cl-}(aq)⟶\ce{2MnCl3}(s)+\ce{9H2O}(l)\);
- \(\ce{Ti}(s)+xs\ce{F2}(g)⟶\ce{TiF4}(g)\)
Q19.1.18
Describir el proceso electrolítico para refinar cobre.
S19.1.18
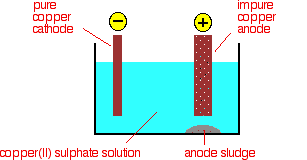
Por electrólisis, el cobre se puede refinar y hacer puramente. La razón por la cual el cobre necesita eliminar las impurezas es porque ayuda a aumentar la conductividad eléctrica en el cable eléctrico. Se puede refinar el cobre y eliminar las impurezas a través de la electrólisis. El cobre puro es importante en la fabricación de cables eléctricos, ya que crea una mejor conductividad eléctrica al transferir electricidad. Para una mejor conductividad eléctrica, es necesario eliminar las impurezas y esto se puede hacer mediante la cocción del cobre impuro para eliminar las impurezas, como azufre, oxígeno, etc. y conformarlas en ánodos eléctricos que pueden ser utilizados en la electrólisis. Luego los electrodos de cobre se colocan en una celda eléctrica (en vasos de precipitados separados) donde la corriente eléctrica puede pasar a través de los vasos y sobre los electrodos. A través de este proceso, el cobre se desprende del ánodo y se deposita sobre el cátodo. Este proceso ayuda a eliminar las impurezas y refinar el cobre porque todo el cobre se ha depositado sobre el cátodo todo en un solo electrodo. Este proceso aumenta el peso del cátodo debido a que el cobre se deposita sobre el cátodo. Este es un excelente ejemplo de cómo saber si un electrodo es un cátodo o un ánodo, como se indica en la Q17.2.9 anterior.
Q19.1.19
Predecir los productos de las siguientes reacciones y equilibra las ecuaciones.
- Se agrega Zn a una solución de Cr 2 (SO 4) 3 en ácido.
- Se agrega FeCl 2 a una solución que contiene un exceso\(\ce{Cr2O7^2-}\) de ácido clorhídrico.
- Se agrega Cr 2+\(\ce{Cr2O7^2-}\) en solución ácida.
- El Mn se calienta con CrO 3.
- Se agrega CrO a 2HNO 3 en agua.
- Se agrega FeCl 3 a una solución acuosa de NaOH.
S19.1.19
se añade a una solución
de ácido.
- Semi-reacción oxidada:
- Media reacción de reducción:
- Reacción general:
- El cromo precipitará de la solución porque tiene un mayor potencial de reducción que el Zinc; la reacción es un solo reemplazo.
- Semi-reacción oxidada:
se añade a una solución que contiene un exceso
de ácido clorhídrico.
- Reacción de disociación:
- Semi-reacción de oxidación:
- Media reacción de reducción:
- Reacción general:
- El potencial de reducción para permanganato es mayor por lo que la reacción sigue siendo favorable incluso cuando la oxidación de
es negativa.
- Reacción de disociación:
en solución ácida.
- Media reacción de reducción:
- Semi-reacción de oxidación:
- Reacción general:
- La reacción es favorable con un alto positivo
- Media reacción de reducción:
se calienta con
.
- Media reacción de reducción:
- Semi-reacción de oxidación:
- Reacción general:
- El calor crea un producto con mayor energía que ambos reactivos anteriores.
- Media reacción de reducción:
se agrega
en agua.
- Disociación ácida fuerte:
- Reacción general:
- Esta reacción funciona por intercambio de electrones para producir iones de cromo.
- Disociación ácida fuerte:
se añade a una solución acuosa de
.
- Reacción general:
- El hidróxido de hierro precipitará porque los dos metales intercambiarán aniones.
- Reacción general:
A19.1.19
- \(\ce{Cr2(SO4)3}(aq)+\ce{2Zn}(s)+\ce{2H3O+}(aq)⟶\ce{2Zn^2+}(aq)+\ce{H2}(g)+\ce{2H2O}(l)+\ce{2Cr^2+}(aq)+\ce{3SO4^2-}(aq)\);
- \(\ce{4TiCl3}(s)+\ce{CrO4^2-}(aq)+\ce{8H+}(aq)⟶\ce{4Ti^4+}(aq)+\ce{Cr}(s)+\ce{4H2O}(l)+\ce{12Cl-}(aq)\);
- En solución ácida entre pH 2 y pH 6, se\(\ce{CrO4^2-}\) forma\(\ce{HrCO4-}\), que está en equilibrio con el ion dicromato. La reacción es\(\ce{2HCrO4-}(aq)⟶\ce{Cr2O7^2-}(aq)+\ce{H2O}(l)\). A otros pH ácidos, la reacción es\(\ce{3Cr^2+}(aq)+\ce{CrO4^2-}(aq)+\ce{8H3O+}(aq)⟶\ce{4Cr^3+}(aq)+\ce{12H2O}(l)\);
- \(\ce{8CrO3}(s)+\ce{9Mn}(s)\overset{Δ}{⟶}\ce{4Cr2O3}(s)+\ce{3Mn3O4}(s)\);
- \(\ce{CrO}(s)+\ce{2H3O+}(aq)+\ce{2NO3-}(aq)⟶\ce{Cr^2+}(aq)+\ce{2NO3-}(aq)+\ce{3H2O}(l)\);
- \(\ce{CrCl3}(s)+\ce{3NaOH}(aq)⟶\ce{Cr(OH)3}(s)+\ce{3Na+}(aq)+\ce{3Cl-}(aq)\)
Q19.1.20
¿Cuál es el gas que se produce cuando el sulfuro de hierro (II) se trata con un ácido no oxidante?
S19.1.20
Fórmula para sulfuro de hierro (II):\[FeS\]
Definición de ácido no oxidante: Un ácido no oxidante es un ácido que no actúa como agente oxidante. Su anión es un agente oxidante más débil que el H+, por lo que no se puede reducir. Ejemplos de ácidos no oxidantes:\[HCl, HI, HBr, H_3PO_4, H_2SO_4\]
Paso 2: Elija uno de los ácidos no oxidantes, en este caso HCl, y escriba la reacción química:
\[FeS(s)+2HCl(aq)\rightarrow FeCl_2(s)+H_2S(g)\]
El gas producido cuando el sulfuro de hierro (II) tratado con un ácido no oxidante, HCl, es H 2 S (sulfuro de dihidrógeno) gas.
Q19.1.21
Predecir los productos de cada una de las siguientes reacciones y luego equilibrar las ecuaciones químicas.
- El Fe se calienta en una atmósfera de vapor.
- Se agrega NaOH a una solución de Fe (NO 3) 3.
- Se agrega FESO 4 a una solución ácida de KMnO 4.
- Se agrega Fe a una solución diluida de H 2 SO 4.
- Se deja reposar al aire una solución de Fe (NO 3) 2 y HNO 3.
- Se agrega FeCo 3 a una solución de HClO 4.
- El Fe se calienta en el aire.
S19.1.21
a. El vapor es agua (\(\ce{H_{2}O}\))
Podemos escribir la reacción como:
\(\ce{Fe}\)+\(\ce{H_{2}O}\) →?
Esta es una sola reacción de reemplazo, por lo que\(\ce{Fe}\) reemplaza\(\ce{H_{2}}\). Entonces, uno de los productos es\(\ce{Fe_{3}O_{4}}\) ya que es una combinación de óxido de hierro (II),\(\ce{FeO}\), y óxido de hierro (III),\(\ce{Fe_{2}O_{3}}\).
El\(\ce{Fe}\) se calienta en una atmósfera de vapor. \(\ce{H_{2}}\)se carga neutralmente y se convierte en otro producto.
Después de equilibrar los coeficientes, la reacción final es:
\(\ce{3Fe}(s)\)+\(\ce{4H_{2}O}(g)\) →\(\ce{Fe_{3}O_{4}}(s)\) +\(\ce{4H_{2}}(g)\)
b.\(\ce{NaOH}\) agregado a una solución de\(\ce{Fe(NO_{3})_{3}}\) es una reacción de doble reemplazo y precipitación.
Podemos escribir la reacción como:
\(\ce{NaOH}\)+\(\ce{Fe(NO_{3})_{3}}\) →?
El\(\ce{Na}\) y\(\ce{Fe}\) cambiar a formar\(\ce{Fe(OH)_{3}}(s)\) y\(\ce{NaNO_{3}}(aq)\).
\(\ce{Fe(OH)_{3}}\)es sólido porque es insoluble de acuerdo con las reglas de solubilidad.
Después de equilibrar los coeficientes en la reacción, la reacción final es:
\(\ce{Fe(NO_{3})_{3}}(aq)\)+\(\ce{3NaOH}(aq)\) →\(\ce{Fe(OH)_{3}}(s)\) +\(\ce{NaNO_{3}}(aq)\)
c. Por ejemplo, el ácido utilizado para elaborar la solución ácida es\(\ce{H_{2}SO_{4}}\), entonces la reacción es:
\(\ce{FeSO_{4}}\)+\(\ce{KMnO_{4}}\) +\(\ce{H_{2}SO_{4}}\) →\(\ce{Fe_{2}(SO_{4})_{3}}\) +\(\ce{MnSO_{4}}\) +\(\ce{H_{2}O}\) +\(\ce{K_{2}SO_{4}}\)
A continuación, la reacción neta iónica tiene que escribirse para deshacerse de los iones del espectador en la reacción, esto se escribe como:
\(\ce{Fe^{2+}}\)+\(\ce{MnO_{4}^{-}}\) +\(\ce{H^{+}}\) →\(\ce{Fe^{3+}}\) +\(\ce{Mn^{2+}}\) +\(\ce{H_{2}O}\)
Como se ve en la ecuación neta iónica anterior,\(\ce{Fe^{2+}}\) se oxida a\(\ce{Fe^{3+}}\) y\(\ce{MnO_{4}^{-}}\) se reduce a\(\ce{Mn^{2+}}\). Estos pueden escribirse como dos medias reacciones:
\(\ce{Fe^{2+}}\)→\(\ce{Fe^{3+}}\)
\(\ce{MnO_{4}^{-}}\)→\(\ce{Mn^{2+}}\)
Para equilibrar la media reacción de oxidación, un electrón como para ser agregado a la\(\ce{Fe^{3+}}\), esto se muestra como:
\(\ce{Fe^{2+}}\)→\(\ce{Fe^{3+}}\) +\(\ce{e^{-}}\)
La media reacción de reducción también tiene que ser equilibrada, pero con\(\ce{H^{+}}\) iones y\(\ce{H_{2}O}\), esto se muestra como:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) →\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\)
Después de equilibrar la carga de los\(\ce{Mn}\) átomos, la carga global tiene que ser equilibrada en ambos lados porque en el lado de los reactivos, la carga es\(\ce{7+}\), y la carga en el lado de los productos lo es\(\ce{2+}\). La carga general se puede equilibrar mediante la adición de electrones, esto se muestra como:
\(\ce{MnO_{4}^{-}}\)\(\ce{8H^{+}}\)+\(\ce{5e^{-}}\) →\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\)
Ahora como ambas medias reacciones están equilibradas, los electrones en ambas medias reacciones tienen que ser iguales, y luego se suman las medias reacciones. Una vez hecho esto, la reacción se ve así:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\)\(\ce{5Fe^{2+}}\) +\(\ce{5e^{-}}\) → +\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\) +\(\ce{5Fe^{3+}}\) +\(\ce{5e^{-}}\)
Los de ambos\(\ce{5e^{-}}\) lados cancelan y la reacción equilibrada final es:
\(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) +\(\ce{5Fe^{2+}}\) →\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\) +\(\ce{5Fe^{3+}}\)
d.\(\ce{Fe}\) agregado a una solución diluida de\(\ce{H_{2}SO_{4}}\) es una sola reacción de reemplazo.
El\(\ce{Fe}\) se agrega a una solución diluida por lo que el\(\ce{H_{2}SO_{4}}\) se escribe como iones separados.
Podemos escribir la reacción como:
\(\ce{Fe}(s)\)+\(\ce{2H^+}(aq)\) +\(\ce{(SO_{4})^{2-}}(aq)\) →?
El Fe reemplaza al\(\ce{H^+}\) ion, y se convierte en un\(\ce{Fe^{2+}}\) ion.
\(\ce{H_{2}O}\)también es un producto porque la solución está diluida.
Además, el\(\ce{FeSO_{4}}\) también tiene que ser separado en iones como resultado de la\(\ce{Fe}\) adición a una solución diluida.
Después de equilibrar todos los coeficientes, la reacción final es:
\(\ce{Fe}(s)\)+\(\ce{(2H_{3}O)^+}(aq)\) +\(\ce{(SO_{4})^{2-}}(aq)\) →\(\ce{Fe^{2+}}(aq)\) +\(\ce{SO_{4}^{2-}}(aq)\) +\(\ce{H_{2}}(g)\) +\(\ce{2H_{2}O}(l)\)
Nota: también se\(\ce{H^+}\) puede escribir como el ion hidronio,\(\ce{(H_{3}O)^{+}}\).
e. Inicialmente podemos escribir:
\(\ce{4Fe(NO_{3})_{2}}\)+\(\ce{4HNO_{3}}\) +\(\ce{O_{2}}\) →?
Escribimos el término oxígeno en los reactivos porque se afirma que la solución se deja reposar en el aire.
Solo tenemos que analizar los posibles productos que se pueden formar y podemos ver que el hidrógeno del ácido nítrico se puede combinar con el gas oxígeno para formar agua y luego combinar todo junto, obtenemos que la reacción final sea:
\(\ce{4Fe(NO_{3})_{2}}(aq)\)\(\ce{4HNO_{3}}(aq)\)+\(\ce{O_{2}}(g)\) →\(\ce{2H_{2}O}(l)\) +\(\ce{4Fe(NO_{3})_{3}}(aq)\)
f. Cuando\(\ce{FeCO_{3}}\) se agrega a\(\ce{HClO_{4}}\), se produce una reacción de reemplazo doble.
El\(\ce{Fe^{2+}}\) ion cambia puntos con el\(\ce{H^+}\) ion para formar\(\ce{Fe(ClO_{4})_{2}}\) como un producto.
Cuando el\(\ce{H^+}\) ion se agrega al\(\ce{(CO_{3})^{2-}}\) ion,\(\ce{H_{2}CO_{3}}\) se forma.
Después de equilibrar los coeficientes, la reacción final es:
\(\ce{FeCO_{3}}(s)\)+\(\ce{HClO_{4}}(aq)\) →\(\ce{Fe(ClO_{4})_{2}}(aq)\) +\(\ce{H_{2}O}(l)\) +\(\ce{CO_{2}}(g)\)
g. El aire está compuesto por gas oxígeno, que es una molécula diatómica, así lo es\(\ce{O_{2}}\).
Agregar\(\ce{Fe}\) a\(\ce{O_{2}}\) provocará que se produzca una reacción de síntesis formando\(\ce{Fe_{2}O_{3}}\).
Después de equilibrar los coeficientes, la reacción final es:
\(\ce{3Fe}(s)\)+\(\ce{2O_{2}}(g)\) →\(\ce{Fe_{2}O_{3}}(s)\)
A19.1.21
- \(\ce{3Fe}(s)+\ce{4H2O}(g)⟶\ce{Fe3O4}(s)+\ce{4H2}(g)\);
- \(\ce{3NaOH}(aq)+\ce{Fe(NO3)3}(aq)\xrightarrow{\ce{H2O}}\ce{Fe(OH)3}(s)+\ce{3Na+}(aq)+\ce{3NO3-}(aq)\);
- \(\ce{MnO_{4}^{-}}\)+\(\ce{8H^{+}}\) +\(\ce{5Fe^{2+}}\) →\(\ce{Mn^{2+}}\) +\(\ce{4H_{2}O}\) +\(\ce{5Fe^{3+}}\)
- \(\ce{Fe}(s)\)+\(\ce{(2H_{3}O)^+}(aq)\) +\(\ce{(SO_{4})^{2-}}(aq)\) →\(\ce{Fe^{2+}}(aq)\) +\(\ce{SO_{4}^{2-}}(aq)\) +\(\ce{H_{2}}(g)\) +\(\ce{2H_{2}O}(l)\)
- \(\ce{4Fe(NO_{3})_{2}}(aq)\)\(\ce{4HNO_{3}}(aq)\)+\(\ce{O_{2}}(g)\) →\(\ce{2H_{2}O}(l)\) +\(\ce{4Fe(NO_{3})_{3}}(aq)\)
- \(\ce{FeCO_{3}}(s)\)+\(\ce{HClO_{4}}(aq)\) →\(\ce{Fe(ClO_{4})_{2}}(aq)\) +\(\ce{H_{2}O}(l)\) +\(\ce{CO_{2}}(g)\)
- \(\ce{3Fe}(s)\)+\(\ce{2O_{2}}(g)\) →\(\ce{Fe_{2}O_{3}}(s)\)
Q19.1.22
Equilibrar las siguientes ecuaciones mediante métodos de oxidación-reducción; tenga en cuenta que tres elementos cambian el estado de oxidación.
\[\ce{Co(NO3)2}(s)⟶\ce{Co2O3}(s)+\ce{NO2}(g)+\ce{O2}(g)\]
S19.1.22
Equilibrar las siguientes ecuaciones mediante métodos de oxidación-reducción; tenga en cuenta que tres elementos cambian el estado de oxidación.
\[Co(NO_3){_2(s)}⟶Co_2O{_3(s)}+NO{_2(g)}+O{_2(g)}\]
En esta reacción, el N cambia los estados de oxidación de +5 a +4 (reducido), el Co cambia los estados de oxidación de +2 a +3 (oxidado) y O cambia los estados de oxidación de -2 a 0 (también oxidado).
Primero, dividir esta reacción en un conjunto de reacción de oxidación y reducción, y equilibrar todos los elementos que no son hidrógeno u oxígeno (trataremos de estos más adelante):
\[Reduction: 2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2\]
Ahora, para la reacción de oxidación, solo estamos tratando con O 2 en el lado de los productos. Para equilibrar esto, necesitaremos agregar agua e hidrógeno a ambos lados:
\[Oxidation: 2H_2O\rightarrow O_2+4H^+ \]
Equilibrar la cantidad de oxígenos en cada lado agregando el número correcto de moléculas de agua (H 2 O), y balancear la cantidad de hidrógeno agregando el número correcto de átomos de H +:
\[Reduction: 2H^++2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2+H_2O\]
\[Oxidation: 2H_2O\rightarrow O_2+4H^+\]
Finalmente, equilibra las cargas añadiendo electrones a cada lado de la ecuación. Para la reacción de reducción, agregaremos 2 electrones para equilibrar el 2H +, y a la reacción de oxidación, agregaremos 4 electrones para equilibrar el 4H +. Recuerda, el objetivo de este paso es asegurarnos de que los cargos estén equilibrados, para que podamos cancelarlos al final.
\[Reduction: 2e^- + 2H^++2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2+H_2O\]
\[Oxidation: 2H_2O\rightarrow O_2+4H^+ +4e^-\]
Multiplique la reacción de reducción por dos, a fin de equilibrar las cargas de manera que haya 4 electrones en cada lado de la reacción.
\[Reduction: 2(2e^- + 2H^++2Co(NO_3){_2}\rightarrow Co_2O_{3}+4NO_2+H_2O)\]
y combinar ambas reacciones que sale a:
\[2H_2O + 4Co(NO_3)_2 + 4H^+ \rightarrow 2CO_2O_3 + 8NO_2 + 2H_2O + O_2 + 4H^+\]
Cancelar términos similares:
\[4Co(NO_3){_2(s)} \rightarrow 2CO_2O{_3(s)} + 8NO{_2(g)} + O{_2(g)}\]
Ambos lados tienen cargos generales de 0 y se puede verificar para ver si están equilibrados.
A19.1.22
\[4Co(NO_3){_2(s)} \rightarrow 2CO_2O{_3(s)} + 8NO{_2(g)} + O{_2(g)}\]
Q19.1.23
La solución diluida de cianuro de sodio se gotea lentamente en una solución de nitrato de plata agitada lentamente. Un precipitado blanco se forma temporalmente pero se disuelve a medida que continúa la adición de cianuro de sodio. Utilizar ecuaciones químicas para explicar esta observación. El cianuro de plata es similar al cloruro de plata en su solubilidad.
S19.1.23
La solución diluida de cianuro de sodio se gotea lentamente en una solución de nitrato de plata agitada lentamente. Un precipitado blanco se forma temporalmente pero se disuelve a medida que continúa la adición de cianuro de sodio. Utilizar ecuaciones químicas para explicar esta observación. El cianuro de plata es similar al cloruro de plata en su solubilidad.
A: Paso 1: mira la pregunta y comienza a escribir un producto general a fórmula reaccionante para esta reacción.
Paso 2: tratar de razonar por qué se formará un precipitado pero sólo por un periodo finito de tiempo antes de reformarse en una sustancia acuosa.
Paso 3: Con el paso 2 deberías haber notado que la reacción es una reacción de múltiples pasos y usando la fórmula aproximada que derivaste en el paso 1, deberías probar y ver cuáles son las series de pasos que conducen al producto general de AgCn 2 líquido
En esta reacción vemos cómo se agrega NaCN a AgnO 3. Se forma un precipitado pero luego desaparece con la adición de aún más NaCN, esto debe significar que es una reacción intermedia que no aparecerá como el producto final. La plata y el cianuro se unen temporalmente, pero el enlace es demasiado débil para mantenerlos unidos por lo que se vuelven a separar cuando se agrega NaCN debido a que se forma un compuesto nuevo, más fuerte y estable: [Ag (CN) 2] - (aq).
La ecuación de reacción real cuando está teniendo lugar por primera vez es\[AgCl(aq)+NaCN(aq)\rightarrow AgCN(s)+NaCl(aq)\]
Esto se puede escribir de la siguiente manera: a medida que se agrega CN −, la plata y el cianuro se combinan: Ag + (aq) +CN − (aq) →AgCN (s)
A medida que más CN - se agrega la plata y dos cianuros se combinan para crear un compuesto más estable: Ag + (aq) +2CN − (aq) → [Ag (CN) 2] - (aq)
AgCN (s) + CN - (aq) → [Ag (CN) 2] - (aq)
A19.1.23
A medida que se agrega CN −,
\[\ce{Ag+}(aq)+\ce{CN-}(aq)⟶\ce{AgCN}(s)\]
A medida que se agrega más CN −,
\[\ce{Ag+}(aq)+\ce{2CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)\]
\[\ce{AgCN}(s)+\ce{CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)\]
Q19.1.24
Predecir cuál será más estable, [CrO 4] 2− o [WO 4] 2−, y explique.
S19.1.24
De acuerdo con las reglas asociadas con las Energías Estabilizadoras de Campos Cristales, las moléculas estables contienen más electrones en los orbitales moleculares de menor energía que en los orbitales moleculares de alta energía. En este caso, ambos complejos tienen O 4 como ligandos, y ambos tienen una carga -2. Por lo tanto, se determina la estabilidad comparando los metales. El cromo se encuentra en la órbita 3d, según la tabla periódica. El tungsteno (W) está en la órbita 5d. 3d es un nivel de energía más bajo que 5d.Los orbitales de nivel superior se ionizan más fácilmente y hacen que su forma elemental base sea más estable. Si la forma elemental es más estable la forma oxidada es menos estable. Por lo tanto, [CrO 4] 2− es más estable que [WO 4] 2−.
A19.1.24
[CrO 4] 2- es más estable porque el Cromo está en el orbital 3d mientras que el Tungsteno está en el orbital 4d, que tiene un nivel de energía más alto y lo hace menos estable.
Q19.1.25
Dar el estado de oxidación del metal para cada uno de los siguientes óxidos de la primera serie de transición. (Sugerencia: Los óxidos de fórmula M 3 O 4 son ejemplos de compuestos de valencia mixta en los que el ion metálico está presente en más de un estado de oxidación. Es posible escribir estas fórmulas compuestas en el formato equivalente MO·M 2 O 3, para permitir la estimación de los dos estados de oxidación del metal).
- Sc 2 O 3
- TiO 2
- V 2 O 5
- CrO 3
- MnO
- Fe 3 O 4
- Co 3 O 4
- NiO
- Cu 2 O
S19.1.25
El primer paso para resolver este problema es mirar las reglas de los estados oxidantes para diversos elementos:
chem.libretexts.org/core/analytical_chemistry/electroquímica/redox_química/oxidation_state
Las principales reglas que se utilizarán en estos problemas serán la regla 6 del estado de oxidación que establece que el estado de oxidación para el Oxígeno es (-2) y la regla 2 que es que la suma total del estado de oxidación de todos los átomos en una especie dada es igual a la carga neta sobre esa especie. Resolver estos problemas requiere álgebra simple. Los estados de oxidación de ambos elementos en el compuesto es igual a cero, por lo que establecer la oxidación desconocida del elemento que no es oxígeno a una variable\({x}\), y el estado de oxidación de Oxígeno igual a\({-2}\). Después multiplicar ambos estados de oxígeno por el número de átomos del elemento presente. Sumar los valores juntos, establecer la ecuación igual a cero y resolver para\({x}\).
- \(\ce{Sc2O3}={3{(-2)}}+{2{x}}={0}⟶{-6}+{2{x}}={0}⟶{x}={Sc}={+3}\)\(Sc^{3+}\)
- \(\ce{TiO2}={2{(-2)}}+{x}={0}⟶{-4}+{x}={0}⟶{x}={Ti}={+4}\)\(Ti^{4+}\)
- \(\ce{V2O5}={5{(-2)}}+{2{x}}={0}⟶{-10}+{2{x}}={0}⟶{x}={V}={+5}\)\(V^{5+}\)
- \(\ce{CrO3}={3{(-2)}}+{x}={0}⟶{-6}+{x}={0}⟶{x}={Cr}={+6}\)\(Cr^{6+}\)
- \(\ce{MnO2}={2{(-2)}}+{x}={0}⟶{-4}+{x}={0}⟶{x}={Mn}={+4}\)\(Mn^{4+}\)
- \(\ce{Fe3O4}=\ce{FeO}·\ce{Fe2O3}=\)
\(\ce{FeO}={-2}+{x}={0}⟶{x}={Fe}={+2}\)\(Fe^{2+}\)
\(\ce{Fe2O3}={3{(-2)}}+{2{x}}={0}⟶{-6}+{2x}={0}⟶{x}={Fe}={+3}\)\(Fe^{3=}\)
(Un átomo de Fe tiene un estado de oxidación de +2 y los otros 2 átomos de Fe tienen un estado de oxidación de +3)
7. \(\ce{Co3O4}=\ce{CoO}·\ce{Co2O3}=\)
\(\ce{CoO}={-2}+{x}={0}⟶{x}={Co}={+2}\)\(Co^{2+}\)
\(\ce{Co2O3}={3{(-2)}}+{2{x}}={0}⟶{-6}+{2x}={0}⟶{x}={Co}={+3}\)\(Co^{3+}\)
(Un átomo de Co tiene un estado de oxidación de +2 y los otros 2 átomos de Co tienen un estado de oxidación de +3)
8. \(\ce{NiO}={-2}+{x}={0}⟶{x}={Ni}={+2}\)\(Ni^{2+}\)
9. \(\ce{Cu2O}={-2}+{2{x}}={0}⟶{-2}+{2x}={0}⟶{x}={Cu}={+1}\)\(Cu^{1+}\)
A19.1.25
Sc 3+; Ti 4+; V 5+; Cr 6+; Mn 4+; Fe 2+ y Fe 3+; Co 2+ y Co 3+; Ni 2+; Cu +
19.2: Coordinación Química de Metales de Transición
Q19.2.1
Indique el número de coordinación para el átomo metálico central en cada uno de los siguientes compuestos de coordinación:
- [Pt (H 2 O) 2 Br 2]
- [Pt (NH 3) (py) (Cl) (Br)] (py = piridina, C 5 H 5 N)
- [Zn (NH 3) 2 Cl 2]
- [Zn (NH 3) (py) (Cl) (Br)]
- [Ni (H 2 O) 4 Cl 2]
- [Fe (es) 2 (CN) 2] + (en = etilendiamina, C 2 H 8 N 2)
S19.2.1
Primero debemos identificar si el ligando tiene o no más de un átomo unido (bidentado/polidentado). Usando la tabla a continuación somos capaces de hacer esto.
| ligando | Número de átomos enlazados |
|---|---|
| Ammine (NH 3) | monodentado |
| Agua (H 2 O) | monodentado |
| Bromo (Br) | monodentado |
| Cloro (Cl) | monodentado |
| Ciano (CN) | monodentado |
| Piridina (C 5 H 5 N) | monodentado |
| Etilendiamina (C 2 H 8 N 2) | bidente |
Ahora que hemos identificado el número de átomos unidos de cada ligando, podemos encontrar el número total de átomos unidos al ion metálico central, dándonos el número de coordinación.
- \([Pt(H_2O)_2Br_2]\): Podemos identificar el ion metálico en el complejo como Pt, platino, ya que los otros dos están listados como ligandos anteriormente y no son metálicos. Ahora podemos usar el número de ligandos y sus átomos de enlace para encontrar su número de coordinación. De la tabla anterior vemos que H 2 O tiene sólo un átomo de enlace y Br también. Entonces para cada átomo de Br tenemos un átomo de enlace, y tenemos dos de estos, produciendo 2 átomos de enlace; esto es lo mismo para H 2 O, dándonos un número total de 4 átomos de enlace, y por lo tanto un número de coordinación de 4.
- \([Pt(NH_3)(py)(Cl)(Br)]\)(py = piridina, C 5 H 5 N): El ion metálico en este complejo, de manera similar al primero, puede identificarse como Pt, platino. Los ligandos pueden identificarse como NH 3, piridina, Cl y Br, que son todos ligandos monodentados y tienen un átomo de enlace cada uno. Dado que tenemos cuatro ligandos, cada uno con un átomo de enlace, el número total de átomos de enlace en el ión metálico es de 4, por lo tanto el complejo tiene un número de coordinación de 4.
- \([Zn(NH_3)_2Cl_2]\): El ion metálico en este complejo se puede identificar como Zn, zinc, y los ligandos pueden identificarse como NH 3 y Cl. Dado que estos dos son ambos ligandos monodentados, tienen un átomo de unión cada uno. Dado que tenemos un total de dos ligandos NH 3 y dos Cl, obtenemos un total de cuatro ligandos monodentados, lo que nos da 4 átomos de enlace y un número de coordinación de 4.
- \([Zn(NH_3)(py)(Cl)(Br)]\): El ion metálico en este complejo se puede identificar como Zn, zinc, y los ligandos pueden identificarse como NH 3, piridina, Cl y Br, que son todos ligandos monodentados y tienen un átomo de unión cada uno. Dado que tenemos cuatro ligandos, cada uno con un átomo de enlace, el número total de átomos de enlace en el ión metálico es de 4, por lo tanto el complejo tiene un número de coordinación de 4.
- \([Ni(H_2O)_4Cl_2]\): El ion metálico en este complejo se puede identificar como Ni, níquel, y ahora podemos usar el número de ligandos y sus átomos de enlace para encontrar su número de coordinación. De la tabla anterior vemos que H 2 O tiene solo un átomo de enlace y Cl también. Entonces por cada átomo de Cl tenemos un átomo de enlace, y tenemos dos de estos, produciendo 2 átomos de enlace. H 2 O es lo mismo, teniendo sólo un átomo de enlace, pero hay cuatro de estos. Entonces esto nos da un número total de 6 átomos de enlace, y por lo tanto un número de coordinación de 6.
- \([Fe(en)_2(CN)_2]^+\)(en = etilendiamina, C 2 H 8 N 2): El ion metálico en este complejo puede identificarse como Fe, hierro, y los ligandos pueden identificarse como (en) y CN. Dado que (en) es bidentado, lo que significa que tiene 2 átomos de enlace, y hay dos de estos, el número total de átomos de enlace de (en) es de cuatro. Dado que CN es monodentado, lo que significa que tiene un átomo de enlace, y hay dos de estos, el número total de átomos de enlace del ligando CN es dos. Entonces, el número total de átomos enlazantes es 6, por lo tanto el complejo tiene un número de coordinación de 6.
A19.2.1
- Los 2 ligandos aqua y 2 bromo forman un total de 4 enlaces covalentes coordinados y como resultado el número de coordinación es 4.
- La ammina, piridina, cloro y bromo forman cada uno un enlace covalente coordinado que da un total de 4 y por lo tanto CN=4.
- Dos ligandos amina y dos cloro dan un total de 4 enlaces covalentes coordinados y un CN = 4.
- Una amina, una pirimidina, un cloro y un ligando bromo dan un total de 4 enlaces covalentes, dando como resultado CN = 4.
- Cuatro ligandos aqua y dos ligandos cloro forman un total de 6 enlaces covalentes coordinados y un CN =6.
- La etilendiamina es un ligando bidentado que forma dos enlaces covalentes coordinados; junto con dos ligandos ciano, forma un total de 6 enlaces, y por lo tanto tiene un CN=6.
Q19.2.2
Indique los números de coordinación y escriba las fórmulas para cada uno de los siguientes, incluyendo todos los isómeros en su caso:
- ion tetrahidroxozincato (II) (tetraédrico)
- ión hexacianopaladato (IV)
- ión dicloroaurato (tenga en cuenta que el aurum es latino para “oro”)
- diamminodicloroplatino (II)
- diamminetetraclorocromato de potasio (III)
- hexaaminecobalt (III) hexacianocromato (III)
- nitrato de dibromobis (etilendiamina) cobalto (III)
S19.2.2
Para determinar los números de coordinación debemos contar el número total de ligandos unidos al metal central y distinguir los ligandos monodentados y polidentados. Para determinar las fórmulas, utilizamos las reglas de nomenclatura y trabajamos hacia atrás.
- “tetrahidroxo” = 4 ligandos de hidróxido; dado que el hidróxido es un ligando monodentado, tenemos un total de 4 enlaces al metal central.
Número de Coordinación: 4
Revisamos los fundamentos de la nomenclatura y vemos que “tetra” = 4 y “hidroxo” = OH -. Dado que la carga sobre zinc es 2+, que se da en la nomenclatura por los números romanos, podemos calcular la carga total en el complejo para que sea 2-.
Fórmula: [Zn (OH) 4] 2− - “hexacyano” = 6 ligandos de cianuro; dado que el cianuro es un ligando monodentado, tenemos un total de 6 enlaces al metal central.
Número de Coordinación: 6
Revisamos los fundamentos de la nomenclatura y vemos que “hexa” = 6 y “ciano” = CN -. Dado que la carga sobre Pd es 4+, que se da en la nomenclatura por los números romanos, podemos calcular la carga total en el complejo para que sea 2-.
Fórmula: [Pd (CN) 6] 2− - “dicloro” = 2 ligandos de cloruro; dado que el cloruro es un ligando monodentado, tenemos un total de 2 enlaces al metal central.
Número de Coordinación: 2
Revisamos los fundamentos de la nomenclatura y vemos que “di” = 2 y “cloro” = Cl -. Dado que la carga en Au es siempre 1+, podemos calcular la carga total en el complejo para que sea 1-.
Fórmula: [AUCl 2] − - “diammina” = 2 ligandos de amoníaco y “dicloro” = 2 ligandos de cloruro; ya que tanto los ligandos de amoníaco como de cloruro son monodentados, tenemos un total de 4 enlaces al metal central.
Número de Coordinación: 4
Revisamos los fundamentos de la nomenclatura y vemos que “di” = 2, “cloro” = Cl - y “ammine” = NH 3. Dado que la carga en Pt es 2+, que se da en la nomenclatura por los números romanos, podemos calcular que la carga total es 0, por lo que el complejo es neutro.
Fórmula: [Pt (NH 3) 2 Cl 2] - “diammina” = 2 ligandos de amoníaco y “tetracloro” = 4 ligandos de cloruro; ya que tanto los ligandos de amoníaco como de cloruro son monodentados, tenemos un total de 6 enlaces al metal central.
Número de Coordinación: 6
Revisamos los fundamentos de la nomenclatura y vemos que “di” = 2, “ammine” = NH 3, “tetra” = 4 y “cloro” = Cl -. Dado que la carga sobre el metal central, Cr, es 3+, que se da en la nomenclatura por los números romanos, podemos calcular que la carga total del complejo es 1-. El “potasio” al frente de la nomenclatura indica que es el catión correspondiente a este complejo aniónico.
Fórmula: K [Cr (NH 3) 2 Cl 4] - Ambos complejos metálicos tienen ligandos monodentados “hexa”, lo que significa que ambos tienen números de coordinación de 6.
Número de Coordinación: 6
Revisamos los fundamentos de la nomenclatura y vemos que “hexa” = 6, “ammine” = NH 3, y “ciano” = CN -. Dado que la carga sobre Cr es 3+ y Co es 3+, que se da en la nomenclatura por los números romanos, encontramos que las cargas de estos complejos se equilibran.
Fórmula: [Co (NH 3) 6] [Cr (CN) 6] - “dibromo” = 2 ligandos bromuro “bis (etilendiamina)” = 2 (en) ligandos; el bromuro es un ligando monodentado mientras que (en) es un ligando bidentado. Por lo tanto, tenemos un número de coordinación de 6.
Número de Coordinación: 6
Revisamos los fundamentos de la nomenclatura y vemos que “di” = 2, “bromo” = Br -, “bis” = 2, y “etilendiamina” = en. Dado que la carga sobre Co es 3+, que se da en la nomenclatura por los números romanos, encontramos que la carga total del complejo es 1+. El nitrato es el anión correspondiente a este complejo catiónico.
Fórmula: [Co (en) 2 Br 2] NO 3
A19.2.2
- 4, [Zn (OH) 4] 2−;
- 6, [Pd (CN) 6] 2−;
- 2, [AUCl 2] −;
- 4, [Pt (NH 3) 2 Cl 2];
- 6, K [Cr (NH 3) 2 Cl 4];
- 6, [Co (NH 3) 6] [Cr (CN) 6];
- 6, [Co (es) 2 Br 2] NO 3
Q19.2.3
Indique el número de coordinación para cada ion metálico en los siguientes compuestos:
- [Co (CO 3) 3] 3− (tenga en cuenta que el CO 3 2− es bidentado en este complejo)
- [Cu (NH 3) 4] 2+
- [Co (NH 3) 4 Br 2] 2 (SO 4) 3
- [Pt (NH 3) 4] [PtCl 4]
- [Cr (es) 3] (NO 3) 3
- [Pd (NH 3) 2 Br 2] (plano cuadrado)
- K 3 [Cu (Cl) 5]
- [Zn (NH 3) 2 Cl 2]
S19.2.3
Se puede determinar el número de coordinación de un compuesto en función de cuántos ligandos están unidos al átomo central.
1) En este compuesto, el Cobalto es el átomo central, y tiene 3 moléculas de CO 3 2- unidas a él. Sin embargo, el CO 3 2- es un ligando bidentado, lo que significa que se une al átomo central en dos lugares en lugar de uno. Esto significa que el número de coordinación de [Co (CO 3) 3] 3- es 6. Un número de coordinación de 6 significa que lo más probable es que la estructura sea octaédrica.
2) En este compuesto, el cobre es el átomo central. 4 moléculas de amoníaco están unidas a él. Esto significa que el número de coordinación es 4, y la estructura es probablemente tetraédrica.
3) Para este compuesto, podemos ignorar el (SO 4) 3 porque no está ligado al átomo central. El átomo central es el cobalto, y tiene 4 moléculas de amoníaco y 2 moléculas de bromo unidas a él. El número de coordinación es 6.
4) Aquí hay dos compuestos, indicados por los corchetes. El átomo central para ambos es el platino. Uno de ellos tiene 4 moléculas de amoníaco unidas, y el otro tiene 4 átomos de cloro unidos. Ambos complejos tienen un número de coordinación de 4.
5) Podemos ignorar (NO 3) 3 para este compuesto. El átomo central es el Cromo. Hay 3 moléculas de etilendiamina unidas al cromo. La etilendiamina es un ligando bidentado, por lo que el número de coordinación es 6.
6) El paladio es el átomo central. 2 moléculas de amoníaco y 2 átomos de bromo están unidos al átomo de paladio. El número de coordinación es 4.
7) Podemos ignorar la estructura K 3. El cobre es el átomo central, y hay 5 moléculas de cloro unidas a él. El número de coordinación es 5, por lo que la estructura es trigonal bipiramidal o piramidal cuadrada.
8) En este compuesto, el zinc es el átomo central. Hay 2 moléculas de amoníaco y 2 átomos de cloro unidos. Esto quiere decir que el número de coordinación es 4.
Q19.2.4
Esbozar las estructuras de los siguientes complejos. Indicar cualquier isómeros cis, trans y ópticos.
- [Pt (H 2 O) 2 Br 2] (plano cuadrado)
- [Pt (NH 3) (py) (Cl) (Br)] (plano cuadrado, py = piridina, C 5 H 5 N)
- [Zn (NH 3) 3 Cl] + (tetraédrico)
- [Pt (NH 3) 3 Cl] + (plano cuadrado)
- [Ni (H 2 O) 4 Cl 2]
- [Co (C 2 O 4) 2 Cl 2] 3− (tenga en cuenta que\(\ce{C2O4^2-}\) es el ion oxalato bidentado,\(\ce{−O2CCO2-}\))
S19.2.4
Cis y trans son un tipo de isómero geométrico, lo que significa que hay una diferencia en la orientación en la que los ligandos están unidos al metal central. En cis, dos de los mismos ligandos están adyacentes entre sí y en trans, dos de los mismos ligandos están directamente uno frente al otro.
Los isómeros ópticos → tienen la capacidad de rotar la luz, los isómeros ópticos también son quirales. Solo los complejos quirales tienen isómeros ópticos
Quiral → asimétrica, la estructura de su imagen especular no es superponible
Enantiómeros: isómeros ópticos quirales (el compuesto puede tener múltiples enantiómeros)
Complejo tetraédrico con 4 ligandos distintos → siempre quiral
- Para tetraédrico, si 2 ligandos son iguales, entonces no puede ser quiral, tiene un plano de simetría
Soluciones:
a.\([Pt(H_2O)_2Br_2]\) (plano cuadrado)
Este complejo tiene 2 tipos de ligandos. Los ligandos coincidentes pueden ser adyacentes entre sí y ser cis, o pueden estar cruzados entre sí y ser trans.
b.\([Pt(NH_3)(py)(Cl)(Br)]\) (plano cuadrado, py = piridina,\(C_5H_5N\))
Este complejo tiene 4 ligandos diferentes. No hay plano de simetría en ninguno de los enantiómeros, haciendo que las estructuras sean quirales y por lo tanto tenga isómeros ópticos.
c.\([Zn(NH_3)_3Cl]^+\) (tetraédrico)
Hay un plano de simetría de\(NH_3\) paso\(Zn\) a otro\(NH_3\), por lo tanto no es quiral.
d.\([Pt(NH_3)_3Cl]^+\) (plano cuadrado)
Hay un plano de simetría de\(NH_3\) paso\(Pt\) a otro\(NH_3\), por lo tanto no es quiral.
e.\([Ni(H_2O)_2Cl_2]\)
Los\(Cl\) ligandos pueden estar uno al lado del otro, o directamente uno frente al otro permitiendo geometrías cis y trans.
f.\([Co(C_2O_4)_2Cl_2]^-3\) (tenga en cuenta que\(C_2O_4^-2\) es el ion oxalato bidentado,\(^−O_2CCO_2^-\)
Hay un plano de simetría desde\(Cl\) el Co al otro\(Cl\) en una configuración de cloro “trans”, por lo que no es quiral en una configuración de cloro “trans”. Sin embargo, no hay simetría en la configuración de cloro “cis”, lo que indica múltiples isómeros “cis”.
A19.2.4
a. [Pt (H 2 O) 2 Br 2]:
b. [Pt (NH 3) (py) (Cl) (Br)]:
c. [Zn (NH 3) 3 Cl] +:
d. [Pt (NH 3) 3 Cl] +:

e. [Ni (H 2 O) 4 Cl 2]:
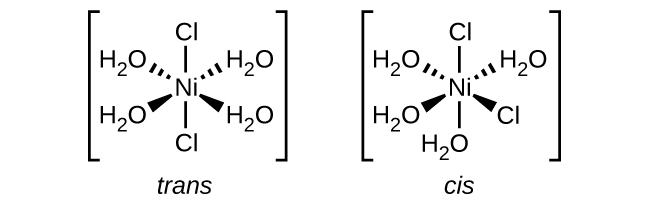
f. [Co (C 2 O 4) 2 Cl 2] 3−:
Q19.2.5
Dibuje diagramas para cualquier isomero cis, trans y optico que pueda existir para lo siguiente (en es etilendiamina):
- [Co (en) 2 (NO 2) Cl] +
- [Co (es) 2 Cl 2] +
- [Pt (NH 3) 2 Cl 4]
- [Cr (es) 3] 3+
- [Pt (NH 3) 2 Cl 2]
S19.2.5
Se nos instruye para dibujar todos los isómeros geométricos e isómeros ópticos para el compuesto especificado. Los isómeros ópticos existen cuando una configuración de isómero no se superpone en su imagen especular. Esto significa que hay dos formas moleculares distintas. A menudo se cita como ejemplo una mano izquierda y derecha; si tomaras tu mano derecha y la coloques sobre tu izquierda, no puedes hacer que las partes principales de tu mano se alineen una encima de la otra. La idea básica a la hora de decidir si algo es ópticamente activo es buscar un plano de simetría, si eres capaz de bisecar un compuesto de una manera que establezca simetría, entonces el compuesto no tiene un isómero óptico.
Los isómeros cis existen cuando hay 2 ligandos de la misma especie colocados en ángulos de 90 grados entre sí. Los isómeros trans existen cuando hay 2 ligandos de la misma especie colocados en ángulos de 180 grados entre sí.
Problema 1
Este compuesto es una molécula octaédrica, por lo que los seis ligandos (átomos en el complejo que no son el metal de transición central) se colocan alrededor del átomo central en ángulos de 90 grados. Existen dos isómeros ópticos para [Co (en) 2 (NO 2) Cl] +. El segundo isómero se dibuja tomando la imagen especular del primero.
Problema 2
Este compuesto también es una molécula octaédrica. Existen dos isómeros cis (ópticos) y un isómero trans para [Co (en) 2 Cl 2] +. El isómero trans se puede dibujar colocando los ligandos de cloro en posiciones donde forman un ángulo de 180 grados con el átomo central. El primer isómero cis se puede dibujar colocando los ligandos de cloro en posiciones donde forman un ángulo de 90 grados con el átomo central. El segundo isómero cis se puede encontrar reflejando el primer isómero cis, como hicimos en el problema 1.
Problema 3
Este compuesto también es una molécula octaédrica. Existen un isómero trans y un isómero cis de [Pt (NH 3) 2 Cl 4]. El isómero trans se puede dibujar colocando los ligandos de amoníaco en posiciones donde forman un ángulo de 180 grados con el átomo central. El isómero cis se puede dibujar colocando los ligandos de amoníaco en posiciones donde forman un ángulo de 90 grados con el átomo central.
Problema 4
Este compuesto también es una molécula octaédrica. Existen dos isómeros ópticos para [Cr (en) 3] 3+. El segundo isómero óptico se puede dibujar tomando la imagen especular del primer isómero óptico.
Problema 5
Este compuesto es un complejo plano cuadrado, por lo que los ligandos se colocan alrededor del átomo central en un plano, en 90 ángulos. Existen un isómero trans y un isómero cis para el complejo [Pt (NH 3) 2 Cl 2]. El isómero trans se puede dibujar colocando los ligandos de amoníaco en posiciones donde forman un ángulo de 180 grados en el plano con el átomo central. El isómero cis se puede dibujar colocando los ligandos de amoníaco en posiciones donde forman un ángulo de 90 grados en el plano con el átomo central.
Q19.2.6
Nombrar cada uno de los compuestos o iones dados en el Ejercicio Q19.2.3, incluyendo el estado de oxidación del metal.
S19.2.6
Reglas a seguir para los complejos de coordinación
1. Los cationes siempre se nombran antes que los aniones.
2. Los ligandos se nombran antes del átomo o ion metálico.
3. Los nombres de los ligandos se modifican con un ‐o agregado al nombre de la raíz de un anión. Para los ligandos neutros se usa el nombre de la molécula, con la excepción de OH2, NH3, CO y NO.
4. Los prefijos mono‐, di‐, tri‐, tetra‐, penta‐ y hexa‐ se utilizan para denotar el número de ligandos simples.
5. Los prefijos bis‐, tris‐, tetrakis‐, etc., se utilizan para ligandos más complicados o aquellos que ya contienen di‐, tri‐, etc.
6. El estado de oxidación del ion metálico central se designa con un número romano entre paréntesis.
7. Cuando hay más de un tipo de ligando presente, se nombran alfabéticamente. Los prefijos no afectan el orden.
8. Si el ion complejo tiene una carga negativa, se agrega el sufijo —ate al nombre del metal.
9. En el caso del isomerismo de iones complejos, los nombres cis, trans, fac o mer pueden preceder a la fórmula del nombre de iones complejos para indicar la disposición espacial de los ligandos. Cis significa que los ligandos ocupan posiciones de coordinación adyacentes, y trans significa posiciones opuestas tal como lo hacen para los compuestos orgánicos. La complejidad de los complejos octaédricos permite dos isómeros geométricos adicionales que son peculiares de los complejos de coordinación. Fac significa facial, o que los tres ligandos similares ocupan los vértices de una cara del octaedro. Mer significa meridional, o que los tres ligandos similares ocupan los vértices de un triángulo uno de cuyos lados incluye el átomo o ion metálico central.
A19.2.6
- ión tricarbonatocobaltato (III);
- ion tetraamina-cobre (II);
- sulfato de tetraaminodibromocobalto (III);
- tetracloroplatinato de tetraaminaplatino (II);
- nitrato de tris- (etilendiamina) cromo (III);
- diaminodibromopaladio (II);
- pentaclorocuprato de potasio (II);
- diaminediclorozinc (II)
Q19.2.7
Nombrar cada uno de los compuestos o iones dados en el Ejercicio Q19.2.5.
S19.2.7
Dado:
- [Co (en) 2 (NO 2) Cl] +
- [Co (es) 2 Cl 2] +
- [Pt (NH 3) 2 Cl 4]
- [Cr (es) 3] 3+
- [Pt (NH 3) 2 Cl 2]
Se busca:
Nombres de los compuestos anteriores.
1. [Co (en) 2 (NO 2) Cl] +
Paso 1: Obtener los nombres de los ligandos y catión metálico. Los nombres se pueden encontrar aquí.
Co: Cobalto
es: Etilendiamina
NO 2: Nitro
Cl: Cloro
Paso 2: Agregar los prefijos apropiados a cada ligando dependiendo del número. Los prefijos se pueden encontrar aquí.
(es) 2: bis (etilendiamina)
Paso 3: Encuentra las cargas de los ligandos. Los cargos se pueden encontrar aquí.
es: 0
NO 2: -1
Cl: -1
Paso 4: Alcanzar algebraicamente la carga del catión metálico usando la carga global del ion complejo y las cargas de ligando individuales.
Co + 2 (es) + (NO 2) + Cl = 1
Co +2 (0) + (-1) + (-1) = 1
Co = 3
Paso 5: Para el nombre colocar alfabéticamente los ligandos, los prefijos no deben contabilizarse, y usar números romanos para el catión metálico que debe colocarse al final.
Clorobis (etilendiamina) nitrocobalto (III)
2. [Co (es) 2 Cl 2] +
Paso 1: Obtener los nombres de los ligandos y catión metálico. Los nombres se pueden encontrar aquí.
Co: Cobalto
es: Etilendiamina
Cl: Cloro
Paso 2: Agregar los prefijos apropiados a cada ligando dependiendo del número. Los prefijos se pueden encontrar aquí.
(es) 2: bis (etilendiamina)
Cl 2: dicloro
Paso 3: Encuentra las cargas de los ligandos. Los cargos se pueden encontrar aquí.
es: 0
Cl: -1
Paso 4: Alcanzar algebraicamente la carga del catión metálico usando la carga global del ion complejo y las cargas de ligando individuales.
Co + 2 (es) +2 (Cl) = 1
Co + 2 (0) + 2 (-1) = 1
Co = 3
Paso 5: Para el nombre colocar alfabéticamente los ligandos, los prefijos no deben contabilizarse, y usar números romanos para el catión metálico que debe colocarse al final.
diclorobis (etilendiamina) cobalto (III)
3. [Pt (NH 3) 2 Cl 4]
Paso 1: Obtener los nombres de los ligandos y catión metálico. Los nombres se pueden encontrar aquí.
Pt: Platino
NH 3: Ammine
Cl: Cloro
Paso 2: Agregar los prefijos apropiados a cada ligando dependiendo del número. Los prefijos se pueden encontrar aquí.
(NH 3) 2: diammina
Cl 4: tetracloro
Paso 3: Encuentra las cargas de los ligandos. Los cargos se pueden encontrar aquí.
NH 3: 0
Cl: -1
Paso 4: Alcanzar algebraicamente la carga del catión metálico usando la carga global del ion complejo y las cargas de ligando individuales.
Pt + 2 (NH 3) + 4 (Cl) = 0
Pt + 2 (0) + 4 (-1) = 0
Pt = 4
Paso 5: Para el nombre colocar alfabéticamente los ligandos, los prefijos no deben contabilizarse, y usar números romanos para el catión metálico que debe colocarse al final.
Diaminetetracloroplatino (IV)
4. [Cr (es) 3] 3+
Paso 1: Obtener los nombres de los ligandos y catión metálico. Los nombres se pueden encontrar aquí.
Cr: Cromio
es: etilendiamina
Paso 2: Agregar los prefijos apropiados a cada ligando dependiendo del número. Los prefijos se pueden encontrar aquí.
(es) 3: tris (etilendiamina)
Paso 3: Encuentra las cargas de los ligandos. Los cargos se pueden encontrar aquí.
es: 0
Paso 4: Alcanzar algebraicamente la carga del catión metálico usando la carga global del ion complejo y las cargas de ligando individuales.
Cr + 3 (es) = 3
Cr + 3 (0) = 3
Cr = 3
Paso 5: Para el nombre colocar alfabéticamente los ligandos, los prefijos no deben contabilizarse, y usar números romanos para el catión metálico que debe colocarse al final.
Tris (etilendiamina) cromio (III)
5. [Pt (NH 3) 2 Cl 2]
Paso 1: Obtener los nombres de los ligandos y catión metálico. Los nombres se pueden encontrar aquí.
NH 3: Ammine
Cl: Cloro
Pt: Platino
Paso 2: Agregar los prefijos apropiados a cada ligando dependiendo del número.
(NH 3) 2: diammina
Cl 2: dicloro
Paso 3: Encuentra las cargas de los ligandos. Los cargos se pueden encontrar aquí.
NH 3: 0
Cl: -1
Paso 4: Alcanzar algebraicamente la carga del catión metálico usando la carga global del ion complejo y las cargas de ligando individuales.
Pt + 2 (NH 3) + 2 (Cl) = 0
Pt + 2 (0) + 2 (-1) = 0
Pt = 2
Paso 5: Para el nombre colocar alfabéticamente los ligandos, los prefijos no deben contabilizarse, y usar números romanos para el catión metálico que debe colocarse al final.
Diaminodicloroplatino (II)
A19.2.7
- Clorobis (etilendiamina) nitrocobalto (III)
- Diclorobis (etilendiamina) cobalto (III)
- Diaminetetracloroplatino (IV)
- Tris (etilendiamina) cromio (III)
- Diaminodicloroplatino (II)
Q19.2.8
Especificar si los siguientes complejos tienen isómeros.
- tetraédrico [Ni (CO) 2 (Cl) 2]
- bipiramidal trigonal [Mn (CO) 4 NO]
- [Pt (es) 2 Cl 2] Cl 2
S19.2.8
Los isómeros son compuestos que tienen el mismo número de átomos, pero tienen diferentes estructuras. Los isómeros estructurales (ligamiento, ionización, coordinación) y estereoisómeros (geométricos y ópticos) pueden ocurrir con varios compuestos.
1. tetraédrico\(\mathrm{[Ni(CO)_2(Cl)_2]}\)
(Fig. 1.) En este modelo, el níquel es el átomo central verde oscuro, los ligandos carbonilo son el átomo rosa y los ligandos cloro son los átomos de color verde claro.
De inmediato, podemos cancelar la posibilidad de isómeros de enlace, ionización y coordinación. No hay otros complejos de coordinación para el isomerismo de coordinación, no hay ningún ligando que pueda unirse al átomo de más de una manera para que presente isomería de ligamiento, y no hay iones fuera de la esfera de coordinación para isomería de ionización.
Se trata de una estructura tetraédrica que descarta inmediatamente cualquier isómero geométrico ya que requieren ángulos de enlace de 90° y/o 180°. Las estructuras tetraédricas tienen ángulos de 109.5°.
Para confirmar que la estructura no tiene isómero óptico, debemos determinar si existe un plano de simetría. Las estructuras que no tienen plano de simetría se consideran quirales y tendrían isómeros ópticos.
(Fig. 2.) Podemos rotar la estructura y encontrar que efectivamente existe un plano de simetría a través de los dos ligandos cloro y el átomo central y entre los ligandos carbonilo.
Dado que existe un plano de simetría, podemos concluir que no hay isómeros ópticos.
En general, no existen isómeros para este compuesto.
2. trigonal byprimidal\(\mathrm{[Mn(CO)_4(NO)]}\)
(Fig. 3.) El átomo púrpura central es manganeso, los ligandos carbonilo son los átomos rosados, y el ligando nitrosil es el átomo de fucía.
No hay iones, otros complejos de coordinación y ligandos ambidentados. Por lo tanto, no existen isómeros estructurales para esta estructura.
No existen isómeros geométricos para este compuesto porque solo hay un ligando nitrosil.
(Fig. 4.) La línea discontinua bisecta la molécula y muestra el plano de simetría. La molécula se gira en esta imagen.
En la imagen de arriba, una vez girada la estructura, podemos ver que hay un plano de simetría. Así, no hay isómeros ópticos.
No existen isómeros (los mencionados anteriormente) para este compuesto.
3. \(\mathrm{[Pt(en)_{2}Cl_2]Cl_2}\)
(Fig. 5.) Los átomos verdes son los ligandos de cloro, el átomo central es platino y los átomos gris/azules son ligandos de etildiamina.
El isomerismo de coordinación no puede existir para este complejo porque no hay otros complejos. No hay isómeros de enlace porque no hay ligandos ambidentados. Los isómeros de ionización tampoco pueden existir en este complejo, a pesar de que hay una molécula neutra fuera de la esfera de coordinación. Si intercambiamos\(\mathrm{Cl_2}\) con una molécula de etildiamina, Habría 5 ligandos en la esfera de coordinación en lugar de 4. Esta diferencia en la relación de átomo de metal a ligandos significa que no puede existir un isómero de ionización.
(Fig. 6.) Aquí, un ligando de cloro intercambió lugares con la etildiamina para que pueda estar en un ángulo de 90° con el otro ligando de cloro.
La imagen de arriba, muestra los ligandos cloro y etildiamina en un ángulo de 90° con su otro ligando idéntico. Este es el isómero cis, mientras que la Fig. 5 muestra el isómero trans.
La Fig. 5 muestra que existe un plano de simetría en el isómero trans. Por lo tanto, esa estructura no tiene un isómero óptico. Por otro lado, el isómero cis no tiene un plano de simetría y por lo tanto tiene un isómero óptico.
A19.2.8
ninguno; ninguno; Los dos ligandos Cl pueden ser cis o trans. Cuando son cis, también habrá un isómero óptico.
Q19.2.9
Predecir si el ligando carbonato\(\ce{CO3^2-}\) se coordinará con un centro metálico como un ligando monodentado, bidentado o tridentado.
S19.2.9
\(\ce{CO3^2−}\)puede ser monodentado o bidentado, ya que dos de sus átomos de oxígeno tienen pares solitarios como se muestra anteriormente y pueden formar enlaces covalentes con un ion de metal de transición. En la mayoría de los casos el carbonato es monodentado debido a su geometría plana trigonal (hay 120 grados entre los oxígenos por lo que es difícil que ambos se unan al mismo metal). Sin embargo, en algunos casos se unirá a dos metales diferentes, haciéndolo bidentado.
A19.2.9
El CO 3 -2 se coordinará con un centro metálico como ligando monodentado.
Q19.2.10
Dibuje los isómeros geométricos, de enlace e ionización para [CoCl 5 CN] [CN].
S19.2.10
Los isómeros son compuestos con la misma fórmula pero diferente disposición de los átomos. Hay dos subcategorías: isómeros estructurales, que son isómeros que contienen el mismo número de átomos de cada tipo pero difieren en qué átomos están unidos entre sí, y estereoisómeros, isómeros que tienen la misma fórmula molecular y ligandos, pero difieren en la disposición de aquellos ligandos en el espacio 3D.
Hay tres subcategorías bajo isómeros estructurales: isómeros de ionización, que son isómeros que son idénticos a excepción de que un ligando tiene lugares de intercambio con un anión o molécula neutra que originalmente estaba fuera del complejo de coordinación; isómeros de coordinación, isómeros que tienen un intercambio de algunos ligandos de la parte catiónica a la parte aniónica; e isómeros de enlace, en dos o más compuestos de coordinación en los que el átomo donante de al menos uno de los ligandos es diferente.
También hay dos tipos principales de estereoisómeros: isómeros geométricos, complejos metálicos que difieren solo en los que los ligandos son adyacentes entre sí (cis) o directamente uno frente al otro (trans) en la esfera de coordinación del metal, e isómeros ópticos, que ocurre cuando el espejo imagen de un objeto no es superponible sobre el objeto original.
Algunos de los isómeros parecen casi idénticos, pero eso se debe a que el ligando CN puede estar unido por ambos (pero no al mismo tiempo) el C o N.
A19.2.10

19.3: Propiedades espectroscópicas y magnéticas de los compuestos de coordinación
Q19.3.1
Determinar el número de electrones desapareados esperados para [Fe (NO 2) 6] 3− y para [FeF 6] 3− en términos de teoría de campos cristalinos.
S19.3.1
- La teoría del campo cristalino es un modelo que describe la ruptura de las degeneraciones de los estados orbitales electrónicos, generalmente orbitales d o f, debido a un campo eléctrico estático producido por una distribución de carga circundante.
- Los orbitales d degenerados se dividieron en dos niveles,\(_{g}\) e y t\(_{2g}\), en presencia de ligandos.
- La diferencia de energía entre los dos niveles se llama la energía de división de campo de cristal,\(\Delta_{\circ}\).
- Después de que 1 electrón cada uno haya sido llenado en los tres\(_{2g}\) orbitales t, el llenado del cuarto electrón se lleva a cabo ya sea en el\(_{g}\) orbital e o en el t\(_{2g}\), donde los electrones se emparejan. dependiendo de si el complejo es de espín alto o de espín bajo.
- Si el\(\Delta_{\circ}\) valor de un ligando es menor que la energía de emparejamiento (P), entonces los electrones ingresan al\(_{g}\) orbital e, pero si el\(\Delta_{\circ}\) valor de un ligando es mayor que la energía de emparejamiento (P), entonces los electrones ingresan al\(_{2g}\) orbital t.
- cuando el
es menor que la energía de emparejamiento, los electrones prefieren entonces e g orbitales porque no hay suficiente energía para emparejar los electrones juntos. Será alto giro
- cuando el
es más que la energía de emparejamiento, los electrones prefieren el t 2g porque hay suficiente energía para emparejar los electrones. Será bajo giro.
Paso 1: Determinar el estado de oxidación del Fe
Para\([Fe(NO_{2}){_{6}}]^{3-}\) y\([FeF_{6}]^{3-}\), ambos\(NO_{2}\) y\(F_{6}\) tienen un cargo de -1. Ya que hay 6 de ellos entonces eso significa que la carga es -6 y para que haya una carga general de -3, Fe tiene que tener una carga +3.
Paso 2: Determinar el tipo de ligando
Con base en la serie espectroquímica podemos ver que\(NO_{2}^{-}\) es un ligando de campo más fuerte que F\(^{-}\), y por lo tanto es un complejo de espín bajo porque tiene un alto\(\Delta_{\circ}\) a diferencia de F\(^{-}\) que es un espín alto.
Paso 3: Dibuja el campo de cristal
\([Fe(NO_{2}){_{6}}]^{3-}\)
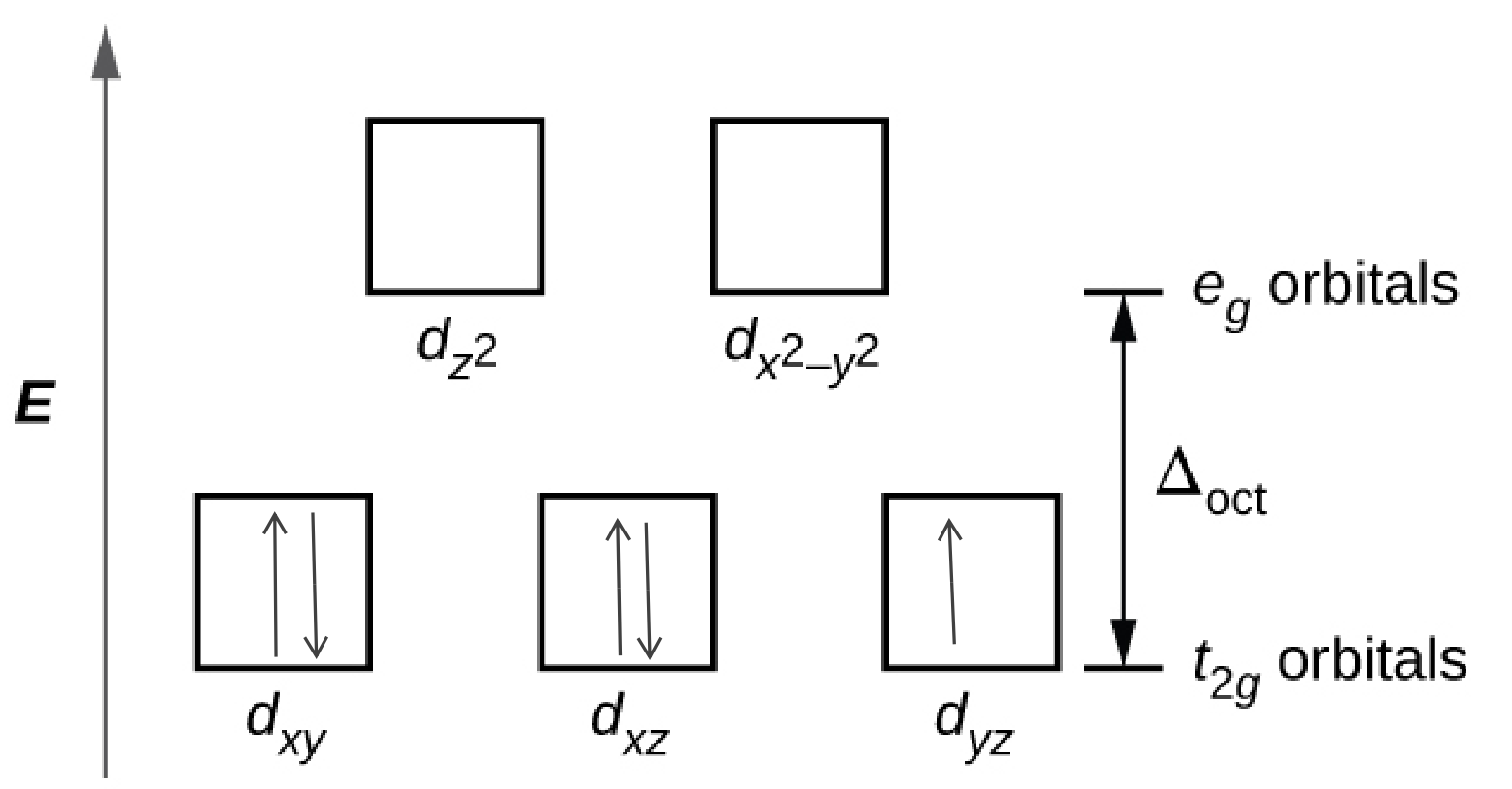
\([FeF_{6}]^{3-}\)
Hay 1 electrón desapareado para\([Fe(NO_{2}){_{6}}]^{3-}\), y 5 para\([FeF_{6}]^{3-}\) basado en la teoría del campo cristalino.
A19.3.1
[Fe (NO 2) 6] 3−:1 electrón
[FeF 6] 3−:5 electrones
Q19.3.2
Dibuje los diagramas de campo de cristal para [Fe (NO 2) 6] 4− y [FeF 6] 2−. Indica si cada complejo es de espín alto o de espín bajo, paramagnético o diamagnético, y compara Δ oct con P para cada complejo.
S19.3.2
a)\[[Fe(NO_2)_6]^{_{-4}}\]
- NO 2 - tiene un cargo -1. El ion total tiene una carga -4, por lo tanto Fe debe ser +2 de carga. (La matemática: \(x+(6)(-1)=-4, x+-6=-4, x=+2\)o 2+ (6*-1) =-4)
- Fe 2+ tiene 6 electrones de valencia.
- A continuación nos fijamos en el ligando unido al Fe, que es NO 2 -. Basado en la Serie espectroquímica, NO 2 - es un ligando de campo fuerte lo que significa que tiene un DELTA grande o gran energía de división en comparación con la energía de emparejamiento, P. Entonces los electrones preferirían emparejarse, ya que toma la menor cantidad de energía.
- Entonces [Fe (NO 2) 6] 4− es de bajo giro.
- Todos los 6 electrones están emparejados, por lo que es diamagnético.
b)\[[FeF_6]^{_{-3}}\]
- F - tiene un cargo -1. El ion global tiene una carga -3, por lo tanto Fe debe ser +3 de carga. (La matemática: \(x+(-1)(6)=-3, x+-6=-3, x=+3\)o 3+ (6*-1) =-3)
- F 3 + tiene 5 electrones de valencia.
- A continuación nos fijamos en el ligando unido al Fe, que es F -. Basado en la Serie Espectroquímica, F - es un ligando de campo débil, lo que significa que tiene un DELTA pequeño o una pequeña energía de división en comparación con la energía de emparejamiento, P. Entonces los electrones preferirían dividirse y subir al nivel de energía más alto, en lugar de emparejarse, ya que toma el menor cantidad de energía.
- Entonces [Fe (NO 2) 6] 4− es alto giro.
- [FeF 6] 3− es paramagnético porque tiene electrones desapareados.
A19.3.2
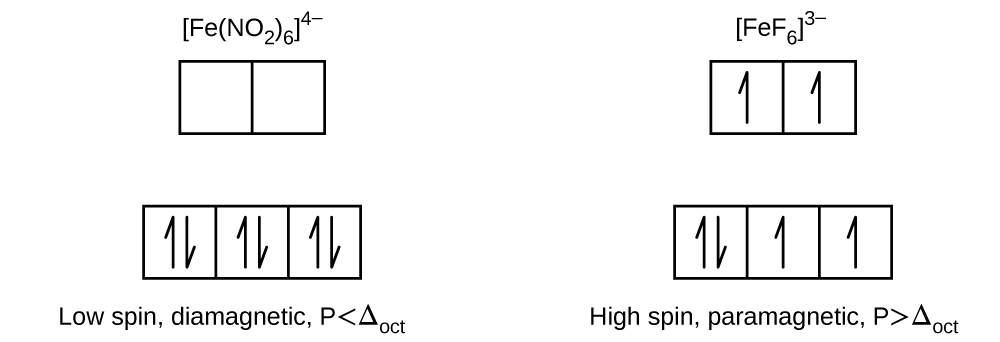
Q19.3.3
Dar el estado de oxidación del metal, el número de electrones d y el número de electrones desapareados predicho para [Co (NH 3) 6] Cl 3.
S19.3.3
El estado de oxidación del metal se puede encontrar identificando la carga de una de cada molécula en el compuesto coordinado, multiplicando la carga de cada molécula por el número respectivo de moléculas presentes y agregando los productos. Esta suma final representa la carga del complejo de coordinación general. Luego se puede resolver el estado de oxidación del metal algebraicamente. En este caso, un anión cloruro Cl - tiene una carga de -1. Por lo que tres aniones cloruro tienen una carga total de -3. Un ligando de amina NH 3 no tiene carga por lo que seis ligandos de amina tienen una carga total de cero. Finalmente, estamos tratando de resolver el estado de oxidación de un ion cobalto. Ahora podemos escribir la ecuación que suma las cargas totales de cada molécula o ion y es igual a la carga total del compuesto de coordenadas generales.
\[ (\text{oxidation}\text{ state}\text{ of}\text{ Co})+(-3)+0=0 \]
\[ \text{oxidation}\text{ state}\text{ of}\text{ Co}=+3 \]
Por lo que el estado de oxidación del Co es +3. Ahora necesitamos identificar el número de electrones d en el ion Co 3+. La configuración de electrones para cobalto que no tiene carga es
\[ [\text{Ar}]4\text{s}^23\text{d}^7 \]
Sin embargo, un ion Co 3+ tiene 3 electrones menos que su contraparte neutra y tiene una configuración de electrones de
\[ [\text{Ar}]3\text{d}^6 \]
Para los metales de transición,\( \text{s} \) los electrones se pierden primero. Entonces el cobalto pierde primero sus dos\( 4\text{s} \) electrones y luego pierde un solo\( 3\text{d} \) electrón, lo que significa que el ion Co 3+ tiene 6\( \text{d} \) electrones. Para predecir el número de electrones desapareados, primero debemos determinar si el complejo es de espín alto o de espín bajo. Si el complejo es espín alto o espín bajo está determinado por el ligando en el complejo de coordenadas. Específicamente, el ligando debe identificarse como un ligando de campo débil o un ligando de campo fuerte basado en la serie espectroquímica. Los ligandos de campo débil inducen espín alto mientras que los ligandos de campo fuerte inducen espín bajo. Luego podemos construir el diagrama de energía o diagrama de campo de cristal del espín designado que tiene la colocación de electrones adecuada. También se debe identificar la forma geométrica del compuesto para construir el diagrama correcto. Finalmente, a partir de este diagrama de campo cristalino podemos determinar el número de electrones desapareados. El número de electrones en el diagrama es igual al número de\( \text{d} \) electrones del metal. El ligando en este caso es NH 3, que es un ligando de campo fuerte según la serie espectroquímica. Esto significa que el complejo es de bajo giro. Adicionalmente, seis ligandos monodentados significan que el campo del ligando es octaédrico. El número de electrones que estarán en el diagrama es de 6 ya que el ion metálico Co 3+ tiene 6\( \text{d} \) electrones. Ahora se puede construir el diagrama de campo de cristal adecuado.
.jpg)
Del diagrama de campo cristalino, podemos decir que el complejo no tiene electrones desapareados.
A19.3.3
a) 3+
b) 6 d electrones
c) Sin electrones desapareados
Q19.3.4
El sólido sólido anhidro CoCl 2 es de color azul. Debido a que absorbe fácilmente el agua del aire, se utiliza como indicador de humedad para monitorear si el equipo (como un celular) ha estado expuesto a niveles excesivos de humedad. Predecir qué producto se forma por esta reacción, y cuántos electrones desapareados tendrá este complejo.
S19.3.4
A partir de nuestro conocimiento de ligandos y compuestos de coordinación (o si necesita un repaso Compuestos de Coordinación), podemos asumir el producto de CoCl 2 en agua. H 2 O es un ligando común de campo débil que forma seis enlaces de ligando alrededor del átomo central de Cobalto mientras que el Cloruro permanece en la esfera externa. Podemos usar esto para determinar el complejo:
\([Co(H_2O)_6]Cl_2\)
A partir de esta formación, podemos utilizar la Teoría del Campo de Cristal (CFT) (Teoría del Campo de Cristal) para determinar el número de electrones desapareados. Este compuesto de coordinación tiene seis enlaces ligando unidos al átomo central, lo que significa que el modelo CFT seguirá la división octaédrica. Tenga en cuenta que sabemos que H 2 O es un ligando de campo débil y producirá un giro alto. El alto giro es cuando la energía de emparejamiento de electrones (P) es mayor que la energía de división octaédrica. Así, los electrones se dispersan y maximizan el giro.
Para poder llenar nuestro diagrama de campo cristalino, necesitamos determinar la carga de cobalto. Debido a que el ligando H 2 O es neutro, y hay dos iones cloro, podemos deducir que la carga de cobalto es más dos para hacer neutro el complejo de coordinación. A partir de aquí, podemos utilizar la configuración electrónica de Co 2+ es [Ar] 4s 2 3d 7. Los electrones que se quitan del átomo de cobalto para formar la carga más dos saldrán del orbital 4s y dejarán intacto el orbital 3d. Así, habrá 7 electrones en el diagrama del campo cristalino y aparecerán como:
Podemos ver aquí que hay 3 electrones desapareados.
A19.3.4
[Co (H 2 O) 6] Cl 2 con tres electrones desapareados.
Q19.3.5
¿Es posible que un complejo de un metal en la serie de transición tenga seis electrones desapareados? Explique.
A19.3.5
¿Es posible que un complejo de un metal en la serie de transición tenga seis electrones desapareados? Explique.
No es posible que un metal en la serie de transición tenga seis electrones desapareados. Esto se debe a que los metales de transición tienen una configuración electrónica general de (n-1) d 1-10 ns 1-2 donde n es el número cuántico. El último electrón entrará en el orbital d que tiene 5 orbitales que pueden contener cada uno 2 electrones, produciendo 10 electrones en total. Según la regla de Hund, los electrones prefieren llenar cada orbital individualmente antes de emparejarse. Esto es más favorable energéticamente. Dado que solo hay 5 orbitales y debido a la Regla de Hund, el número máximo de electrones desapareados que puede tener un metal de transición es de 5. Por lo tanto, no puede haber un complejo de un metal de transición que tenga 6 electrones desapareados.
Por ejemplo, veamos la configuración electrónica del hierro. El hierro tiene una configuración electrónica de 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6. Ahora el orbital más importante a observar es el orbital d que tiene 6 electrones en él, pero solo hay 4 electrones desapareados como puede ver en este diagrama:
3d: [] [] [] [] []
Cada [] representa una órbita dentro de la órbita d. Este diagrama sigue la regla de Hund y muestra por qué ningún metal de transición puede tener 6 electrones desapareados.
Q19.3.6
¿Cuántos electrones desapareados están presentes en cada uno de los siguientes?
- [CoF 6] 3− (giro alto)
- [Mn (CN) 6] 3− (centrifugado bajo)
- [Mn (CN) 6] 4− (centrifugado bajo)
- [MnCl 6] 4− (alto giro)
- [rHCl 6] 3− (centrifugado bajo)
S19.3.6
1. Para [CoF 6] 3-, primero encontramos el estado de oxidación del Co, que es 3+ ya que F tiene una carga 1- y como hay 6 F, la carga de Co tiene que ser 3+ para que la carga total sea 3-.
\[\textrm{charge of Co} + \textrm{-6} = \textrm{-6}\]\[\textrm{charge of Co} = \textrm{+3}\]
Después de encontrar el estado de oxidación, luego voy a la tabla periódica para encontrar su configuración electrónica: [Ar] 3d 6
Distribuimos los 6 electrones d-orbitales a lo largo del complejo y como es de alto giro, los electrones se distribuyen una vez en cada nivel de energía antes de ser emparejados. Sólo hay un par y los otros 4 electrones están desapareados, haciendo que la respuesta sea 4.

2. Se repite el mismo proceso. Encontramos la carga de Mn, que es 3+, haciendo la configuración electrónica: [Ar] 3d 4
\[\textrm{charge of Mn} + \textrm{-6} = \textrm{-3}\]\[\textrm{charge of Mn} = \textrm{+3}\]
Hay una diferencia entre este y el número 1. Este es un giro bajo así que en lugar de distribuir un electrón en cada nivel antes de emparejarlo, debo distribuir un electrón en la parte inferior y luego emparejarlos todos antes de poder moverme a la porción superior. Entonces como hay 4, solo hay un par en d yz y los otros dos electrones están desapareados. Haciendo el número de electrones desapareados 2.
3.Se aplica el mismo proceso que el número 2. La única diferencia es que la carga de Mn es ahora 2+ por lo que la configuración electrónica: [Ar] 3d 5.
\[\textrm{charge of Mn} + \textrm{-6} = \textrm{-4}\]\[\textrm{charge of Mn} = \textrm{+2}\]
Ya que es de bajo giro como el número 2, solo necesito agregar un electrón extra al siguiente nivel, haciendo que 2 pares de electrones y solo 1 electrón estén desapareados.

4. Dado que Cl tiene una carga -1 como CN, la carga de Mn también es 2+ con la misma configuración de electrones que el número 3, que es 5.
\[\textrm{charge of Mn} + \textrm{-6} = \textrm{-4}\]\[\textrm{charge of Mn} = \textrm{+2}\]
Con 5 electrones, este es un giro alto en lugar de bajo. Entonces, como se afirma en el número 1, emparejamos primero distribuimos los electrones en todos los niveles. Ya que hay 5 electrones y 5 niveles y están al distribuidos, hay cero pares, lo que hace que sean 5 electrones desapareados.

5. Usando el mismo proceso que los problemas anteriores, la carga de Rh es 3+, con la configuración electrónica: [Kr] 4d 6.
\[\textrm{charge of Rh} + \textrm{-6} = \textrm{-3}\]\[\textrm{charge of Mn} = \textrm{+3}\]
Con un giro bajo y 6 electrones, todos los electrones están emparejados, lo que lo convierte en 0 electrones que están desapareados.

A19.3.6
4; 2; 1; 5; 0
Q19.3.7
Explique cómo el ion difosfato, [O 3 P−O−PO 3] 4−, puede funcionar como un ablandador de agua que evita la precipitación de Fe 2+ como una sal de hierro insoluble.
S19.3.7
El ion difosfato, [O 3 P−O−PO 3] 4− puede funcionar como un ablandador de agua manteniendo el hierro en una forma soluble en agua debido a su potencial electroquímico más negativo que el agua. Esto es similar a la forma en que el chapado evita que los metales reaccionen con el oxígeno para corroerse.
Los depósitos minerales se forman por reacciones iónicas. El Fe 2+ formará una sal de hierro insoluble de óxido-hidróxido de hierro (III) cuando una sal de hierro férrico hidroliza agua. Sin embargo, con la adición de [O 3 P−O−PO 3] 4−, los cationes Fe 2+ se sienten más atraídos por el grupo PO 3, formando un complejo Fe (PO 3).
El exceso de minerales en este tipo de agua se considera duro de ahí su nombre agua dura.
Q19.3.8
Para complejos del mismo ion metálico sin cambio en el número de oxidación, la estabilidad aumenta a medida que aumenta el número de electrones en los orbitales t 2 g. ¿Qué complejo en cada uno de los siguientes pares de complejos es más estable?
- [Fe (H 2 O) 6] 2+ o [Fe (CN) 6] 4−
- [Co (NH 3) 6] 3+ o [CoF 6] 3−
- [Mn (CN) 6] 4− o [MnCl 6] 4−
S19.3.8
La serie espectroquímica es la siguiente\[I^{-}<Br^{-}<SCN^{-}\approx Cl^{-}<F^{-}<OH^{-}<ONO^{-}<ox<H_{2}O<SCN^{-}<EDTA<NH_{3}<en<NO_{2}^{-}<CN\]
Los ligandos de campo fuerte (a la derecha) son de bajo giro que rellena más electrones en los orbitales t 2 g. Los ligandos de campo débil (a la izquierda) son de alto espín por lo que pueden llenar electrones en los orbitales t 2 g y orbitales e g. En conclusión, se llenan más electrones de los ligandos de campo fuerte porque los electrones no se mueven hasta los orbitales e g.
a.\([Fe(CN)_{6}]^{4-}\)
\(CN\)es un ligando más fuerte que\(H_{2}O\) por lo que es de espín bajo, que llena los orbitales t 2 g.
b.\([Co(NH_{3})_{6}]^{3+}\)
\(NH_{3}\)es un ligando más fuerte que\(F\).
c.\([Mn(CN)_{6}]^{4-}\)
\(CN\)es un ligando más fuerte que\(Cl^{-}\).
Para obtener más información sobre la forma del complejo y la configuración de electrones d, el libretexto proporciona más información sobre cómo clasificar los complejos de espín alto y bajo.
A19.3.8
[Fe (CN) 6] 4−; [Co (NH 3) 6] 3+; [Mn (CN) 6] 4−
Q19.3.9
La trimetilfosfina, P (CH 3) 3, puede actuar como ligando donando el par solitario de electrones en el átomo de fósforo. Si se agrega trimetilfosfina a una solución de cloruro de níquel (II) en acetona, se puede aislar un compuesto azul que tiene una masa molecular de aproximadamente 270 g y contiene 21.5% Ni, 26.0% Cl y 52.5% P (CH 3) 3. Este compuesto azul no tiene ninguna forma isomérica. ¿Cuáles son la geometría y la fórmula molecular del compuesto azul?
S19.3.9
1) Encontrar la fórmula empírica. Hay un total de 270 gramos. Para saber cuántos gramos de cada elemento/compuesto hay, multiplica el porcentaje por la masa (270).
\[(270g)(0.215)=58.05gNi\]
\[(270g)(0.26)=70.2gCl\]
\[(270g)(0.525)=141.75gP(CH_3)_3\]
Ahora que tenemos los gramos de cada elemento/compuesto, podemos convertirlos en moles usando su masa molar.
\[(58.055gNi)(\frac{1mol.}{58.69gNi})=0.989mol.Ni\]
\[(70.2gCl)(\frac{1mol.}{35.45gCl})=1.98mol.Cl\]
\[(141.75gP(CH_3)_3)(\frac{1mol.}{76.07gP(CH_3)_3})=1.86mol.P(CH_3)_3\]
Ahora que tenemos los moles de todos los elementos/compuestos, podemos encontrar la proporción de todos ellos entre sí. Para ello, tomamos el elemento/compuesto con la menor cantidad de moles y dividimos todos los moles de elemento/compuesto por esta cantidad. En este caso, Ni tiene el menor número de moles.
\[\frac{0.989mol.Ni}{0.989mol.Ni}=1\]
\[\frac{1.98mol.Cl}{0.989mol.Ni}=approx.2\]
\[\frac{1.86mol.P(CH_3)_3}{0.989mol.Ni}=approx.2\]
Ahora conocemos la relación de todos los elementos/compuestos en el compuesto azul.
La fórmula empírica es: NiCl (P (CH 3) 3) 2
Esta fórmula nos muestra que hay 4 ligandos. Hay 2 ligandos de cloro y 2 ligandos de trimetilfosfina. Esto significa que el compuesto azul tiene una forma tetraédrica o plana cuadrada, donde las formas tetraédricas son capaces de diferentes formas isoméricas cuando todos los ligandos son diferentes (porque si no, solo hay 1 forma para que se dispongan), y las formas planas cuadradas son capaces de formas cis/trans. En el problema, afirma que este compuesto no tiene ninguna forma isomérica, por lo tanto este tiene una forma tetraédrica.
A19.3.9
a) NiCl (P (CH 3) 3) 2
b) Tetraédrico
Q19.3.10
¿Esperarías que el complejo [Co (en) 3] Cl 3 tenga electrones desapareados? ¿Algún isómeros?
S19.3.10
Asignar estados de oxidación a cada elemento. Cl- tiene un estado de oxidación -1. En es neutral, por lo que 0. Todo el complejo también es neutro, por lo que para equilibrar las cargas, el Co debe ser +3 porque hay 3 cloruros, lo que da una carga -3.
PASO 2:
Escriba la configuración electrónica para\(Co^{3+}\). \([Ar]3d^6\). Hay 6 electrones.
PASO 3:
Compruebe dónde se encuentra en la serie espectroquímica. ¿Tiene una fuerte fuerza de campo? Lo hace, por lo que estos electrones existirán en el nivel d con alta energía de división porque la magnitud de la energía de emparejamiento es menor que la energía de división del campo cristalino en el campo octaédrico.
Te darás cuenta de que no hay electrones desapareados cuando dibujas el diagrama de la Teoría del Campo de Cristal (CFT).
Este complejo no tiene isómeros geométricos debido a que no se pueden formar estructuras cis-trans. La imagen especular es no superimpoasable, lo que significa que los enantiómeros son moléculas quirales; si la imagen especular se coloca encima de la molécula original, entonces nunca estarán perfectamente alineados para dar la misma molécula.
A19.3.10
El complejo no tiene electrones desapareados. El complejo no tiene isómeros geométricos, pero la imagen especular no es superponible, por lo que tiene un isómero óptico.
Q19.3.11
¿Esperarías que el Mg 3 [Cr (CN) 6] 2 sea diamagnético o paramagnético? Explica tu razonamiento.
S19.3.11
El primer paso para determinar el magnetismo del complejo es calcular el estado de oxidación del metal de transición. En este caso, el metal de transición es Cr.
Antes de hacerlo, necesitamos encontrar carga del del ion complejo [Cr (CN) 6] 2 dado que el estado de oxidación del Mg 3 es 2+. Usando los subíndices del\(\displaystyle Mg^{2+}\) ion y el complejo [Cr (CN) 6] 2, encontramos que el estado de oxidación de [Cr (CN) 6] 2, x, es:
\(\displaystyle 3(+2)+2(x)=0\)
\(\displaystyle x=3\)
Ahora que encontramos la carga del complejo de coordinación, podemos encontrar la carga del metal de transición Cr dado que la carga de CN es -1. Nuevamente, usando los subíndices encontramos que el estado de oxidación de Cr, y, es:
\(\displaystyle y + 6(-1)=-3\)
\(\displaystyle y=3\)
Por lo tanto, el estado de oxidación del metal de transición Cr es\(\displaystyle Cr^{3+}\)
A continuación, utilizando el metal de transición\(\displaystyle Cr^{3+}\) y la tabla periódica como referencia, podemos determinar la configuración electrónica de\(\displaystyle Cr^{3+}\) ser\(\displaystyle [Ar]d^{3}\). Esto significa que\(\displaystyle Cr^{3+}\) tiene 3 electrones desapareados en el subnivel 3d. Por lo tanto, encontramos que dado que al menos un electrón está desapareado (en este caso los 3 electrones están desapareados), Mg 3 [Cr (CN) 6] 2 es paramagnético.
A19.3.11
a) Paramagnético
Q19.3.12
¿Esperarías que las sales del ion oro, Au +, sean coloreadas? Explique.
S19.3.12
No. Los iones coloreados tienen electrones desapareados en su orbital más externo. Un orbital d parcialmente lleno, por ejemplo, puede producir varios colores. Después de completar la configuración de gas noble, vemos que Au + tiene una configuración de [Xe] 4f 14 5d 10. Dado que Au + tiene un subnivel d completamente lleno, estamos seguros de que cualquier sal del ion oro, Au + será incolora.
*Un ejemplo de un ion coloreado sería el cobre (II). Cu 2+ tiene una configuración electrónica de [Ar] 3d 9. Tiene un electrón desapareado. El cobre (II) aparece azul.
A19.3.12
No. Au + tiene un subnivel completo de 5 d.
Q19.3.13
[CuCl 4] 2− es verde. [Cu (H 2 O) 6] 2+ es azul. ¿Cuál absorbe fotones de mayor energía? ¿Cuál se prevé que tenga una división de campo de cristal más grande?
S19.3.13
Aunque un color pueda aparecer de cierta manera, en realidad absorbe un color diferente, opuesto a él en la rueda de colores. 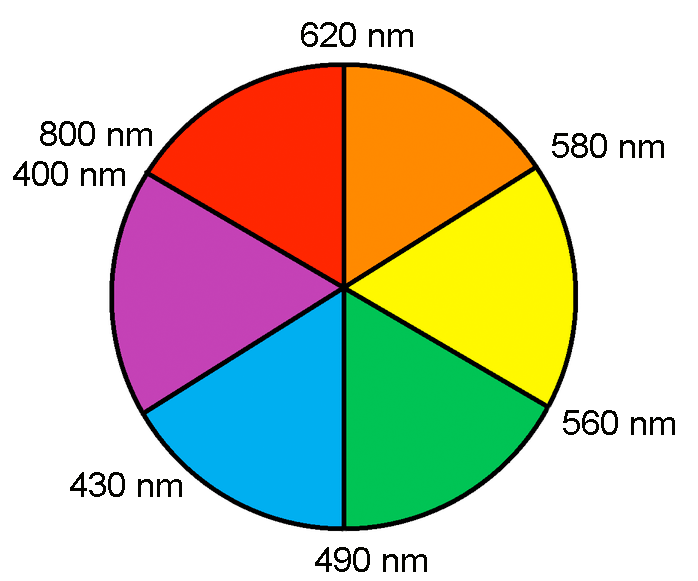
En este caso;
[CuCl 4] 2- aparece verde pero es opuesto al rojo en la rueda de color que se absorbe y se caracteriza por longitudes de onda 620-800 nanómetros.
[Cu (H 2 O) 6] 2+ aparece azul pero es opuesto al naranja en la rueda de color que se absorbe y se caracteriza por longitudes de onda 580-620 nanómetros.
Al determinar cuál absorbe los fotones de mayor energía, hay que mirar el complejo mismo. Una mayor energía indica un fotón de alta energía absorbido y una energía menor indica un fotón de menor energía absorbido. ¿Cómo podemos determinar esto? Al observar el complejo y más específicamente el ligando unido y su ubicación en la serie espectroquímica.
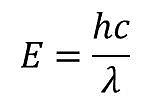

Los ligandos unidos son Agua y Cloro y dado que el Agua es un ligando más fuerte que el Cloro según la serie, también tiene mayor energía, lo que indica una mayor energía. Esto significa que el complejo [Cu (H 2 O) 6] 2+ absorbe un fotón de mayor energía debido a su ligando más fuerte que el cloro.
La parte 2 de esta pregunta también plantea qué complejo se prevé que tenga una división de campo de cristal más grande. Para determinar esto también se utiliza la serie espectroquímica y ver qué ligando es más fuerte. Dado que H 2 O es más fuerte que Cl - en la serie espectroquímica, podemos decir que [Cu (H 2 O) 6] 2+ tiene una mayor división del campo cristalino.
A19.3.13
a) [Cu (H 2 O) 6] 2+
b) [Cu (H 2 O) 6] 2+ tiene una división de campo de cristal más alta



