11.1: Absorción de Luz
- Page ID
- 81112
Introducción
La división orbital d en los complejos de coordinación resulta en un gap (\(\Delta\)) que resulta ser de la magnitud correcta para absorber la luz visible. Debido a que los complejos metálicos pueden absorber la luz visible, muestran una variedad de colores. No sólo el color es atractivo a la vista, es una indicación de las propiedades químicas y físicas del complejo metálico. El color (como la magnitud de\(\Delta\)) depende de la identidad del ion metálico, la geometría de coordinación y la identidad del ligando. Sin embargo, los químicos no solo “miran” el color, sino que lo medimos usando espectroscopía electrónica de absorción. Esto generalmente se hace en un laboratorio usando un espectrofotómetro UV-Visible.
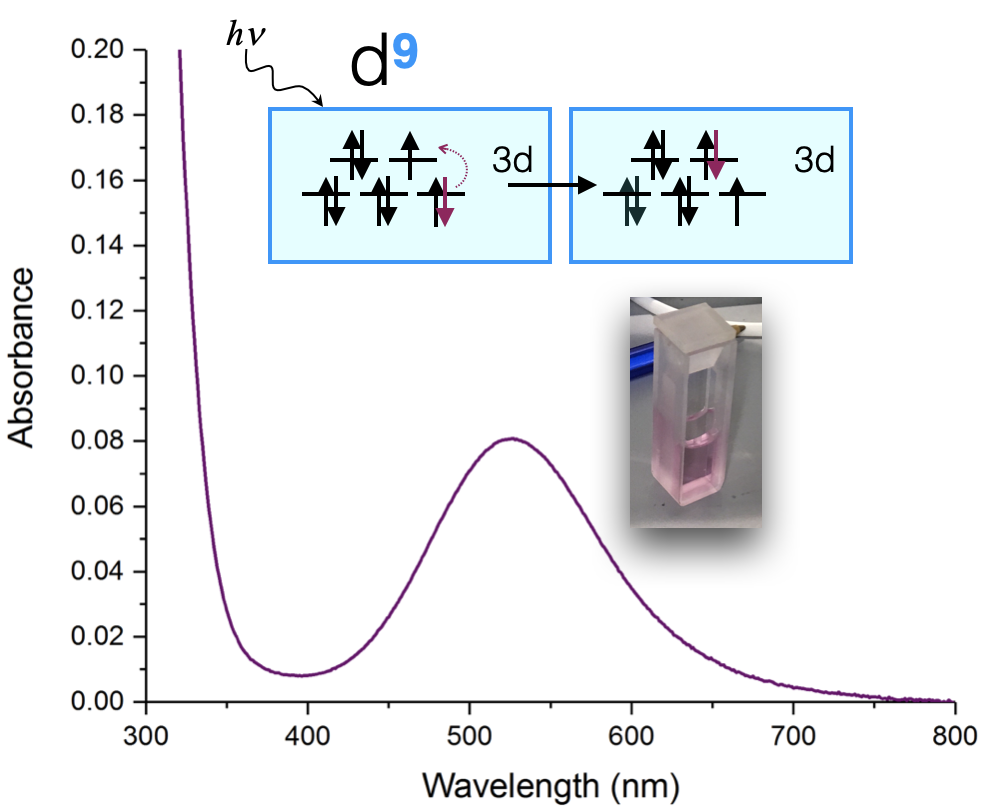
Un ejemplo de tal medición se muestra a continuación en la Figura\(\PageIndex{1}\) para un complejo de Cu (II). La muestra aparece de color rosa en el ojo, y cuando se mide con un espectrómetro UV-Visible, se muestra que absorbe la luz visible a aproximadamente 530 nm. El espectro de absorción puede indicar el estado de oxidación del Cu, los ligandos unidos al ion Cu (II) y la geometría de coordinación. El color de la solución en la Figura\(\PageIndex{1}\) es un tono de rosa.
Observamos el color complementario de la luz absorbida
El espectro de absorción mostrado anteriormente en la Figura\(\PageIndex{1}\) es un caso sencillo en el que solo se observa una banda de absorción en la región visible del espectro. En un caso sencillo como este, el color de un complejo puede predecirse como el color complementario de la luz absorbida por la solución. Cuando una solución u objeto absorbe una cierta longitud de onda, vemos el color complementario; o el color opuesto a la longitud de onda absorbida en la rueda de colores en la Figura\(\PageIndex{2}\). En el caso del espectro complejo Cu (II) mostrado en la Figura\(\PageIndex{1}\), el color de la luz absorbida a 530 nm es verde, y el color pronosticado observado es rosa.
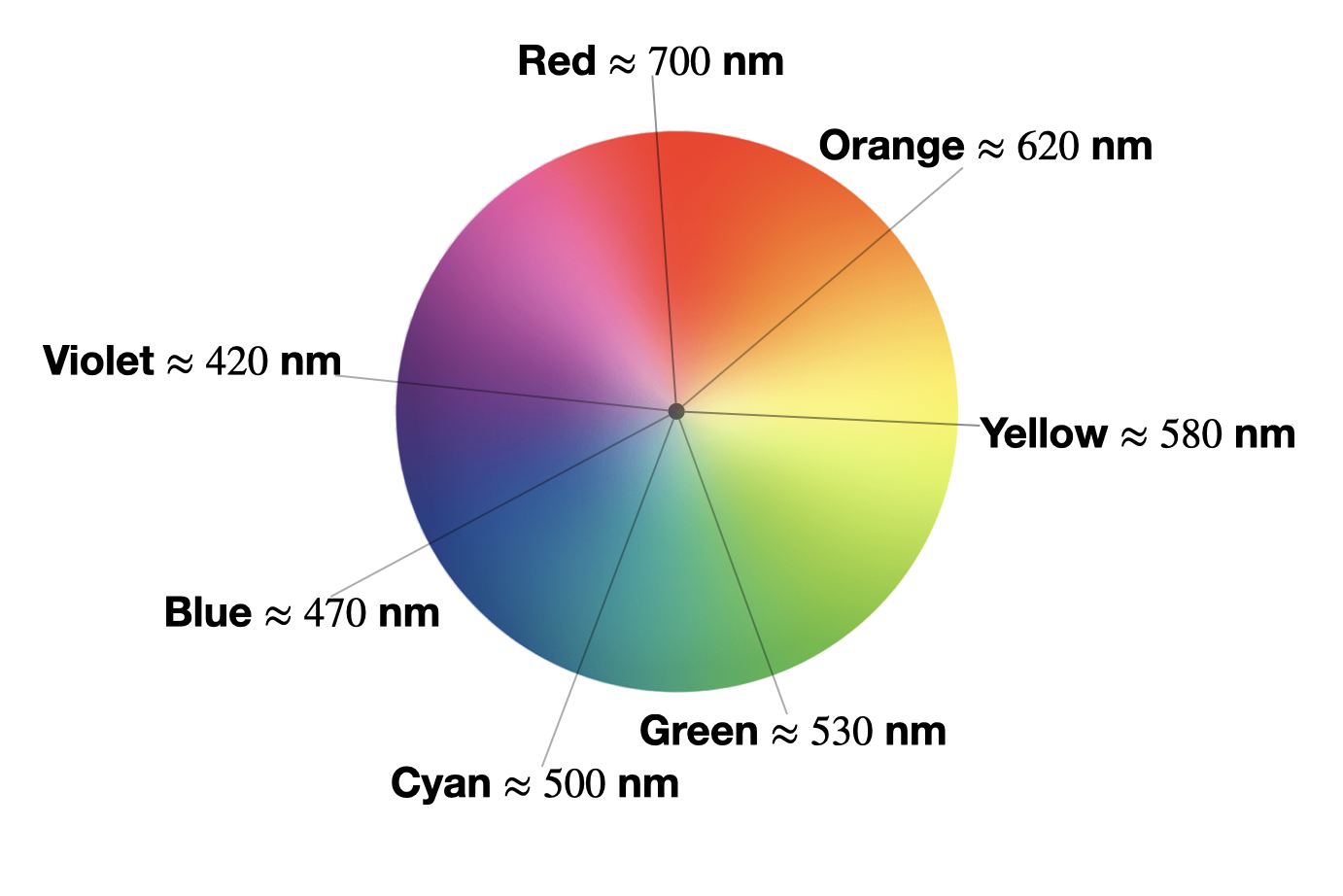
La siguiente tabla enumera los colores aproximados de absorción correspondientes a las longitudes de onda de la luz absorbida, y da información similar a la deducida de la Figura\(\PageIndex{2}\).
| \(\lambda\)absorbido | E (cm\(^{-1}\)) | E (eV) | Color aproximado absorbido | Color pronosticado observado (a ojo) |
|---|---|---|---|---|
| \ (\ lambda\) absorbida">\(> 700\) nm | \ (^ {-1}\)) ">\(< 14,000 \frac{1}{\text{cm}}\) | \( < 1.77\)eV | Infrarrojos | no observable |
| \ (\ lambda\) absorbida">\(\approx 700-635\) nm | \ (^ {-1}\)) ">\(\approx 14,300- 16,000\frac{1}{\text{cm}}\) | \( \approx 1.77-1.95\)eV | Rojo | Verde |
| \ (\ lambda\) absorbida">\(\approx 635-590\) nm | \ (^ {-1}\)) ">\(\approx 15,700- 16,900 \frac{1}{\text{cm}}\) | \( \approx 1.95-2.10\)eV | Naranja | Azul |
| \ (\ lambda\) absorbida">\(\approx 590-560\) nm | \ (^ {-1}\)) ">\(\approx 16,900-17,900 \frac{1}{\text{cm}}\) | \( \approx 2.10-2.21\)eV | Amarillo | Violeta |
| \ (\ lambda\) absorbida">\(\approx 560-520\) nm | \ (^ {-1}\)) ">\(\approx 17,900- 19,200 \frac{1}{\text{cm}}\) | \( \approx 2.21-2.38\)eV | Verde | Rojo |
| \ (\ lambda\) absorbida">\(\approx 520-490\) nm | \ (^ {-1}\)) ">\(\approx 19,200- 20,400 \frac{1}{\text{cm}}\) | \( \approx 2.38-2.53\)eV | Cian | Rojo-Naranja |
| \ (\ lambda\) absorbida">\(\approx 490-450\) nm | \ (^ {-1}\)) ">\(\approx 20,400- 22,200 \frac{1}{\text{cm}}\) | \( \approx 2.53-2.76\)eV | Azul | Naranja |
| \ (\ lambda\) absorbida">\(400-450\) nm | \ (^ {-1}\)) ">\(\approx 22,200- 25,000 \frac{1}{\text{cm}}\) | \( \approx 2.76-3.10\)eV | Violeta | Amarillo |
| \ (\ lambda\) absorbida"><400 nm | \ (^ {-1}\)) ">\(> 25,000 \frac{1}{\text{cm}}\) | \( > 3.10\)eV | Ultravioleta (UV) | no observable |
Energía de absorción electrónica
El espectro de absorción de un complejo metálico se puede utilizar para calcular la energía de división\(\Delta\),, cuando la absorción corresponde a una\(d \rightarrow d \) transición. Usemos como ejemplo el complejo\(d^9\) Cu (II) (discutido anteriormente). Un ion\(d^9\) metálico solo tiene una\(d \rightarrow d\) transición visible-luz. Supongamos que la geometría de coordinación es aproximadamente octaédrica (aunque en realidad es un octaedro distorsionado de Jahn-Teller, y más como un plano cuadrado). Si asumimos que es octaédrico, entonces el diagrama de división\(d\) -orbital (ver Figura\(\PageIndex{1}\)) nos lleva a esperar una transición electrónica: un electrón se excita del\(t_{2g}\) a\(e_g\). La energía absorbida es igual a la energía del\(\Delta\).
Muchos casos no son tan simples como un caso\(d^9\) octaédrico porque existen múltiples transiciones electrónicas posibles, y también múltiples bandas de absorción en el espectro UV-Vis. En estos casos más complejos, la energía real de la transición se ve afectada por diferencias en las energías de repulsión electrón-electrón en el estado fundamental y los estados excitados. Aprenderemos a dar cuenta de múltiples estados excitados posibles y repulsiones electrón-electrón usando diagramas Tanabe-Sugano más adelante en este capítulo.


