11.3.7: Espectros de transferencia de carga
- Page ID
- 81147
Transiciones de transferencia de

Todavía no hemos terminado con nuestros espectros electrónicos. Hasta ahora, solo hemos considerado transiciones de electrones d entre d-orbitales, y sus términos. Estas se llaman transiciones d-d. Sin embargo, también existen las llamadas transiciones de transferencia de carga posibles, que no son transiciones d-d. Podemos ver fácilmente que debe haber transiciones distintas a las transiciones d-d cuando miramos los colores de los iones d 10 y d 0. Para esos, no hay transiciones d-d posibles. Por lo tanto, todos deben ser incoloros. Sin embargo, eso no siempre es cierto. Algunos de estos iones son efectivamente incoloros, pero algunos no (Figura\(\PageIndex{2}\)). Por ejemplo, Zn 2 +, un ion d 10, es incoloro en complejos, pero no Cu (I), que también es d 10. Mientras que el tetrakis (acetonitrilo) cobre (+) es incoloro, el bis (fenantreno) cobre (+) es naranja oscuro. los iones d 0 tienen propiedades similares: Mientras que TiF 4 y TiCl 4 son incoloros, TiBr 4 es naranja y TiI 4 es marrón. Algunas especies d 0 son incluso extremadamente coloridas, por ejemplo, permanganato con Mn 7 +, que es extremadamente púrpura, y dicromato con Cr (VI), que es naranja brillante.
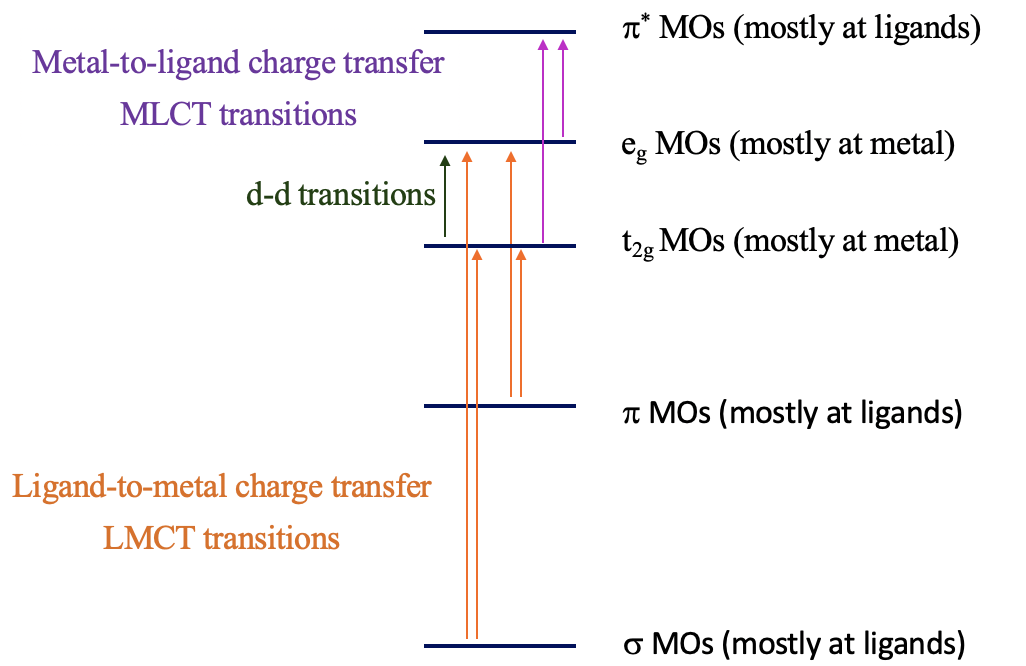
La explicación de estos fenómenos son las transiciones de transferencia de carga (\(\PageIndex{2}\)). Hay dos tipos de transiciones de transferencia de carga: transiciones de transferencia de carga de ligando a metal (LMCT) y de metal a ligando (MLCT). Para las transiciones ligando-metal, los electrones de la unión σ y π-orbitales se excitan en orbitales d metálicos en el campo ligando, por ejemplo los orbitales t 2g y e g en un complejo octaédrico. Si la diferencia de energía entre los orbitales σ/π-y los orbitales d es lo suficientemente pequeña, entonces esta transición electrónica se asocia con la absorción de luz visible. La transición se denomina transición ligando a metal porque los orbitales σ/π-ligando se localizan principalmente en los ligandos, mientras que los orbitales metal-d-en un campo de ligando se localizan principalmente en el metal. Viceversa, la transición de metal a ligando implica la transición de un electrón de orbitales d metálicos en un campo de ligando a orbitales π*-ligando. Esto esencialmente mueve la densidad electrónica del metal al ligando, de ahí el nombre de transición de transferencia de carga de ligando a metal. Si la diferencia de energía entre el ligando π* y los orbitales metálicos es lo suficientemente pequeña, entonces la absorción ocurre en el rango visible. Las transiciones de transferencia de carga suelen ser permitidas tanto en espín como en Laporte; por lo tanto, si ocurren, el color suele ser muy intenso. ¿Cómo podemos distinguir entre d-d y transiciones de transferencia de carga? Las transiciones de transferencia de carga a menudo cambian de energía a medida que se varía la polaridad del disolvente (solvatocrómica), ya que hay un cambio en la polaridad del complejo asociado con la transición de transferencia de carga. Esto se puede utilizar para distinguir entre transiciones d-d y bandas de transferencia de carga.
Transiciones LMCT
¿Podemos predecir cuándo las ventanas de energía entre los orbitales moleculares de unión y los orbitales d metálicos son lo suficientemente pequeñas para que tengan lugar las transiciones LMCT en lo visible? Generalmente, sería deseable que la energía de los orbitales metálicos fuera lo más baja posible y la energía de los orbitales del ligando de unión fuera lo más alta posible. La energía de los d-orbitales metálicos disminuye al aumentar la carga positiva en el metal debido a que aumenta la carga nuclear efectiva sobre el metal. Esto significa que los estados de oxidación de metales muy altos favorecen las transiciones LMCT. Los orbitales d deben tener pocos o ningún electrón, de modo que los electrones puedan ser promovidos hacia los orbitales, y la energía orbital disminuye debido a que se minimiza la repulsión electrón-electrón. Ejemplos son Mn (VII), Cr (VI) y Ti (IV). La energía de los MO de los orbitales ligantes de unión aumenta cuando los orbitales del ligando tienen alta energía; este suele ser el caso de los ligandos donadores π con carga negativa (Fig. 8.2.21).


Ejemplos de ligandos son ligandos oxo y halo. Esto explica, por ejemplo, las transiciones LMCT en permanganato. El Mn se encuentra en el estado de oxidación muy alto +7, y los ligandos son oxo-ligandos, los cuales son donadores π con una carga 2- negativa. Las transiciones son tanto Laporte como spin-allowed, lo que lleva a una intensidad muy alta de absorción de luz, y así color (Fig. 8.2.21).
Transiciones MLCT
Entonces, ¿cuáles son las propiedades favorables del ion metálico y del ligando para una transición de metal a ligando? En este caso nos gustaría mantener la energía de los orbitales metálicos lo más alta posible para que se minimice la diferencia de energía entre un d-orbital metálico y un orbital π*-orbital. Esto se logra cuando la carga positiva en el ion metálico es pequeña, y hay muchos electrones d que pueden repelerse entre sí, aumentando así las energías orbitales, por ejemplo Cu (I), Fig. 8.2.22.
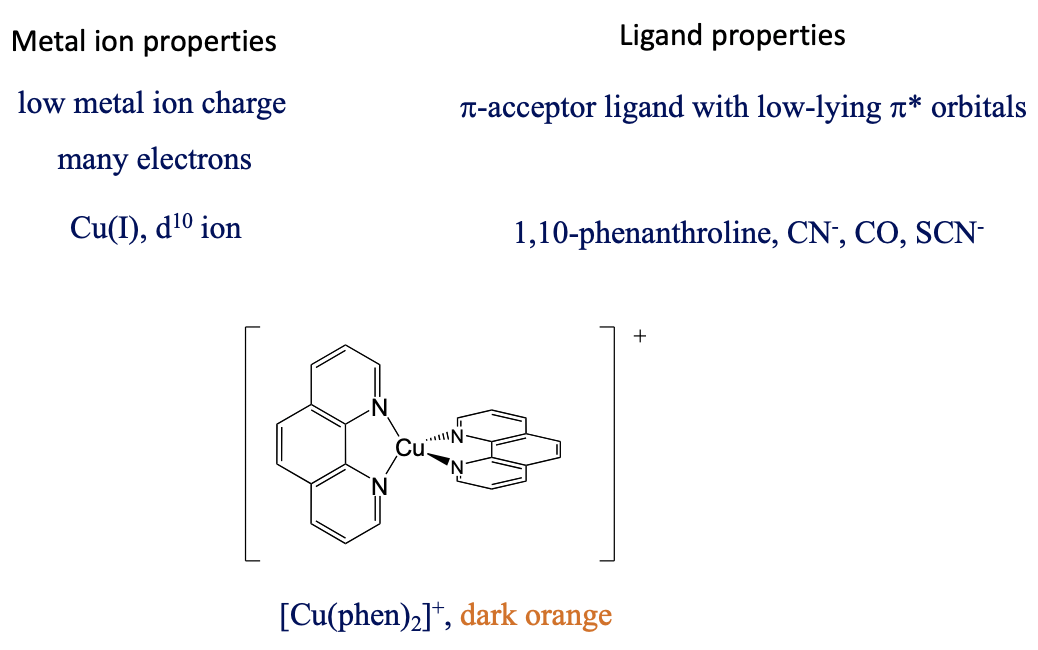
El ligando debe ser un aceptor π con orbitales π*-bajos - por ejemplo, fenantrolina, CN -, SCN - y CO. El ion bis (fenantrolina) cobre (+), por ejemplo, es naranja oscuro y tiene una banda de absorción MLCT a 458 nm. Esta transferencia MLCT está permitida tanto por giro como en Laporte.
Cabe mencionar que algunos complejos permiten transiciones tanto de metal a ligando como de ligando a metal. Por ejemplo, en el complejo Cr (CO) 6, los orbitales σ-orbitales son lo suficientemente altos y los orbitales π*-son lo suficientemente bajos en energía para permitir la absorción de luz en el rango visible. Finalmente, las bandas intraligand también son posibles cuando el ligando es un cromóforo.


