12.2.2: Complejos inertes y lábiles
- Page ID
- 81485
Cinética de las reacciones de sustitución
La cinética es una rama de la química que se ocupa de las tasas de reacciones químicas. En esta sección, discutiremos las tasas de reacciones de sustitución metal-ligando (M-L).
Empecemos con algunos ejemplos. En la siguiente tabla hay tres ejemplos de reacciones de sustitución de ligandos de complejos hexaaquo metálicos para formar complejos de hexaammina. Estas reacciones son casi idénticas con la excepción del ión metálico. Los productos son favorecidos termodinámicamente en todos los casos.
| Reacción | Constante de velocidad (\(k\)) | Lábil o Inerte |
|---|---|---|
| \(\ce{[Ni(OH2)]^{2+} + 6 NH3 <=>> [Ni(NH3)6]^{2+}} \quad\) | \ (k\)) ">\(k = 10^{4} s^{-1}\) (1 ns) |
Lábil (ocurre en < 1 min) |
| \(\ce{[Cr(OH2)]^{3+} + 6 NH3 <=>> [Cr(NH3)6]^{3+}} \quad\) | \ (k\)) ">\(k = 10^{-3} s^{-1}\) (6 días) | Inerte (lento, toma horas) |
| \(\ce{[Cu(OH2)]^{2+} + 6 NH3 <=>> [Cu(NH3)6]^{2+}}\quad \) | \ (k\)) ">\(k = 10^{8} s^{-1}\) | Muy lábil (ocurre en segundos) |
- Cinéticamente lábil - Los complejos metálicos que experimentan reacciones de sustitución “cinéticamente rápidas” son cinéticamente lábiles. Taube sugirió que se trata de reacciones en las que la mitad del reactivo se consume en un minuto o menos (\(t_{1/2}\)<1 min).
- Cinéticamente Inerte - Los complejos metálicos que experimentan reacciones de sustitución “cinéticamente lentas” son cinéticamente inertes o no lábiles. Taube sugirió que se trata de reacciones en las que\(t_{1/2}\) >1 min.
Un escollo común es confundir el significado de términos cinéticos, como lábil e inerte, con términos termodinámicos, como estable e inestable. Es importante distinguir entre cinética y termodinámica. Por ejemplo, el complejo\([Fe(H_2O)Cl]^{2+}\) tiene una gran constante de formación y es termodinámicamente estable; sin embargo, también es lábil. Por otro lado, el complejo\([Co(NH_3)_6]^{3+}\) es inestable en solución acuosa ácida y se descompone espontáneamente en\([Co(H_2O)_6]^{3+}\); sin embargo, se descompone lentamente porque es inerte. Es una buena práctica usar términos claros como "cinéticamente lábil” o "cinéticamente inerte” y "termodinámicamente estable” y "termodinámicamente inestable”.
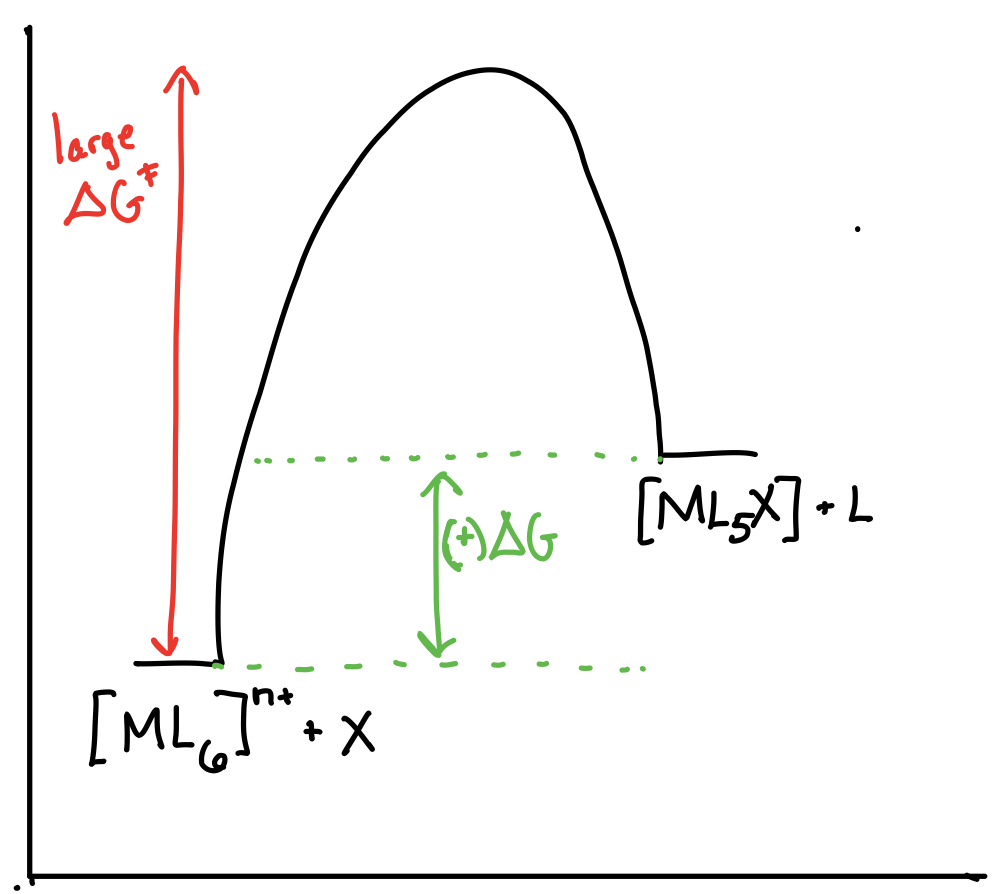
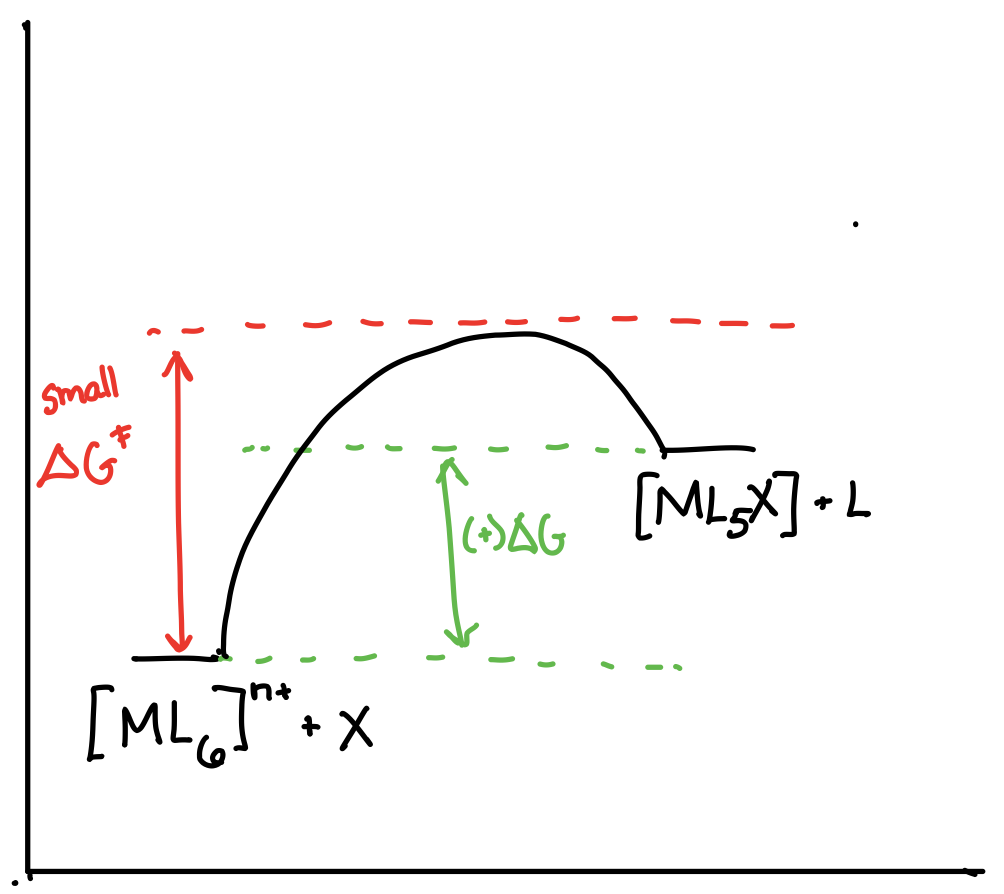
Dibuje los diagramas de coordenadas de reacción para una reacción de la forma\([ML_6]^{n+} + X \rightleftharpoons [ML_5X]^{n+} + L\) en los siguientes escenarios:
- \([ML_6]^{n+}\)es termodinámicamente estable y cinéticamente inerte.
- \([ML_6]^{n+}\)es termodinámicamente inestable y cinéticamente inerte.
- \([ML_6]^{n+}\)es termodinámicamente estable y cinéticamente lábil.
- \([ML_6]^{n+}\)es termodinámicamente inestable y cinéticamente lábil.
- Respuesta a)
-
- Respuesta b)
-
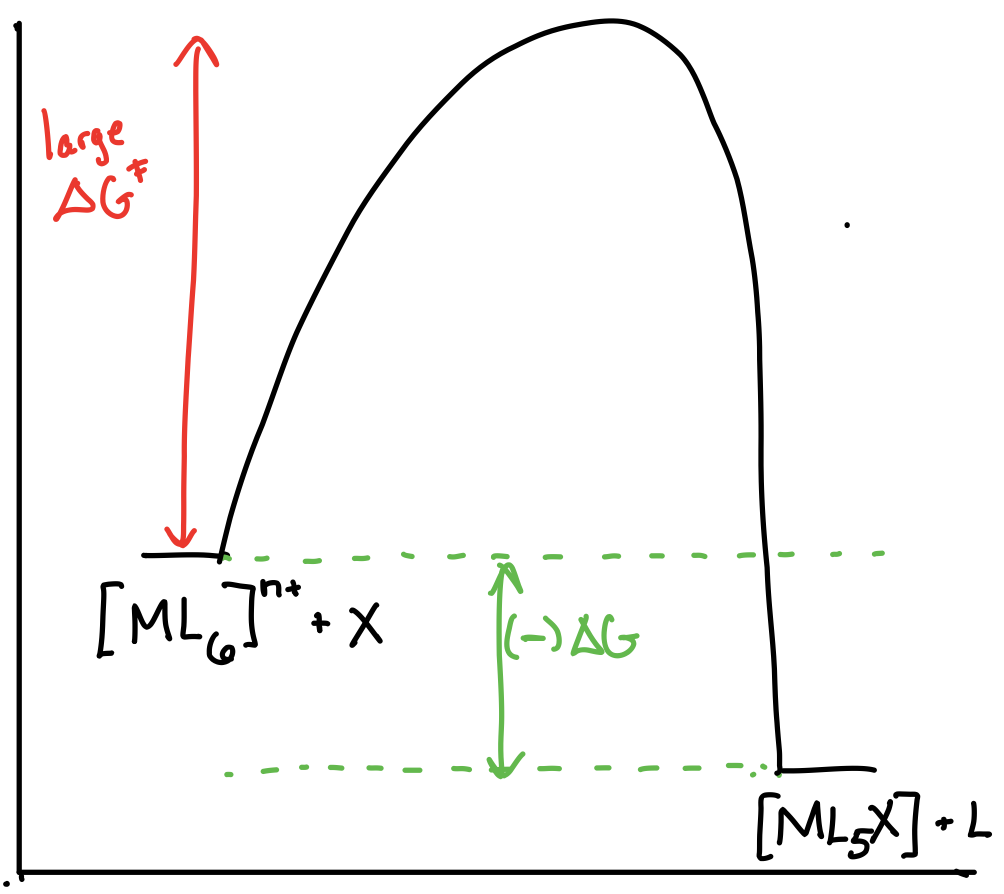
- Respuesta c)
-
- Respuesta d)
-

Factores que afectan las tasas de reacciones de sustitución:
Algunos de los factores que afectan las tasas cinéticas de sustitución de ligandos son los mismos factores que afectan la estabilidad termodinámica (ver Capítulo 10). Los mismos factores que hacen estable a un complejo también pueden hacerlo más inerte. ¿Por qué los factores cinéticos están relacionados con la estabilidad termodinámica? Se debe a que la estructura y estabilidad del complejo reactivo está relacionada con la estructura y estabilidad del estado de transición. El complejo reactivo debe cambiar su geometría para formar un estado intermedio o de transición. Cuando el reactivo es particularmente estable, puede resultar en una mayor energía de activación asociada con alejarse de la configuración estable. Sin embargo, es incorrecto suponer que la estabilidad siempre está correlacionada con las velocidades de reacción. Los factores cinéticos y termodinámicos están relacionados, pero separados.
Hay tres factores importantes que influyen en la tasa cinética de sustitución:
- Energía de estabilización de campo de ligando (LFSE): Las configuraciones de electrones que colocan electrones en orbitales de mayor energía (particularmente orbitales antienlace) resultan en complejos más lábiles. Mientras no haya electrones en orbitales de mayor energía, la labilidad se correlaciona aproximadamente con LFSE. Cuanto más negativo es el LFSE, más inerte.
- Atracción coulómbica entre el metal y el ligando: En general, una mayor densidad de carga en el ión metálico o en el ligando (s) conduce a una atracción electrostática más fuerte entre el metal y el ligando. La atracción coulómbica más fuerte generalmente conduce a pasos de disociación más lentos y pasos de asociación más rápidos. El efecto que estos tienen sobre la velocidad de reacción depende de los pasos elementales que participan en los pasos de determinación de velocidad.
- Denticidad: Los ligandos multidentados crean complejos particularmente inertes como resultado del efecto cinético del quelato.
Las tres consideraciones se describen con más detalle a continuación.
¿En qué compuesto de cada par esperarías los enlaces iónicos más fuertes? ¿Por qué?
a) LiF vs KBr
b) CaCl 2 vs KCl
- Contestar a
-
Los iones en LiF son ambos más pequeños que en KBr, por lo que la fuerza de atracción entre los iones en LiF es mayor debido a la menor separación entre las cargas.
- Respuesta b
-
El calcio tiene una carga 2+ en CaCl 2, mientras que el potasio solo tiene una carga +, por lo que los iones cloruro son más fuertemente atraídos por el calcio que por el potasio.
Observaciones de Taube sobre las tasas de sustitución de complejos metálicos
Henry Taube (Premio Nobel, 1983) intentó comprender la labilidad cinética comparando los factores que rigen las fuerzas de enlace con observaciones sobre las velocidades de reacción de los complejos de coordinación. Vio algunas cosas que no eran sorprendentes. También sacó algunas conclusiones nuevas basadas en la teoría del campo de ligandos.
Taube observó que muchos iones M +1 (M = metal) son más lábiles que muchos iones M +3, en general. Eso no es demasiado sorprendente, ya que los iones metálicos funcionan como electrófilos (ácidos de Lewis) y los ligandos funcionan como nucleófilos (bases de Lewis) en la formación de complejos de coordinación. En otras palabras, los metales con cargas más altas deberían ser ácidos de Lewis más fuertes, por lo que deberían unirse a los ligandos con mayor fuerza. No obstante, hubo excepciones a esa regla general. Por ejemplo, Taube también observó que\(\ce{Mo+5}\) los compuestos son más lábiles que\(\ce{Mo+3}\) los compuestos. Entonces, debe haber algo más sucediendo aquí que solo los efectos de la atracción electrostática.
Otro factor que gobierna las fuerzas de enlace iónico es el tamaño del ion. Típicamente, los iones con radios atómicos más pequeños forman enlaces más fuertes que los iones con radios más grandes. Taube observó que los iones Al 3 +, V 3+, Fe 3 + y Ga 3 + tienen aproximadamente el mismo tamaño. Todos estos iones intercambian ligandos aproximadamente a la misma velocidad. Eso no es sorprendente, porque tienen la misma carga y el mismo radio. Sin embargo, el Cr 3 + también tiene aproximadamente el mismo tamaño que esos iones y también tiene la misma carga, pero es mucho menos lábil. Una vez más, hay excepciones a nuestras expectativas regulares basadas en simples consideraciones electrostáticas. Además, los metales de transición 4d y 5d (Y\(\rightarrow\) Cd y Ac\(\rightarrow\) Hg) son mucho más inertes que los metales de transición 3d (Sc\(\rightarrow\) Zn). Esto es inesperado cuando consideramos el tamaño; los metales 4d y 5d son mucho más grandes que los metales 3d. Este comportamiento inesperado nos dice que la electrostática por sí sola no puede predecir labilidad.
A Taube se le ocurrió una hipótesis que podría explicar las aparentes oservaciones contradictorias descritas anteriormente: la labilidad cinética debe verse afectada por la configuración de electrones d. Esta idea forma la base de las reglas de Taube sobre labilidad.
Por ejemplo, metales como Ni 2 + y Cu 2 + son muy lábiles. Los diagramas de división orbital d para esos compuestos tendrían d electrones en el conjunto e g. Recuerde, el conjunto de e g surge de la interacción con los orbitales donantes de ligandos; este conjunto corresponde a un nivel\(\sigma\) antiunión.
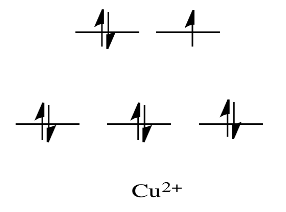
En comparación, V 2+ es bastante inerte. El diagrama de división orbital d en este caso tiene electrones en el conjunto t 2g, pero ninguno en el conjunto e g.
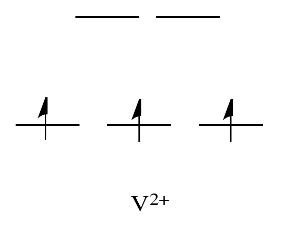
Entonces, al tener electrones en la mayor energía, el nivel de e g antiunión debilita el enlace al ligando, por lo que el ligando puede reemplazarse más fácilmente. En ausencia de esos electrones de mayor energía, el enlace al ligando es más fuerte, y el ligando no se reemplaza tan fácilmente.
Por otro lado, metales como Ca 2 +, Sc 3 + y Ti 4 + son bastante lábiles. Los d diagramas de división orbital en esos casos son bastante simples: no hay electrones d en absoluto en estos iones.
Eso significa que no tener electrones en estos niveles mayormente no enlazantes deja al complejo susceptible al reemplazo del ligando. Pero es difícil ver por qué la población de un orbital que en su mayoría no es enlazante tendría un efecto sobre la fuerza del enlace del ligando.
En cambio, este factor probablemente tenga algo que ver con la parte de sustitución de ligandos que hasta ahora hemos ignorado. No sólo necesita salir un ligando, sino que un segundo necesita unirse en su lugar. Entonces, tener un orbital vacío para que el ligando done electrones en (o, dicho de otra manera, no tener electrones en la forma que pueda complicar la donación del ligando) facilita esa parte de la reacción.
Considere todas las configuraciones de electrones posibles para los complejos octaédricos (\(d^0\)a\(d^{10}\), casos de espín alto y bajo espín): prediga si cada caso sería inerte, intermedio o lábil.
- Contestar
-
Cinéticamente Inerte (Lento) Cinéticamente lábil (rápido) \(d^n\)recuento de electrones e intensidad de campo de ligando Configuraciones octaédricas con\(e_g\) orbitales vacíos:
- \(d^3\)
- bajo giro\(d^4, d^5, d^6\)
Campo fuerte\(d^8\) (plano cuadrado)
Configuraciones octaédricas con\(e_g\) orbitales ocupados:
- \(d^1,d^2, d^7,d^9,d^10\)
- de alto giro\(d^4,d^5, d^6\)
Campo débil\(d^8\) (generalmente tetraédrico)
Poner los iones metálicos en orden decreciente de la velocidad de reacción (de lábil a inerte):
a)\(Al^{3+}, Na^+, Mg^{2+}\)
b)\(Ca^{2+}, Mg^{2+}, Sr^{2+} \)
- Respuesta (a)
-
Más lábil a más inerte:\(Na^+ > Mg^{2+} > Al^{3+}\)
Se trata de iones metálicos con tamaño similar y carga variable. Están en orden de aumentar la carga y aumentar la densidad de izquierda a derecha.
- Respuesta (b)
-
Más lábil a más inerte:\(Sr^{2+} > Ca^{2+} > Mg^{2+}\)
Estos iones metálicos tienen la misma carga, y varían en tamaño. Están en orden de disminuir la carga y aumentar la densidad de carga de izquierda a derecha.
Algunos metales, como Mn 2 +, pueden ser lábiles o inertes, dependiendo de si son de alto espín o de bajo espín. Explicar por qué usar d diagramas de división orbital.
- Contestar
-
Agrega textos aquí. No elimine primero este texto.
Predecir si los siguientes metales, en complejos octaédricos, son lábiles o no.
a) Co 3 + (alto giro)
b) Co 3 + (bajo giro)
c) Fe 2 + (bajo giro)
d) Fe 2 + (alto giro)
e) Zn 2 +
- Contestar
- Contestar a
-
lábil (electrones en mayor energía d conjunto orbital)
- Respuesta b
-
no lábil (todos los electrones en orbitales d de menor energía)
- Respuesta c
-
no lábil (todos los electrones en orbitales d de menor energía)
- Respuesta d
-
lábil (electrones en mayor energía d conjunto orbital)
- Respuesta e
-
lábil (electrones en mayor energía d conjunto orbital)
Generalizaciones sobre cómo el ion metálico afecta a la cinética:
Estas son algunas generalizaciones sobre cómo la cinética de sustitución se ve afectada por la identidad de iones metálicos y la configuración\(d^n\) electrónica.
- los metales del bloque s son muy lábiles, excepto aquellos con densidad de carga muy alta (eg. \(Mg^{2+}\ is\: inert\))
- \(d^{10}\)los metales son lábiles (por ejemplo:\(Zn^{2+}, Cu^+, Hg^{2+}\))
- Otros iones con una capa completa son lábiles (por ejemplo:\(Ln^{3+}\) de bloque f)
- 3d\(M^{2+}\), cuando el giro alto, son generalmente lábiles (eg. \(Cu^{2+} is\: very\: labile\))
- 4d y 5d son generalmente inertes debido a un LFSE más alto (bajo giro, LFSE alto)
- \(M^{2+}\)es más lábil que el mismo metal que\(M^{3+}\)
- \(d^3\)y bajo centrifugado\(d^6\) son inertes (eg. \(Cr^{3+}, Co^{3+}, \)bajo giro\(Fe^{2+}\))
Complejos de quelatos
Además de considerar factores relacionados con el ion metálico y el carácter de carga o covalente de los enlaces metal-ligando, una consideración importante es el efecto de un ligando quelato sobre la cinética de reacción. Este efecto también se discute con más detalle más adelante en este capítulo (Sección 12.4.5).
Recordemos el Efecto Quelato Termodinámico
Los complejos quelantes tienden a ser más estables que los complejos con ligandos monodentados. A esto se le llama el “efecto quelato termodinámico”. El efecto merece una explicación. La explicación es el aumento de entropía que se produce cuando dos o más ligandos monodentados son reemplazados por un ligando quelante. La entropía aumenta debido a que el número total de partículas aumenta a medida que se produce la sustitución.
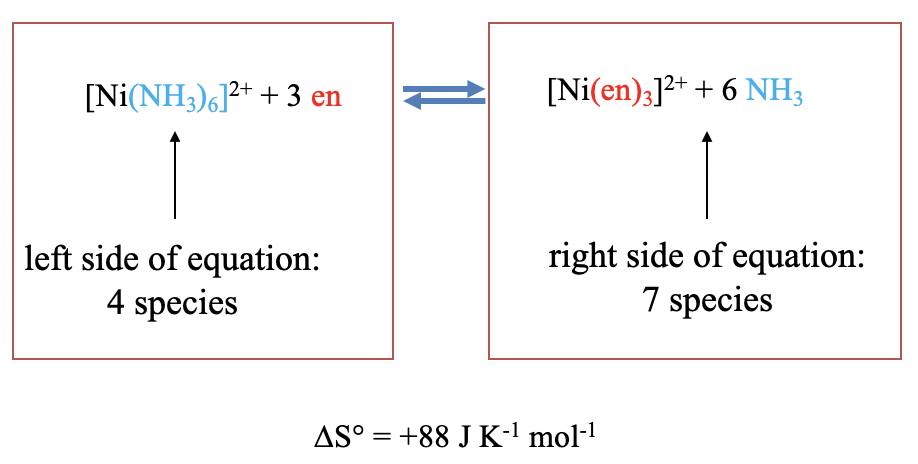
Por ejemplo, la sustitución de seis ligandos de amina en el complejo hexaamina-níquel (2+) por tres ligandos quelantes de etilendiamina aumenta el número de moléculas de cuatro a siete, y por lo tanto la entropía aumenta, en este caso en 88 J K -1 y mol -1 (Figura\(\PageIndex{3}\))
El Efecto Quelato Cinético
Además del efecto quelato termodinámico, existe el efecto quelato cinético. Los complejos de quelatos son frecuentemente más inertes que los complejos con ligandos monodentados. Los complejos quelatos son más inertes por dos razones (Figura\(\PageIndex{4}\)).
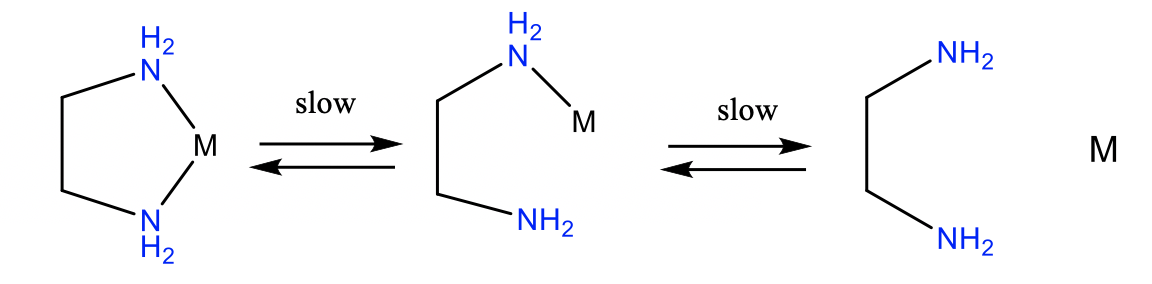
En primer lugar, todos los ligandos necesitan rotar y doblarse para escindir el primer enlace metal-ligando. Esto requiere tiempo y ralentiza la cinética de la escisión del enlace. La segunda razón es que el átomo donante separado no puede salir de la proximidad del complejo porque el ligando aún está unido a través del otro átomo donante. Esto aumenta la probabilidad de la re-formación del enlace metal-ligando, lo que disminuye la probabilidad de que ambos enlaces sean escindidos.
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John's University)
Modified by Kathryn Haas (khaaslab.com)
Template:ContribLandskron

