12.2.3: Posibilidades Mecanicistas
- Page ID
- 81479
Un mecanismo es la secuencia de pasos elementales por los cuales procede una reacción. Hay dos aspectos que describen el mecanismo de una reacción de sustitución. Uno se llama el mecanismo estequiométrico, y el otro se llama el mecanismo íntimo. La parte estequiométrica del mecanismo se define por la identidad del intermedio, o la falta del mismo. La parte íntima del mecanismo se define por el paso limitante de la velocidad, y cómo la velocidad depende de la identidad del ligando entrante.
Mecanismos estequiométricos
La parte estequiométrica del mecanismo se define por la identidad del intermedio, o la falta del mismo. Existen tres clases de mecanismos estequiométricos basados en el tipo de intermedios que se pueden caracterizar. Si el intermedio puede aislarse es una reacción asociativa (intermedio de número de coordinación superior) o disociativa (intermedio de número de coordinación inferior). Por otro lado, si el intermedio no puede aislarse por ser efímero (o no existe) la reacción se clasifica como Intercambio.
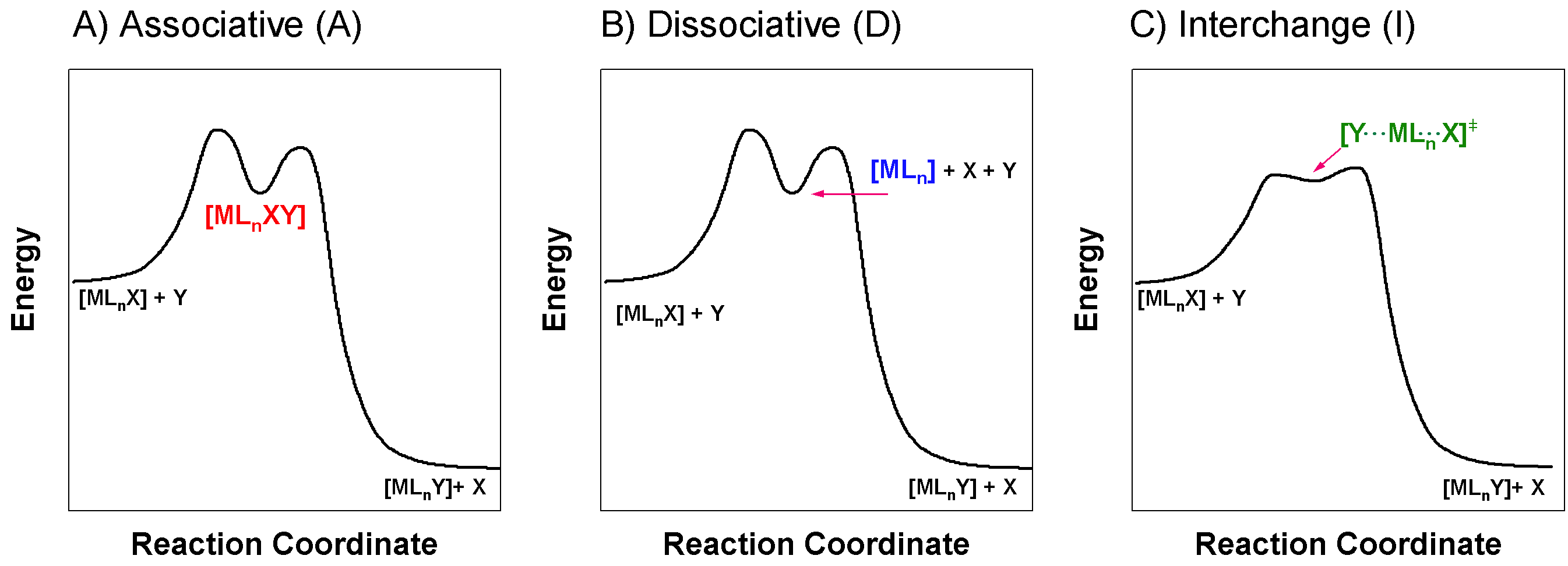
Mecanismo asociativo (A)
Los mecanismos asociativos (A) implican un primer paso donde el ligando entrante se une al ion metálico, creando un intermedio con un mayor número de coordinación. El grupo de salida sale en un segundo paso para formar el producto. La reacción genérica a continuación ilustra los pasos de un mecanismo asociativo. Obsérvese que el intermedio\(\color{red}{\ce{ML_{n}XY}}\),, tiene un número de coordinación mayor que el del reactivo,\(\ce{ML_{n}X}\).
\ [\ begin {array} {rc}
\ text {Reacción general:} &\ ce {ML_ {n} X + Y <=> ML_ {n} Y + X}\\
\ hline\ text {Paso 1 (Asociación):} &\ ce {ML_ {n} X + Y <=>}\ color {rojo} {\ ce {ML_ {n} XY}\
\ texto {Paso 2 (Disociación):} &\ textcolor {rojo} {\ ce {ML_ {n} XY}}\ ce {<=> ML_ {n} Y + X}
\ fin {matriz}\ nonumber\]
Los mecanismos asociativos son típicos de los\(d^8\) complejos planos cuadrados. Las características importantes que distinguen a este mecanismo de otros es que el intermedio es lo suficientemente longevo como para que sea detectable, y que el intermedio tenga un número de coordinación mayor que el complejo reactivo.
Mecanismo disociativo (D)
Los mecanismos disociativos (D) implican un primer paso donde se rompe un enlace entre el ion metálico y el grupo saliente, creando un intermedio con un menor número de coordinación. El grupo entrante entra en un segundo paso para formar el producto. La reacción genérica a continuación ilustra las etapas de un mecanismo disociativo. Obsérvese que el intermedio\(\color{blue}{\ce{ML_{n}}}\),, tiene un número de coordinación menor que el del reactivo,\(\ce{ML_{n}X}\).
\ [\ begin {array} {rc}
\ text {Reacción general:} &\ ce {ML_ {n} X + Y <=> ML_ {n} Y + X}\
\\ hline\ text {Paso 1 (Disociación):} &\ ce {ML_ {n} X <=>}\ textcolor {azul} {\ ce {ML_ {n}}\ ce {+ X}\\
\ text {Paso 2 (Asociación):} &\ textcolor {azul} {\ ce {ML_ {n}}}\ ce {+ Y & lt; => ML_ {n} Y}
\ end {array}\ nonumber\]
Las características importantes que distinguen a este mecanismo de otros es que el intermedio es lo suficientemente longevo como para que sea detectable, y que el intermedio tenga un número de coordinación menor que el complejo reactivo.
Mecanismo de Intercambio (I)
Intercambio (I) Los mecanismos se llevan a cabo en un paso concertado donde entra el grupo entrante cuando sale el grupo saliente. La formación de enlaces y la ruptura del enlace ocurren simultáneamente. En el caso de un mecanismo de intercambio, no es detectable ningún intermedio. Esto significa que o no hay intermedio, o que el intermedio es de energía demasiado alta y de corta duración para ser detectado. La reacción genérica a continuación ilustra el paso único de un mecanismo de intercambio. Tenga en cuenta que la especie\(\color{green}{\ce{[Y\bond{...}ML_{n}\bond{...}X]^{\ddagger}}}\),, puede definirse como un estado de transición o un intermedio de muy corta duración. La distinción entre estas dos posibilidades es difícil; cuando el intermedio es indetectable no se considera un verdadero intermedio.
\ [\ begin {array} {rc}
\ text {Reacción general:} &\ ce {ML_ {n} X + Y <=> ML_ {n} Y + X}\\
\ hline\ text {Paso 1 (Concertado):} &\ ce {ML_ {n} X + Y <=>}\ textcolor {verde} {\ ce {[Y\ bond {...} ML_ {n}\ bond {...} X] ^ {\ ddagger}}}\ ce {+ <=> ML_ {n} Y + X}
\ end {array}\ nonumber \]
El mecanismo de intercambio es común para muchos complejos metálicos de seis coordenadas (octaédricas). La característica distintiva que distingue al mecanismo de intercambio de otros mecanismos posibles es la ausencia de un intermedio detectable. Si se detecta un intermedio, el mecanismo se considera asociativo (A). Otra evidencia que puede indicar un mecanismo de intercambio son los cambios estereoquímicos de reactivo a producto. Si se cambia la esteroquímica específica (es decir, relaciones cis o trans), se puede tomar como evidencia de que existe un intermedio el tiempo suficiente para permitir que se produzca un reordenamiento.
Distinción de los Mecanismos A, D e I
La Figura\(\PageIndex{1}\) muestra ejemplos de posibles perfiles de reacción para cada uno de los mecanismos estequiométricos descritos anteriormente. El perfil de los mecanismos A y D puede ser similar; cada uno requiere un intermedio, y la diferencia primaria entre A y D es la secuencia de pasos. Un mecanismo I carece de un verdadero intermedio. Estos tres casos pueden ser difíciles de distinguir experimentalmente, y especialmente si la caracterización de un intermedio es difícil. Observe que el diagrama de coordenadas de reacción para las vías A y D, mostrado en la Figura\(\PageIndex{1}\), son similares. La única diferencia necesaria entre ellos está en la identidad de las especies intermedias.
Mecanismos íntimos
El mecanismo íntimo se define por las características del paso limitante de velocidad. La reacción se clasifica como activada asociativamente (usando un subíndice\(a\)) si la velocidad cambia más de 10 veces a medida que se varía el grupo entrante. La reacción se clasifica como activada de forma disociativa (usando un subíndice\(d\)) si la velocidad cambia en menos de 10 veces a medida que se varía el grupo entrante.
Mecanismos Activados Asociativamente
La etapa limitante de velocidad de una ruta activada asociativamente es la formación de un enlace entre el grupo entrante y el ion metálico central. Estas reacciones también requieren la formación de un complejo de encuentro en una etapa de preequilibrio antes de las etapas de formación de enlaces o ruptura de enlaces discutidas aquí (ver Mecanismo Eigen-Wilkins).
A e I activadas asociativamente (\(\ce{A_{a}}\)y\(\ce{I_{a}}\))
En el caso de una ruta asociativa activada asociativamente (\(\bf\ce{A_{a}}\)) o una ruta de intercambio activada asociativamente (\(\bf\ce{I_{a}}\)), el paso limitante de velocidad es la asociación del grupo entrante (Y) con el reactivo,\(\ce{ML_{n}X}\). En el caso de la\(\ce{A_{a}}\) vía, es el primer paso (en negrilla) a continuación.
\ [\ begin {array} {rcc}
&\ ce {A_ {a}}\ text {Mecanismo} &\\\ hline
\ textbf {Paso 1 (Asociación):} &\ bf\ ce {ML_ {n} X + Y <=> [k_1] [k_ {-1}] ML_ {n} XY} &\ Longleftarrow\ textbf {ASOCIACIÓN LIMITACIÓN DE TASA}\\
\ text {Paso 2 (disociación):} &\ ce {ML_ {n} XY & lt; => [k_2] [k_ {-2}] ML_ {n} Y + X}
\ end {array}\ nonumber\]
En el caso de\(\ce{A_{a}}\), el primer paso mostrado anteriormente es más lento que el segundo paso (\( k_1 < k_2\)). En este caso, es posible que no se detecte un intermedio porque su concentración en estado estacionario es cercana a cero (es decir, reacciona tan pronto como se forma). Por lo tanto, distinguir entre\(\ce{A_{a}}\) y\(\ce{I_{a}}\) mecanismos suele ser imposible.
D activado asociativamente (\(\ce{D_{a}}\))
En el caso de una reacción disociativa activada asociativamente (\(\bf\ce{D_{a}}\)), la etapa limitante de velocidad es la asociación del grupo entrante (Y) con el intermedio\(\ce{ML_{n}}\); la segunda etapa (en negrilla) en el mecanismo que se muestra a continuación:
\ [\ begin {array} {rcc}
&\ ce {D_ {a}}\ text {Mecanismo} &\\
\ hline\ text {Paso 1 (Disociación):} &\ ce {ML_ {n} X <=> [k_1] [k_ {-1}] ML_ {n} + X} &\
\ textbf {Paso 2 (Asociación):} &\ bf\ ce {ML_ {n} X + Y <=> [k_2] [k_ {-2}] ML_ {n} Y} &\ Longleftarrow \ textbf {ASOCIACIÓN DE LIMITACIÓN DE
VELOCIDAD}\ end {array}\ nonumber\]
En este caso, la concentración intermedia debe ser medible ya que el segundo paso es más lento que el primero (\( k_1 > k_2\)).
Dibuje los diagramas de coordenadas de reacción (también conocidos como perfiles de reacción) de las reacciones que proceden a través de\(\ce{A_{a}}\)\(\ce{I_{a}}\), y\(\ce{D_{a}}\) vías. Usa estos diagramas para explicar por qué es imposible distinguir entre\(\ce{A_{a}}\) y\(\ce{I_{a}}\).
- Insinuación
-
Observe que los diagramas de coordenadas de reacción para las vías A y D, mostrados en la Figura\(\PageIndex{1}\), son similares. La única diferencia necesaria entre ellos es la identidad del intermedio. Estos diagramas se pueden modificar para representar vías activadas asociativamente alterando la energía relativa del estado de transición para el paso asociativo; la barrera energética para el paso asociativo debe ser mayor que la del paso disociativo. En otras palabras, la diferencia entre\(\ce{A_a}\),\(\ce{D_a}\) está en las energías relativas del primer y segundo estados de transición. En el caso de\(\ce{I_a}\), el diagrama podría ser similar al perfil I mostrado en la Figura\(\PageIndex{1}\), con la excepción de que la barrera de energía para hacer el enlace M-Y es mayor que la barrera de energía para romper el enlace M-X.
- Contestar
-
Los tres diagramas de coordenadas de reacción mostrados en la siguiente figura representan\(\ce{A_{a}}\)\(\ce{I_{a}}\), y\(\ce{D_{a}}\) mecanismos respectivamente. Si tu diagrama no coincide perfectamente con esto, eso puede estar bien. Las características importantes son:
- \(\ce{A_{a}}\): Este perfil de reacción debe mostrar un intermedio con mayor número de coordinación que el reactivo. El intermedio debe ser relativamente estable. La barrera energética para la formación de este intermedio es el paso asociativo, y por lo tanto también debería ser el paso limitante de velocidad para un\(\ce{A_{a}}\) mecanismo; es decir, el primer paso debe tener la barrera energética más alta.
- \(I_a\): Este perfil de reacción debe carecer de un intermedio estable. La barrera de energía para la creación del enlace M-Y debe ser limitante de índice. El diagrama que se muestra a continuación es una solución aceptable, pero un diagrama como el que se muestra en el Panel C de la Figura también\(\PageIndex{1}\) es correcto. No queda claro solo del diagrama si la ruptura de enlaces o la creación de enlaces son limitantes de la velocidad; este matiz estaría principalmente en la identidad del estado de transición, y si el enlace M-Y es más fuerte o más débil que el enlace M-X en el estado de transición.
- \(\ce{D_{a}}\): Este perfil de reacción debe mostrar un intermedio con menor número de coordinación que el reactivo. El intermedio debe ser relativamente estable. La barrera energética para la asociación del grupo entrante con el intermedio (el segundo escalón) debe ser limitante de velocidad en un\(\ce{D_{a}}\) mecanismo. Es decir, el segundo paso debería tener la barrera energética más alta.
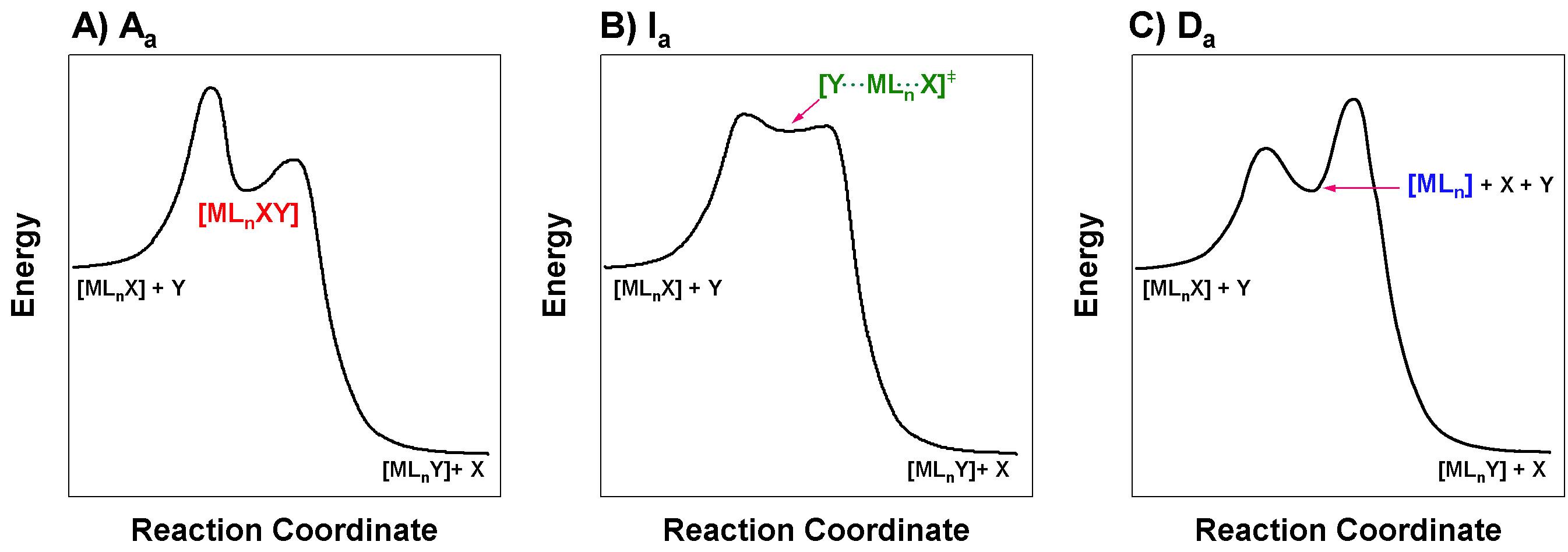
Figura para Excercise\(\PageIndex{1}\): Diagramas de coordenadas de reacción para mecanismos activados asociativamente. (A) Asociativo activado asociativamente,\(\ce{A_a}\). (B) Intercambio activado asociativamente,\(\ce{I_a}\). (C) Asociativamente activado disociativo,\(\ce{D_a}\). (CC-BY-SA; Kathryn Haas) Los\(I_a\) mecanismos\(\ce{A_{a}}\) y tienen diferentes perfiles de reacción, mientras que la etapa limitante de la velocidad es la asociación inicial del ligando entrante con el centro metálico. Estos dos tipos de mecanismos son difíciles de distinguir porque en el caso de\(\ce{A_{a}}\), existe una barrera energética relativamente pequeña para la reacción del intermedio para formar producto; así este intermedio no es de larga duración y sería difícil de detectar. La distinción experimental entre\(\ce{A_{a}}\) y\(I_a\) radica en la detección y caracterización de este intermedio, y dado que puede ser esquivo en\(\ce{A_{a}}\), es difícil determinar inequívocamente si un mecanismo activado asociativamente es\(\ce{A_{a}}\) o\(I_a\).
Mecanismos activados disociativamente
Cuando la etapa determinante de la velocidad es la ruptura de un enlace entre el ion metálico central y el grupo saliente, se considera un mecanismo activado disociativamente (subíndice\(d\)). Las velocidades de estas reacciones son en gran medida independientes de la identidad del ligando entrante.
A activado disociativamente (\(\ce{A_{d}}\))
En el caso de una vía asociativa activada disociativamente (\(\bf\ce{A_{d}}\)), la etapa limitante de la velocidad es la disociación del grupo saliente (X) del intermedio,\(\ce{ML_{n}XY}\); la segunda etapa (en negrilla) a continuación.
\ [\ begin {array} {rcc}
&\ ce {A_ {d}}\ text {Mecanismo} &\\
\ hline\ text {Paso 1 (Asociación):} &\ ce {ML_ {n} X + Y <=> [k_1] [k_ {-1}] ML_ {n} XY} &\
\ textbf {Paso 2 (Disociación):} &\ bf\ ce {ML_ {n} XY <=> [k_2] [k_ {-2}] ML_ {n} Y + X} &\ Longleftarrow\ textbf {DISXILIACIÓN DE LIMITACIÓN DE TARIFA}
\ end {array}\ nonumber\]
En este caso, la concentración intermedia debe ser medible ya que el segundo paso es más lento que el primero (\( k_1 > k_2\).
D e I activadas disociativamente (\(\ce{D_{a}}\)y\(\ce{I_{a}}\))
En el caso de una reacción disociativa activada por disociación (\(\bf\ce{D_{d}}\)), o una ruta de intercambio activada disociativamente (\(\bf\ce{I_{d}}\)), la etapa limitante de velocidad es la disociación del grupo saliente (X) del reactivo,\(\ce{ML_{n}X}\). Para\(\ce{D_{d}}\) el paso de limitación de velocidad es el primer paso (en negrilla) en el mecanismo que se muestra a continuación:
\ [\ begin {array} {rcc}
&\ ce {D_ {d}}\ text {Mecanismo} &\\
\ hline\ textbf {Paso 1 (Disociación):} &\ bf\ ce {ML_ {n} X <=> [k_1] [k_ {-1}] ML_ {n} + X} &\ Longleftarrow\ textbf {tasa limitante de disociación}\\
\ text {Paso 2 (Asociación):} &\ ce {ML_ {n} X + Y <=> [k_2] [k_ {-2}] ML_ {n} Y} &
\ end {array}\ nonumber\]
En el caso de\(\ce{D_{d}}\), el primer paso mostrado anteriormente es más lento que el segundo paso (\( k_1 < k_2\)y es posible que no se detecte un intermedio porque su concentración en estado estacionario es cercana a cero (es decir, reacciona tan pronto como se forma). Por lo tanto, distinguir entre\(\ce{D_{d}}\) y\(\ce{I_{d}}\) mecanismos suele ser imposible.
Debes completar Excercise\(\PageIndex{1}\) antes de intentar este ejercicio.
Dibuje los diagramas de coordenadas de reacción (también conocidos como perfiles de reacción) de las reacciones que proceden a través de\(\ce{A_{d}}\)\(\ce{I_{d}}\), y\(\ce{D_{d}}\) vías.
- Contestar
-
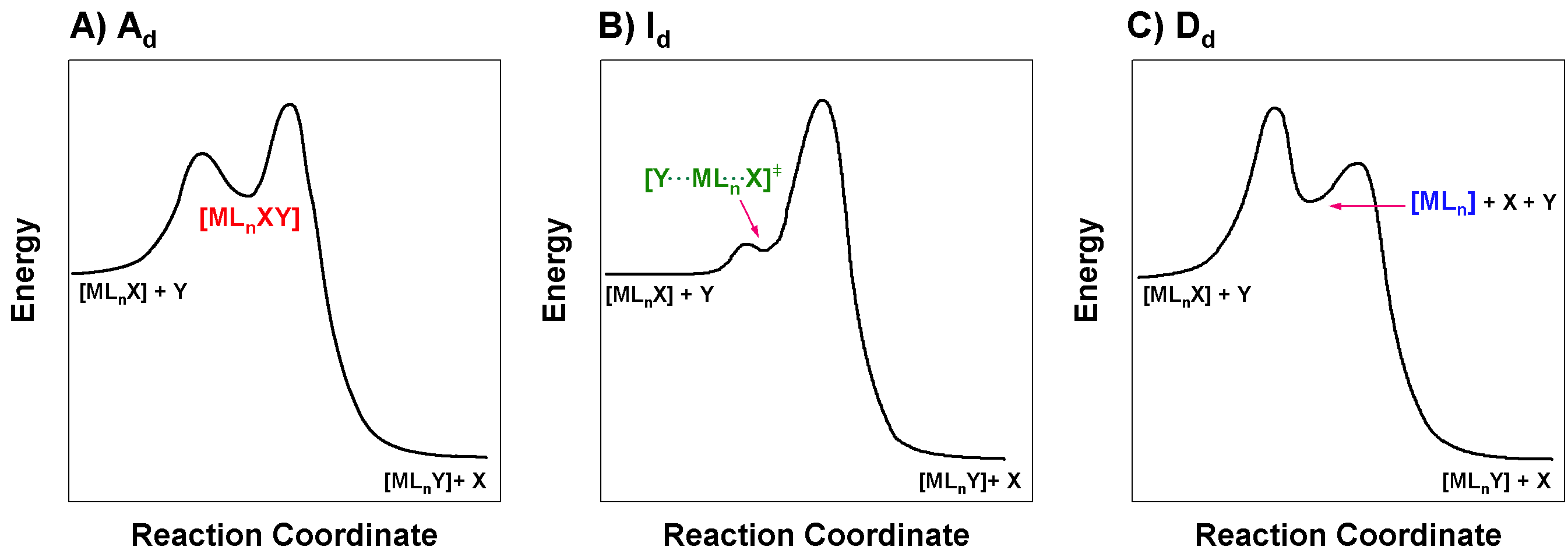
Figura para Excercise\(\PageIndex{2}\): Diagramas de coordenadas de reacción para mecanismos activados disociativamente. (A) Asociativo activado disociativamente,\(\ce{A_d}\). (B) Intercambio activado disociativamente,\(\ce{I_d}\). (C) Disociativamente activado disociativo,\(\ce{D_d}\). (CC-BY-SA; Kathryn Haas)
Modified by Kathryn Haas (khaaslab.com)


