12.3.6: Algunas razones para diferentes mecanismos
- Page ID
- 81487
Por lo general, buscamos razones físicas por las que un compuesto determinado puede sufrir una reacción a través de un mecanismo y no de otro. Esa habilidad se suma a nuestra comprensión de la química. Si podemos tomar información y darle valor predictivo, entonces podemos tomar decisiones educadas sobre lo que probablemente está sucediendo con nuevas reacciones.
¿Por qué una reacción podría sufrir una reacción disociativa en lugar de una asociativa? ¿Qué factores podrían impedir una vía asociativa?
Una razón puede ser que no hay suficiente espacio. En una etapa asociativa, entra un ligando adicional y se une al metal. Si ya está abarrotado, eso puede ser difícil.
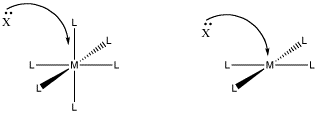
Figura\(\PageIndex{1}\): El papel del hacinamiento estérico en la sustitución de ligandos. En uno de estos casos, el mecanismo asociativo se ve menos favorecido por el hacinamiento que ocurrirá en el estado de transición.
- El hacinamiento estérico puede conducir a un mecanismo disociativo, más que asociativo.
Otra razón tiene que ver con la electrónica. Tal vez el compuesto no pueda aceptar fácilmente un par de unión adicional. Ese puede ser el caso si el compuesto ya tiene dieciocho electrones.
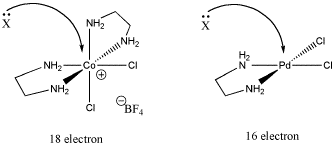
Figura\(\PageIndex{2}\): El papel del recuento de electrones en la sustitución de ligandos. En uno de estos casos, el mecanismo asociativo se ve menos favorecido porque el metal ya está saturado electrónicamente.
- La saturación electrónica puede conducir a un mecanismo disociativo, más que asociativo.
Sin embargo, si hay menos hacinamiento y se pueden acomodar más electrones, puede resultar una vía asociativa.
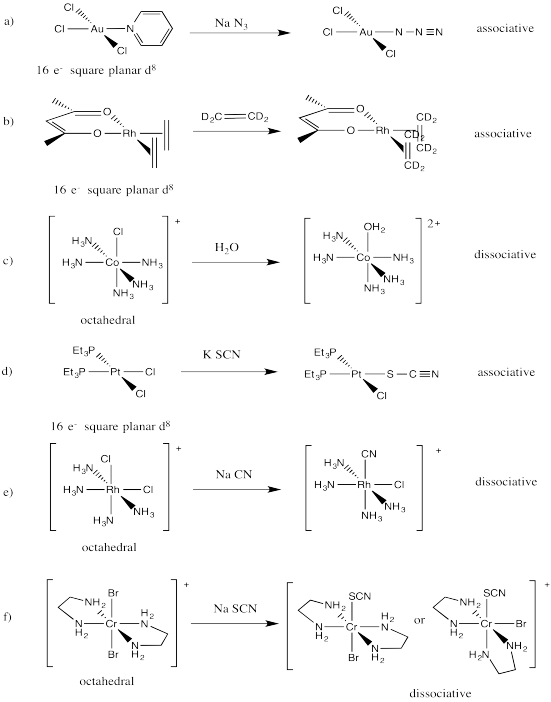
i) Dibujar estructuras para las siguientes reacciones. Presta atención a la geometría.
ii) Predecir si cada una de las sustituciones ocurriría a través de mecanismos asociativos o disociativos.
a) AUCl 3 py + Na N 3 → Na + [AUCl 3 N 3] - + py
b) Rh (C 2 H 4) 2 (acac) + C 2 D 4 → Rh (C 2 D 4) 2 (acac) + C 2 H 4
c) [Co (NH 3) 5 Cl] 2+ + H 2 O → [Co (NH 3) 5 (OH 2)] 2+ + Cl -
d) trans - (Et 3 P) 2 PtCl 2 + - SCN → trans - (Et 3 P) 2 PtCl (SCN) + Cl -
e) Rh (NH 3) 4 Cl 2 + + - CN → Rh (NH 3) 4 Cl (CN) + + Cl -
f) trans- [Cr (es) 2 Br 2] + + - SCN → cis- y trans- [Cr (es) 2 Br (SCN)] + + Br -
- Responder
-
Maurice Brookhart de UNC, Chapel Hill, elabora compuestos organometálicos con el fin de estudiar preguntas fundamentales sobre la reactividad. En este caso, ha reportado hacer un nuevo compuesto capaz de “activación C-H”, reacción en la que los enlaces C-H no reactivos pueden verse obligados a romperse. Este proceso tiene la promesa futura de convertir el carbón y el gas natural en importantes materias primas actualmente obtenidas del petróleo.
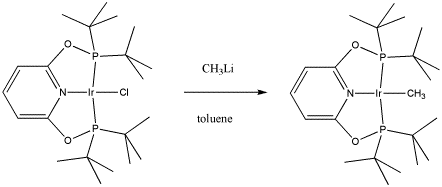
a) Dibujar, con flechas curvas, un mecanismo para la sustitución de ligandos en la síntesis de este complejo activador de C-H.
b) Explique sus razones para elegir el mecanismo de reacción.
- Responder
-

Bob Grubbs de Cal Tech fue galardonado con el Premio Nobel de Química por su desarrollo de catalizadores para metátesis de olefina. La metátesis de olefina es importante tanto en la reforma del petróleo como en la síntesis de productos importantes como los farmacéuticos. En el siguiente estudio, reemplazó cloruros en un “catalizador Grubbs Generación I” para estudiar el efecto sobre la reacción de metátesis de olefina.
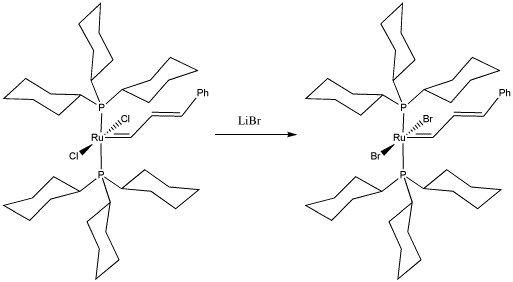
a) Dibujar, con flechas curvas, un mecanismo para la sustitución de ligandos en este complejo.
b) Explique sus razones para elegir el mecanismo de reacción.
c) ¿Qué factor (es) crees que Grubbs esperaba estudiar haciendo esta sustitución en el catalizador?
- Responder
-

A veces, los estudios cinéticos pueden dar una idea de una reacción si los cambios controlados en la reacción producen resultados medibles.
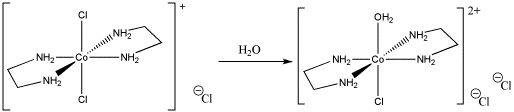
a) Dibujar, con flechas curvas, un mecanismo para la sustitución del ligando en esta reacción.
b) Explique sus razones para elegir el mecanismo de reacción.
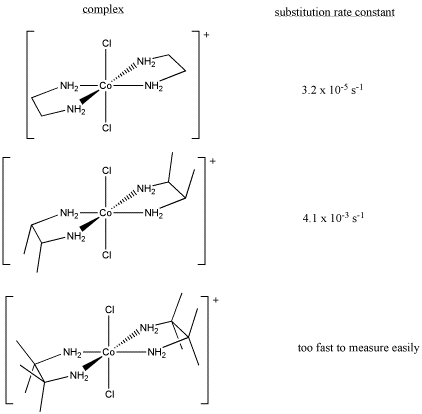
c) Explicar los siguientes datos cinéticos.
Se propusieron varias estructuras diferentes para Ni (cisteína) 2 2-. Los estudios cinéticos de sustitución en este complejo mostraron que la tasa dependía de la concentración tanto del complejo metálico como del ligando entrante. ¿Qué estructura crees que es la correcta? ¿Por qué?


