12.3.5: Parámetros de activación
- Page ID
- 81496
La ley de velocidad muestra cómo la velocidad de una reacción depende de las concentraciones de diferentes especies en solución. La constante de proporcionalidad, k, se denomina constante de velocidad. Contiene otra información sobre los requerimientos energéticos de la reacción.
Todas las reacciones deben superar las barreras de activación para que ocurran. La barrera de activación es la suma de la energía que se debe gastar para que la reacción vaya. A menudo se piensa en una barrera de activación, caricaturesamente, como una colina sobre la que la molécula tiene que trepar durante la reacción. Una vez, allí, puede simplemente deslizarse por el otro lado de la colina para convertirse en productos. En lo alto del cerro, la molécula existe en lo que se llama el “estado de transición”. En el estado de transición, la estructura se encuentra en algún lugar entre su forma original y la estructura de los productos.
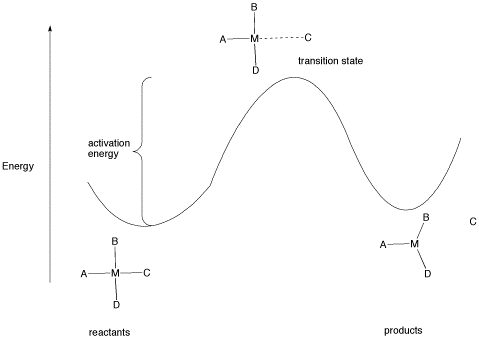
El tipo de diagrama que se muestra en la figura LS6.1 a veces se denomina “diagrama de progreso de reacción”. Muestra los cambios de energía en el sistema a medida que avanza una reacción. Una o más barreras de activación pueden ocurrir a lo largo de las vías de reacción, ya que varias etapas elementales ocurren en la reacción. En el caso anterior, es fácil imaginar la fuente de la barrera energética, porque se debe gastar algo de energía para romper el enlace con el ligando C.
No obstante, después de pasar esa barrera, la energía vuelve a bajar. Esto puede suceder por varias razones. Una vez que C se ha separado del complejo metálico, es libre de vibrar, voltear, enrollar y cerrar por completo por sí solo. Eso significa que puede poner su energía en cualquiera de esos modos, independientemente del complejo metálico. Como resultado, la entropía del sistema aumenta. Eso baja la “energía libre” general del sistema. Además, puede haber cierto alivio del hacinamiento ya que la molécula cambia de un complejo de cuatro coordenadas a un complejo de tres coordenadas, por lo que la energía de tensión también se reduce.
Haga dibujos que representen la relación entre el progreso de la reacción y la energía para los siguientes casos:
a) un nuevo ligando se une a un complejo de cuatro coordenadas, formando un complejo de cinco coordenadas.
b) un proceso de dos etapas en el que un nuevo ligando se une a un complejo de cuatro coordenadas, formando un complejo de cinco coordenadas, y luego un ligando antiguo se disocia para formar un nuevo complejo de cuatro coordenadas.
La constante de velocidad da una visión directa de lo que está sucediendo en el estado de transición, porque nos da la diferencia de energía entre los reactivos y el estado de transición. A partir de esa información, obtenemos algunas ideas de lo que está sucediendo en el camino hacia el estado de transición.
La constante de velocidad se puede descomponer en pedazos. Matemáticamente, a menudo se expresa como
\[k = (\frac{RT}{Nh}) e^{-\frac{\Delta G \ddagger}{RT}} \nonumber\]
En donde R = la constante de gas ideal, T = temperatura, N = número de Avogadro, h = constante de Planck y Δ G ‡ = la energía libre de activación.
La constante de gas ideal, la constante de Planck y el número de Avogadro son constantes típicas utilizadas para modelar el comportamiento de moléculas o grandes grupos de moléculas. La energía libre de activación es esencialmente el requerimiento de energía para conseguir que una molécula (o un mol de ellas) se someta a la reacción.
Tenga en cuenta que k depende de solo dos variables:
- Δ G ‡ o la energía requerida para la reacción
- T o la temperatura del entorno, que es un índice de la energía disponible
La relación entre la energía libre de activación y la temperatura compara las necesidades de energía con la energía disponible. Cuanta más energía esté disponible en comparación con la energía necesaria, menor será esta relación. Como resultado, la parte exponencial de la función se hace más grande (ya que la potencia tiene un signo menos). Eso hace que la constante de velocidad sea más grande, y la reacción se vuelve más rápida.
La energía libre de activación es constante para una reacción dada. Se puede desglosar a su vez para:
\[\Delta G^{\ddagger} = \Delta H^{\ddagger} -T \Delta S^{\ddagger} \nonumber\]
en el que Δ H ‡ = entalpía de activación y Δ S ‡ = entropía de activación.
La entalpía de activación es la energía requerida para la reacción. La entropía de activación trata de cómo se debe redistribuir la energía dentro de la molécula para que ocurra la reacción. Estos dos parámetros pueden ser útiles para comprender los eventos que conducen al estado de transición.
Por ejemplo, en la sustitución de ligandos, una vía asociativa está marcada por una baja entalpía de activación pero una entropía negativa de activación. La baja entalpía de activación resulta porque los enlaces no necesitan romperse antes del estado de transición, por lo que no cuesta mucho llegar allí. Eso es favorable y facilita la reacción. Sin embargo, una disminución en la entropía significa que la energía debe dividirse en menos estados. Eso no es favorable y hace que la reacción sea más dura. La razón por la que la energía debe redistribuirse de esta manera es que dos moléculas (el complejo metálico y el nuevo ligando) se están uniendo para formar una molécula más grande. Ya no pueden moverse independientemente entre sí, y toda su energía combinada debe redistribuirse conjuntamente, con un rango más limitado de estados vibracionales, rotacionales y traslacionales para usar con ese propósito.
- Vía asociativa: más creación de enlaces que ruptura de enlaces; necesidades de entalpía más bajas
- Vía asociativa: dos moléculas deben alinearse y unirse; menos grados de libertad para la distribución de energía; disminución de la entropía
Por otro lado, la vía disociativa está marcada por una mayor entalpía de activación pero una entropía positiva de activación. La mayor entalpía de activación resulta porque un enlace debe romperse en la etapa de determinación de la velocidad. Eso no es favorable. Sin embargo, la molécula se rompe en dos moléculas en el paso determinante de la velocidad. Estas dos moléculas tienen más grados de libertad en los que dividir su energía que lo hicieron como una sola molécula. Eso es favorable.
- Vía disociativa: más ruptura del enlace en el paso determinante de la velocidad, mayores necesidades de entalpía
- Vía disociativa: una molécula se convierte en dos moléculas en el paso determinante de la velocidad, mayores grados de libertad en dos moléculas que se mueven independientemente, aumenta la entropía
Por lo tanto, mirar los parámetros de activación puede revelar mucho sobre lo que está sucediendo en el estado de transición.
¿Qué factor (es) aparte de la entropía podría elevar la energía libre del estado de transición entrando en un paso asociativo entre un complejo metálico y un ligando entrante? (¿Qué factor podría hacer que el primer paso asociativo sea más lento que el segundo paso disociativo?)
- Contestar
-
El centro metálico está cada vez más abarrotado a medida que llega el nuevo ligando, por lo que un aumento de la energía debido al impedimento estérico también puede jugar un papel en la energía del estado de transición.
También son posibles otros mecanismos para la sustitución de ligandos. El siguiente caso se denomina intercambio asociativo (I A).
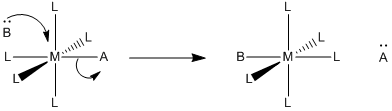
a) Describir con palabras lo que sucede en un intercambio asociativo.
b) Predecir la ley de velocidad para la reacción.
c) Predecir cualitativamente la entropía y entalpía de activación, en comparación con
i) un mecanismo asociativo y
ii) un mecanismo disociativo.
- Contestar a
-
El nuevo ligando, B, está llegando al mismo tiempo que el viejo ligando, A, se va. También podríamos describirlo como nuevo ligando B que empuja al viejo ligando A fuera del complejo.
- Respuesta b
-
\(Rate = k[ML_{5}A][B]\), que parece una ley de tasas asociativas.
- Respuesta c
-
Esta es una pregunta que incita a la reflexión sin una respuesta definitiva. Los mecanismos asociativos suelen tener menor entalpía de activación que los mecanismos disociativos, porque también ha habido alguna formación de enlaces antes de la ruptura del enlace en la etapa de determinación de la velocidad. El intercambio asociativo sería un poco más parecido al mecanismo asociativo que disociativo. La mezcla de formación de enlaces y rotura de enlaces en el estado de transición haría que la entalpía de activación sea relativamente baja.
Los mecanismos asociativos tienen entropías de activación negativas, mientras que los mecanismos disociativos tienen entropías de activación positiva. El intercambio asociativo podría estar entre ambos, dado que el paso elemental estaría cerca de entropicamente neutro en general. Lo que sucede en el estado de transición es un poco más difícil de imaginar, pero podría reflejar los pequeños cambios en la entropía a lo largo del curso de la reacción, produciendo una pequeña entropía de activación. Por otro lado, si el ligando entrante se ve obligado a adoptar algún enfoque específico a medida que entra en la molécula (para mantenerse fuera del camino del ligando que sale, por ejemplo) entonces esa restricción podría aparecer como una pequeña entropía de activación negativa.
Para el siguiente mecanismo:
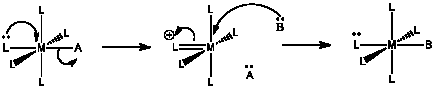
a) Describir con palabras lo que está sucediendo.
b) Predecir el paso determinante de la tasa.
c) Predecir la ley de velocidad para la reacción.
d) Predecir cualitativamente la entropía y entalpía de activación, en comparación con
i) tanto un mecanismo asociativo como
ii) un mecanismo disociativo.
e) Sugerir algunos ligandos que puedan hacer que se produzca este mecanismo.
- Contestar a
-
La donación de un solo par de un ligando parece empujar a otro ligando hacia afuera.
- Respuesta b
-
El primer paso es probablemente determinar la tasa, debido a la ruptura de bonos involucrada.
- Respuesta c
-
Si el primer paso es determinar la tasa,\(Rate = k [ML_{5}A]\).
- Respuesta d
-
Otra pregunta sin una respuesta muy clara. En comparación con un mecanismo asociativo, la entropía de activación es probablemente mucho más positiva, ya que se están ganando grados adicionales de libertad a medida que la molécula se dirige sobre la barrera de activación y uno de los ligandos se separa para estar solo. Sin embargo, la entropía de activación puede ser menos positiva que en una disociación regular, porque en este caso la ruptura de un enlace tiene que coordinarse con la formación de otro.
La entalpía de activación tiene tanto un componente de formación de enlaces como de rotura de enlaces, un poco como en un mecanismo asociativo. Sin embargo, la cantidad de unión que se hace aquí es probablemente menos importante, porque los enlaces pi normalmente no son tan fuertes como los enlaces sigma. La entalpía de activación es probablemente mayor que una vía asociativa pero no tan alta como la disociativa.
- Respuesta e
-
El ligando donante debe tener un par solitario. Los donantes de oxígeno serían buenos candidatos, porque incluso si un par solitario ya está donando en un bono sigma, un par solitario adicional puede estar disponible para la donación de pi. Lo mismo es cierto para los donantes de halógenos. También sería cierto para los donantes aniónicos de nitrógeno pero no para los donantes de nitrógeno neutro, porque un nitrógeno neutro tiene sólo un par solitario.


