12.7: El Efecto Trans
- Page ID
- 81516
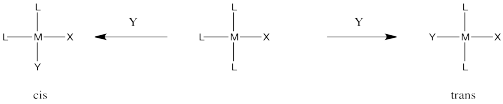
Ocasionalmente en la sustitución de ligandos hay una situación en la que hay dos ligandos idénticos que podrían ser reemplazados, pero resultarían dos productos diferentes dependiendo del ligando que quede. Esta situación suele ocurrir en complejos planos cuadrados, por ejemplo. El reemplazo de un ligando conduciría a un producto cis. La sustitución del otro conduciría a un producto trans.
Un ejemplo importante de este problema está en la síntesis de cis-platino, un medicamento antitumoral frecuentemente utilizado para tratar el cáncer de ovario y testicular.

El cis-platino podría elaborarse a partir del tratamiento de tetraaminaplatino (II) con sales de cloruro. El ion cloruro podría reemplazar a dos de los ligandos de amoníaco.
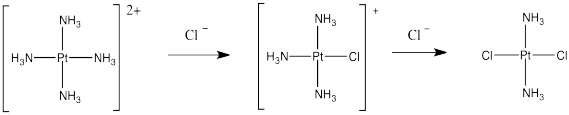
Pero eso no funciona. Esa síntesis da como resultado la formación de trans-platino, un compuesto que tiene todos los desagradables efectos secundarios del isómero cis pero sin ninguno de los beneficios terapéuticos.
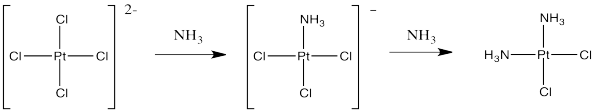
Si en cambio comenzaras con sales de tetracloroplatinato y las trataras con amoníaco, podrías reemplazar dos de los ligandos de cloruro. Eso funciona muy bien, y proporciona cis -platino, no trans -platino.
¿Cuál crees que es el mecanismo de sustitución de las dos reacciones anteriores? ¿Por qué?
- Contestar
-
Este es probablemente un mecanismo asociativo debido a la geometría plana cuadrada.
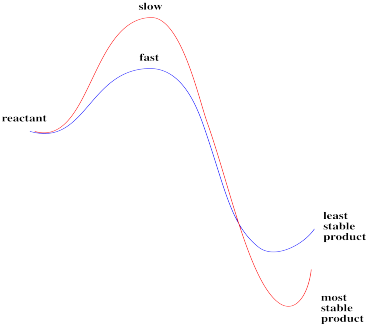
Esta reacción, si se realiza en estas condiciones, claramente no siempre está bajo control termodinámico. Resultan dos productos diferentes, dependiendo de cómo se haga la reacción. Uno de esos isómeros es probablemente más estable que el otro; si la termodinámica estuviera a cargo, formaría lo mismo en ambas ocasiones.
En cambio, puede haber un elemento de control cinético para al menos una de las vías. Un producto dado podría estar hecho, no porque sea más estable, sino simplemente porque se forma más rápido que el otro.
Échale otra mirada a esas dos reacciones. Una de las cosas que tienen en común es que el ligando que se reemplaza es trans a un cloruro. No es trans a un amoníaco. Tal vez los otros ligandos en el complejo puedan influir en la rapidez con la que un ligando puede salir.

Específicamente, el “efecto trans” es el papel de los ligandos trans en influir en las tasas de sustitución en complejos planos cuadrados.
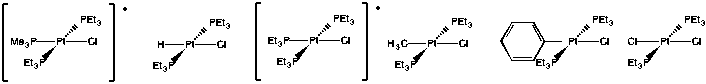
Se obtuvieron los siguientes datos cinéticos para las sustituciones en complejos de platino plano cuadrado, en la reacción:
\[trans-(PEt_{3})_{2}PtLCl + py \rightarrow trans-(PEt_{3})_{2}PtLpy^{+} + Cl^{-} \nonumber\]
| L | k obs (s -1) | T, °C |
| PMe 3 | 0.20 | 0 |
| H - | 0.047 | 0 |
| PET 3 | 0.041 | 0 |
| CH 3 - | 6.0 x 10 -4 | 25 |
| C 6 H 5 - | 1.2 x 10 -4 | 25 |
| Cl - | 3.5 x 10 -6 | 25 |
Ref: Cooper Langford & Harry Gray, Procesos de sustitución de ligandos, W.A. Benjamin, NY, 1965, p. 25.
Dibujar estructuras para cada uno de los complejos enumerados en la tabla.
- Contestar
-
Proporcionar un mecanismo con flechas para la reacción estudiada en la tabla.
- Contestar
-
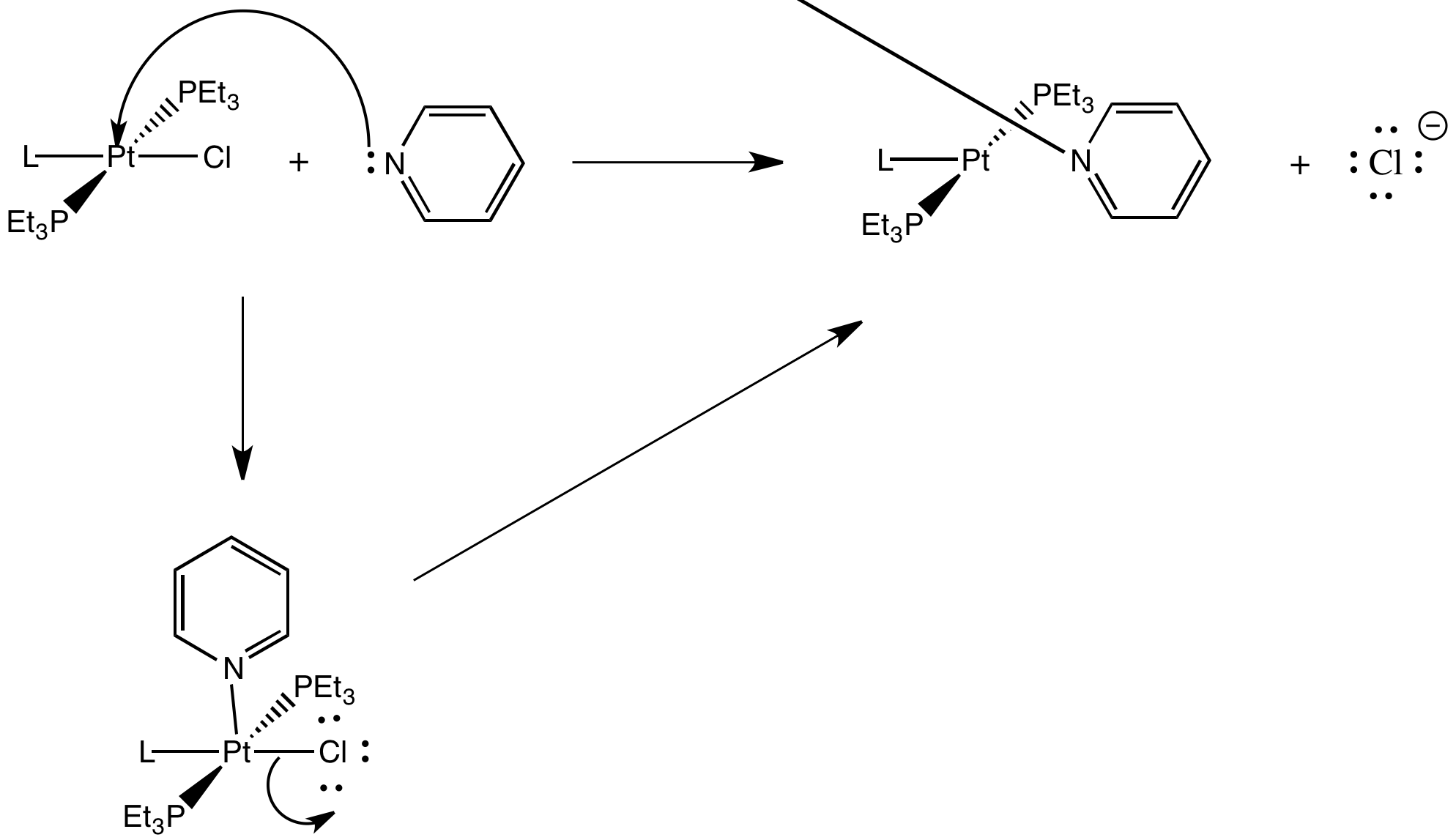
Claramente, ese ligando trans tiene un efecto dramático sobre la rapidez con la que se puede sustituir el cloruro en el estudio anterior. Estudios adicionales como este han dado lugar a algunas tendencias generales. Abajo, los ligandos de la izquierda tienen fuertes efectos trans. Los ligandos trans a ellos se sustituyen muy rápidamente. Los ligandos de la derecha tienen efectos trans muy modestos. Los ligandos trans a ellos se sustituyen solo lentamente.

Busque tendencias empíricas en la serie de ligandos anteriores. Sin tratar de explicar exactamente por qué, encontrar factores químicamente relevantes que puedan ser responsables de estas tendencias de reactividad.
- Contestar
-
Hay una tendencia de electronegatividad: cuanto menos electronegativa, mayor es el efecto trans (ver los halógenos, así como las series O, N, C y también los órdenes dentro de varios maridajes: S, P; O, S y N, P).
Alternativamente, algunos de los anteriores podrían describirse por una tendencia de polarizabilidad: átomo más polarizable, mayor efecto trans (por ejemplo, los halógenos).
La mayoría de los ligandos que contienen enlaces π tienen una fuerte influencia trans (pero no todos).
La mayoría de los donadores p tienen una influencia trans más débil. Sin embargo, estos ligandos cubren un rango muy amplio en esta serie.
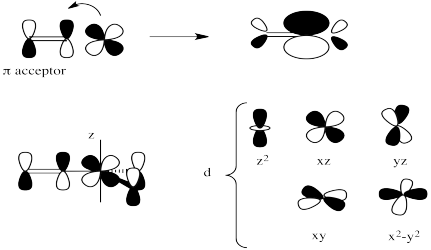
En general, las explicaciones del efecto trans se han centrado en dos tipos separados de ligandos. Se trata de donantes sigma fuertes y aceptores de pi fuertes.
Los donantes sigma fuertes donan electrones de manera muy efectiva al metal a través de un enlace sigma. Debido a que el ligando trans a este donante estaría uniendo vía donación al mismo metal p orbital, hay una competencia. El metal p orbital se une más favorablemente con el donante sigma fuerte, y el ligando trans a él se deja con un enlace más débil.
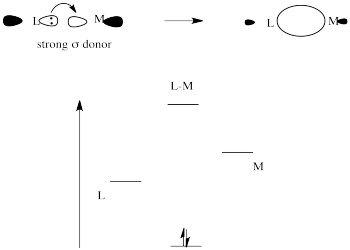
El donante sigma fuerte obtiene una buena superposición con la órbita metálica y la interacción resultante baja en energía.
El donante sigma débil obtiene una superposición más pobre con el orbital metálico y solo una débil estabilización de los electrones donantes.
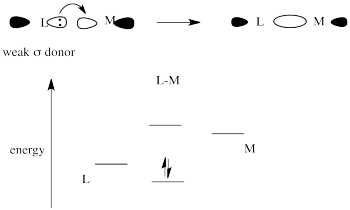
Coloque estas dos opciones juntas, y la órbita metálica se involucrará en una fuerte interacción de unión con el donador fuerte σ-donante. Hacerlo disminuye significativamente la energía electrónica. No interactuará mucho con el débil σ-donante, porque hacer eso no resultará en tanto descenso de la energía electrónica. El resultado es una unión fuerte en un lado del metal y una unión débil en el otro. Ese enlace débil se romperá fácilmente y ese ligando será reemplazado fácilmente.
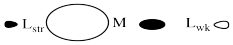
¿Cuáles de los ligandos de la serie de efectos trans son probablemente donantes de σfuertes? ¿Por qué?
- Contestar
-
Los donadores σmás fuertes son típicamente aquellos con átomos donadores más polarizables (como S, P, I) así como aquellos con menos iones donadores electronegativos como C - y H -.
Los aceptores de pi fuertes ejercen su efecto trans de una manera diferente. Se piensa que estabilizan una geometría particular del intermedio de cinco coordenadas en sustitución de complejos planos cuadrados. No nos hemos preocupado demasiado por la geometría de ese intermedio, pero probablemente sea trigonal bipiramidal. Tendría tres ligandos en un plano ecuatorial y dos más directamente opuestos entre sí, en las posiciones axiales.
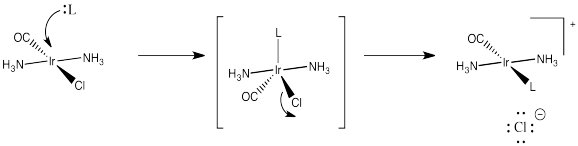
Esencialmente, el ligando entrante empuja dos de los ligandos hacia abajo desde el plano cuadrado para formar esta bipirámide trigonal. Cuando llegue el momento de que un ligando se vaya, probablemente va a ser uno de estos ligandos el que ya está en movimiento. Ya están en una trayectoria fuera del plano cuadrado, de todos modos.
Un aceptor de pi fuerte como el CO ejerce su efecto trans asegurándose de que, junto con el ligando opuesto, penetre en ese plano ecuatorial. Lo hace mediante una deslocalización estabilizadora que ocurre cuando el aceptor π está en el plano ecuatorial rico en electrones. En esa posición, puede extraer densidad de electrones vía π-donación de dos donantes diferentes. Si estuviera en una posición axial, aún podría deslocalizar electrones de esta manera, pero extraería más efectivamente de un solo donante en lugar de dos.
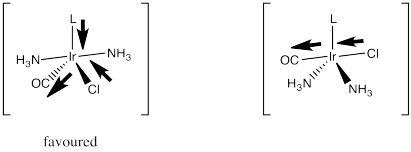
Entonces, ¿cuál de esos dos ligandos va a seguir moviéndose y dejará el complejo? Ciertamente no será el que esté ejerciendo un efecto estabilizador y deslocalizador sobre el complejo a través de sus fuertes interacciones de unión. Será el desafortunado ligando trans el que se arrastró junto con él.
¿Cuáles de los ligandos de la serie de efectos trans son probablemente aceptores π fuertes? Mostrar por qué.
Dibujar una imagen orbital que muestre la -deslocalización descrita en el intermedio bipiramidal trigonal. Etiquetar los orbitales, asumiendo que el eje z está a lo largo del eje de la bipirámide trigonal (es decir, el plano ecuatorial es el plano xy).
- Contestar
-
Sustitución de ligandos trans en complejos μ-oxo-bis (μ-acetato) dirutenio: Síntesis y estudios cinéticos. Hussain, Bhatt, Kumar, Thorat, Padhiyar y Shukla, Inorganica Chemica Acta, 2009, 362, 1101-1108.
Dada la estructura [Ru 2 O (L) 6 (acetato) 2] (PF 6) 2, en la que L es un donante neutro,
a) Dibujar la estructura del contraión, PF 6 -.
b) Dar cuenta del recuento de electrones de valencia en el complejo de coordinación de rutenio.
| Electrones de valencia sobre metal | |
| Carga total sobre ligandos | |
| Carga sobre el metal | |
| Recuento revisado de metal | |
| Electrones donados por ligandos | |
| Electrones totales en metal en complejo |
Los datos muestran que los ligandos L son trans al ligando puente oxo son lábiles.
c) Utilizar caricaturas orbitales y palabras para dar una explicación de este efecto.
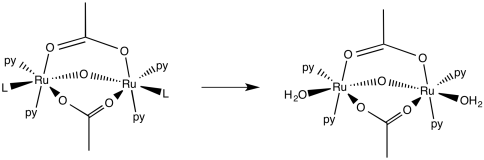
Cuando se añade agua a una solución de acetona de [Ru 2 O (piridina) 4 (L) 2 (acetato) 2] (PF 6) 2, luego [Ru 2 O (piridina) 4 (H 2 O) 2 (acetato) 2] (PF 6) 2 se forma.
d) Dibujar el producto de esta reacción.
Cuando se agrega piridina a [Ru 2 O (piridina) 4 (H 2 O) 2 (acetato) 2] (PF 6) 2, entonces se forma [Ru 2 O (piridina) 6 (acetato) 2] (PF 6) 2. Para esta reacción se observaron las siguientes constantes de velocidad.
| [piridina] mol L -1 | k s s -1 (x 10 -3) |
| 0.005 | 1.75 |
| 0.012 | 2.53 |
| 0.025 | 9.7 |
| 0.049 | 16.7 |
| 0.100 | 35.2 |
e) Utilizar los datos de esta tabla para determinar el orden en piridina. Proporcione una explicación para su conclusión.
f) Dibujar un mecanismo para la reacción, consistente con los datos.
g) Escribir una ley de velocidad para la reacción.
h) Los autores estudian la misma reacción con diferentes ligandos en lugar de piridina. Observaron un incremento en las constantes de velocidad al aumentar la basicidad de los ligandos entrantes. Dar una explicación para esta observación.
- Contestar a
-

- Respuesta b
-

- Respuesta c
-
El oxo es un donante sigma fuerte y engancha la órbita con el metal, dejando muy poco espacio para la unión orbital trans al donante sigma.
- Respuesta d
-
- Respuesta e
-
Primer orden. Aunque hay cierta cantidad de error en los datos, duplicar la concentración de piridina generalmente da como resultado una duplicación de la tasa.
- Respuesta f
-
El mecanismo que dibujas tendría que implicar un primer paso asociativo; debido a que el complejo ya es de 18 electrones, es probable que el intercambio asociativo sea.
- Respuesta g
-
\[Rate = k [ML_{n}][py] \nonumber\]
- Respuesta h
-
Los ligandos básicos tienen una atracción más fuerte hacia el metal, acelerando así la reacción.


