12.8.1: Transferencia de Electrones en la Esfera Exterior
- Page ID
- 81462
¿Cómo llega un electrón de un metal a otro? Esta podría ser una tarea más difícil de lo que parece. En bioquímica, un electrón puede necesitar ser transferido una distancia considerable. A menudo, cuando la transferencia ocurre entre dos metales, los iones metálicos pueden estar restringidos en sitios de unión particulares dentro de una proteína, o incluso en dos proteínas diferentes.
Eso significa que el electrón debe viajar por el espacio para llegar a su destino. Su capacidad para hacerlo generalmente se limita a unos pocos Angstroms (recuerde, un Angstrom es aproximadamente la distancia de un vínculo). Aún así, puede reaccionar con algo a unas pocas longitudes de enlace de distancia. La mayoría de las cosas necesitan chocar con una pareja antes de que puedan reaccionar con ella.
Este salto de larga distancia se llama transferencia de electrones de esfera externa. Los dos metales reaccionan sin ponerse en contacto nunca entre sí, sin meterse en las esferas de coordinación de los demás. Por supuesto, hay limitaciones a la distancia involucrada, y cuanto más lejos estén los metales, menos probable será la reacción. Pero una transferencia de electrones de esfera exterior parece un poco mágica.
Barrera a la reacción: una imagen cualitativa de la teoría de Marco
Entonces, ¿qué retiene al electrón? ¿Cuál es la barrera a la reacción? Rudy Marcus en Caltech ha desarrollado un enfoque matemático para comprender la cinética de la transferencia de electrones, en un trabajo que realizó a partir de finales de la década de 1950, analizaremos de manera muy cualitativa algunas de las ideas en lo que se conoce como “Teoría Marcus”. Un electrón es pequeño y muy rápido. Todos esos átomos grandes y pesados involucrados en la imagen son pesados y lentos. La barrera a la reacción tiene poco que ver con la capacidad del electrón para moverse, aunque incluso eso está limitado por la distancia. En cambio, tiene todo que ver con todas esas cosas que apenas se mueven en comparación con el electrón.
Imagínese que un ion de hierro (II) está pasando un electrón a un ion de hierro (III). Después de la transferencia de electrones, han cambiado identidades; el primero se ha convertido en un hierro (III) y el segundo se ha convertido en un ion hierro (II).
Nada podría ser más sencillo. El problema es que hay grandes diferencias entre un ion hierro (II) y un ion hierro (III). Por ejemplo, en un complejo de coordinación, tienen distancias de enlace muy diferentes. ¿Por qué es eso un problema? Porque cuando los electrones saltan, los dos átomos de hierro se encuentran en entornos de coordinación subóptimos.
Supongamos que un electrón se transfiere de un ion Fe (II) a un ion Cu (II). Describa cómo podrían cambiar las longitudes de los enlaces en cada caso y por qué. No te preocupes por cuáles son los ligandos específicos.
- Contestar
-
Los enlaces al hierro se contraerían porque el aumento de la carga sobre el hierro atraería más fuertemente a los electrones donantes del ligando. Los enlaces al cobre se alargarían debido a la menor carga sobre el cobre.
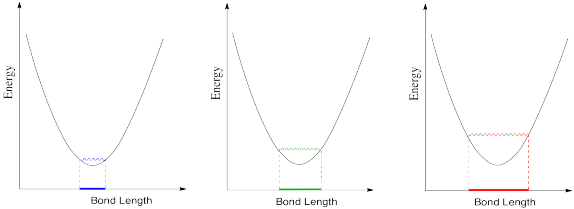
En realidad, una longitud de unión no es estática. Si hay un poco de energía alrededor, el enlace puede alargarse y acortarse un poco, o vibrar. A continuación se muestra una gráfica típica de la energía molecular frente a la longitud del enlace.

- ¿Por qué crees que la energía aumenta cuando el enlace se vuelve más corto de lo óptimo?
- ¿Por qué crees que la energía aumenta cuando el enlace se vuelve más largo de lo óptimo?
- En los siguientes dibujos, se está agregando energía a medida que avanzamos de izquierda a derecha. Describa lo que está sucediendo con la longitud del enlace a medida que aumenta la energía disponible.
- Contestar a
-
a) Lo más probable es que haya fuerzas repulsivas entre los ligandos si los enlaces se hacen demasiado cortos.
- Respuesta b
-
b) Un solapamiento insuficiente entre los orbitales de metal y ligando debilitaría el enlace y elevaría la energía.
- Respuesta c
-
c) El rango de posibles longitudes de enlace se hace más amplio a medida que aumenta la energía. El enlace tiene más latitud, con enlaces tanto más largos como cortos permitidos a mayor energía.
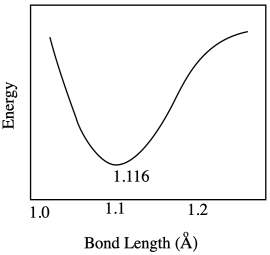
La longitud óptima del enlace C-O en una molécula de dióxido de carbono es de 1.116 Å. Dibuja una gráfica de lo que sucede con la energía interna cuando esta longitud de enlace varía entre 1.10 Å y 1.20 Å. No te preocupes por las etiquetas cuantitativas en el eje de energía.
- Contestar
-
El ángulo óptimo de enlace O-C-O en una molécula de dióxido de carbono es de 180°. Dibuja una gráfica de lo que sucede con la energía interna cuando este ángulo de unión varía entre 170° y 190°. No te preocupes por las etiquetas cuantitativas en el eje de energía.
- Contestar
-

La barrera a la transferencia de electrones tiene que ver con reorganizaciones de todos esos grandes átomos antes de que el electrón dé el salto. En términos de la esfera de coordinación, esas reorganizaciones implican vibraciones de enlace, y las vibraciones de enlace cuestan energía. Fuera de la esfera de coordinación, las moléculas solventes también tienen que reorganizarse. Recuerde, la estabilidad iónica está altamente influenciada por el medio circundante.
Dibujar un ion Fe (II) y un ion Cu (II) con tres moléculas de agua ubicadas en algún lugar entre ellos. No te preocupes por los ligandos en el hierro o el cobre. Mostrar cómo las moléculas de agua podrían cambiar de posición u orientación si un electrón es transferido del hierro al cobre.
- Contestar
-
Las moléculas de agua pueden pivotar hacia el Fe (III) más cargado, o pueden desplazarse más cerca de él debido a la atracción entre el ión y el dipolo de la molécula de agua.

Tenga en cuenta que tales ajustes también ocurrirían en disolventes no polares, aunque implicarían IMF más débiles como las interacciones dipolo inducidas por iones.
Por lo tanto, los cambios energéticos necesarios antes de que pueda ocurrir la transferencia de electrones implican una variedad de cambios, incluyendo longitudes de enlace de varios ligandos, ángulos de enlace, moléculas de disolvente, etc. Todo el sistema, que involucra a ambos metales, tiene algún conjunto óptimo de posiciones de mínima energía. Cualquier desviación de esas posiciones requiere energía añadida. En el siguiente diagrama de energía, el eje x ya no define un parámetro en particular. Ahora grumos todos los cambios en el sistema en un eje. Esta imagen es un poco más abstracta que cuando solo estamos mirando una longitud de enlace o un ángulo de enlace, pero el concepto es similar: hay un conjunto óptimo de posiciones para los átomos en este sistema, y requeriría una entrada de energía para alejar a cualquiera de ellos de su posición óptima.

Se piensa que este tipo de reorganizaciones —que involucran moléculas solventes, longitudes de enlace, geometría de coordinación, etc.— en realidad ocurren antes de la transferencia de electrones. Suceden a través de movimientos aleatorios de las moléculas involucradas. Sin embargo, una vez que han sucedido, no hay nada que retenga al electrón. Su movimiento es tan rápido que puede encontrarse inmediatamente en el otro átomo antes de que algo tenga la oportunidad de volver a moverse.
En consecuencia, la barrera a la transferencia de electrones es solo la cantidad de energía necesaria para que todos esos átomos pesados lleguen a algún conjunto de coordenadas que serían accesibles en el primer estado, antes de que se transfiera el electrón, pero que también serían accesibles en el segundo estado, después de que se transfiera el electrón .
Describir algunos de los cambios que contribuyen a la barrera a la transferencia de electrones en el siguiente caso.
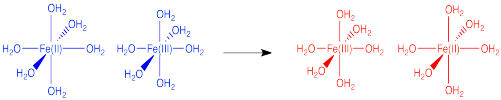
- Contestar
-
Los reactivos y productos son muy similares en este caso. Sin embargo, el complejo Fe (III) tiene enlaces más cortos que el complejo Fe (II) debido a la mayor interacción electrostática entre el ión metálico y los ligandos. Estos cambios en la longitud del enlace necesarios para prepararse para cambiar de Fe (III) a Fe (II) (o al revés) representan una barrera importante para la reacción.
En el dibujo a continuación, un electrón se transfiere de un metal a otro metal del mismo tipo, por lo que los dos están cambiando de estado de oxidación. Por ejemplo, podría ser una plancha (II) y una plancha (III), como se muestra en el problema anterior. En el estado azul, un hierro tiene el electrón extra, y en el estado rojo es el otro hierro el que tiene el electrón extra. La energía de los dos estados es la misma, y el potencial de reducción que implica esta transferencia es cero. Sin embargo, habría algunas reorganizaciones atómicas necesarias para ajustar los entornos de coordinación y solvatación a la transferencia de electrones. Los átomos del ligando y las moléculas de disolvente han cambiado en el cambio de un estado a otro, y así nuestras superficies de energía se han desplazado a lo largo del eje x para reflejar esa reorganización.
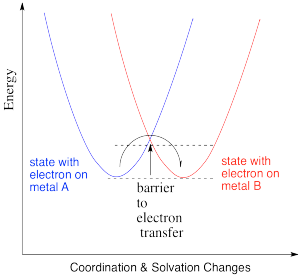
Ese ejemplo no es muy interesante, porque no formamos nada nuevo en el lado del producto. En cambio, imaginemos una transferencia de electrones de un metal a uno muy diferente. Por ejemplo, tal vez el electrón se transfiere del citocromo c al centro “cobre A” en la citocromo c oxidasa, una proteína importante involucrada en la transferencia respiratoria de electrones.

En el dibujo anterior, se incluyen algunas moléculas de agua entre los dos centros metálicos.
- Explique qué sucede con las moléculas de agua para permitir que se produzca la transferencia de electrones, y por qué.
- Supongamos que entre los complejos había un disolvente diferente, distinto del agua. ¿Cómo podría afectar eso la barrera a la reacción?
- Contestar a
-
a) El dibujo es una simplificación excesiva, pero en general las moléculas de agua se muestran reorientándose después de la transferencia de electrones debido a interacciones ión-dipolo. En este caso, las aguas se muestran orientándose para presentar sus extremos negativos al átomo de hierro más positivo después de la transferencia de electrones. En realidad, en una proteína hay muchas otras cargas (incluidas las cargas en el ligando) que pueden tomar parte en interacciones adicionales ión-dipolo.
- Respuesta b
-
b) Debido a que la transferencia de electrones es tan rápida, en realidad se piensa que las reorganizaciones atómicas y moleculares ocurren antes de la transferencia de electrones. Las moléculas de agua pasarían a cambiar a una posición que proporcionaría la mayor estabilización posible para los iones y luego se transferiría el electrón. Un disolvente menos polar que el agua sería menos capaz de estabilizar iones y el electrón sería más lento de transferir como resultado. Además, un disolvente menos polar que el agua sería un medio pobre para transmitir un electrón, el cual se carga y por lo tanto se estabiliza por interacciones con disolventes polares.
El diagrama de energía para el caso que involucra dos metales diferentes es muy similar, excepto que ahora hay una diferencia de energía entre los dos estados. El potencial de reducción ya no es cero. Asumiremos que el potencial de reducción es positivo, por lo que el cambio de energía libre es negativo. La energía baja tras la transferencia de electrones.
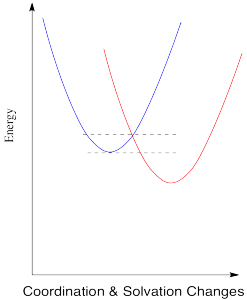
Compara esta imagen con la del caso degenerado, cuando el electrón se acaba de transferir a un nuevo metal del mismo tipo. Un potencial de reducción positivo (o un cambio negativo de energía libre) tiene el efecto de deslizar la superficie de energía para el estado rojo hacia abajo. Como resultado, el punto de intersección entre las dos superficies también se desliza hacia abajo. Dado que ese es el punto en el que el electrón puede deslizarse de un estado a otro, la barrera a la reacción disminuye.
¿Qué pasaría si el potencial de reducción fuera aún más positivo? Veamos en la imagen de abajo.

La tendencia continúa. Según esta interpretación de la cinética de la transferencia de electrones, cuanto más exotérmica sea la reacción, menor será su barrera. No siempre ocurre que la cinética rastrea junto con la termodinámica, pero esta podría ser una de ellas.
Pero, ¿es todo esto realmente cierto? Deberíamos echar un vistazo a algunos datos experimentales y ver si realmente funciona de esta manera.
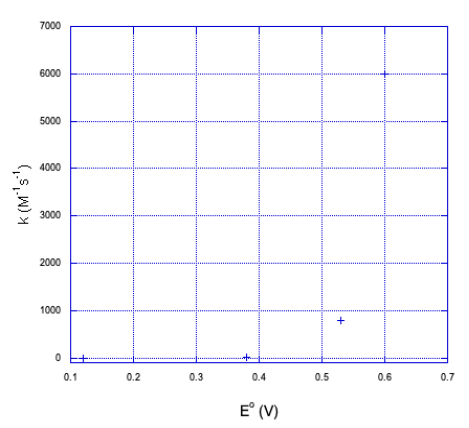
| Oxidante | E° | k (M -1 s -1) (margen de error mostrado entre paréntesis) |
|---|---|---|
| Co (dieno) (NH 3) 2 3+ | 0.12 | 3.0 (4) |
| Co (dieno) H 2 O) NCS 2+ | 0.38 | 11 (1) |
| Co (dieno) (H 2 O) 2 3+ | 0.53 | 800 (100) |
| Co (EDTA) | 0.60 | 6000 (1000) |
A medida que el potencial de reducción se vuelve más positivo, la energía libre se vuelve más negativa y la velocidad de reacción aumenta drásticamente. Hasta el momento, la teoría de Marcus parece hacer las cosas bien.
- Trazar los datos en la tabla anterior.
- ¿Cómo describirías la relación? ¿Es lineal? ¿Es exponencial? ¿Es directo? ¿Es inverso?
- Constante de tasa de trazado versus cambio de energía libre. ¿Cómo se compara esta gráfica con la primera?
- Contestar a
-
a) Aquí hay una gráfica de los datos.
- Respuesta b
-
b) No parece lineal. Si trazamos el eje y en una escala logarítmica, las cosas se vuelven un poco más lineales.
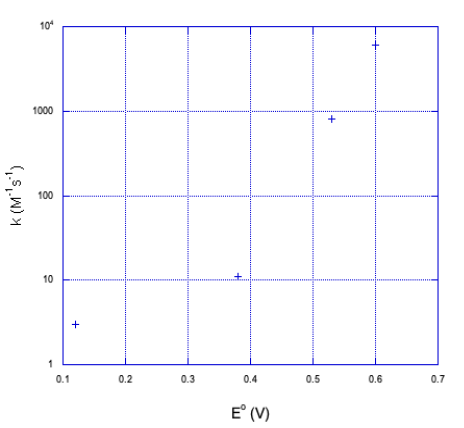
Se ve más cerca de una relación logarítmica que a una lineal.
- Respuesta c
-
c) Suponiendo una transferencia de electrones:
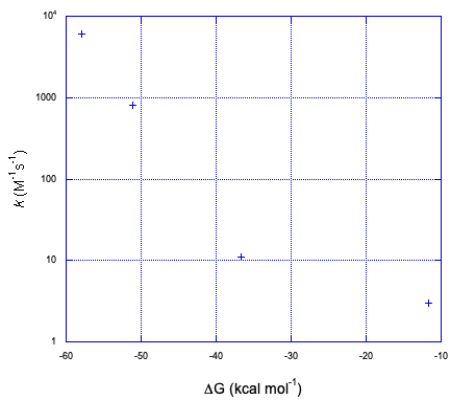
La gráfica toma la misma forma pero en dirección opuesta a lo largo del eje x.
Región Invertida Marcus
Sin embargo, cuando miras un poco más de cerca la teoría de Marcus, las cosas se ponen un poco extrañas. Supongamos que hacemos un cambio más y vemos qué sucede cuando el potencial de reducción se vuelve aún más positivo.
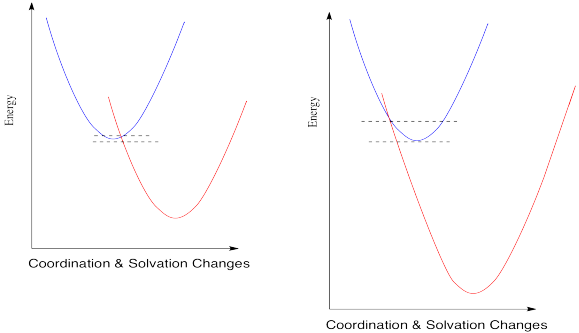
Entonces, si Marcus tiene razón, en algún momento a medida que el potencial de reducción sigue siendo más positivo, las reacciones comienzan a disminuir de nuevo. No solo alcanzan una velocidad máxima y se mantienen estables en esa meseta; la barrera se hace cada vez más alta y las reacciones se vuelven cada vez más lentas. Si te sientes un poco escéptico al respecto, estás en buena compañía.
Marcus siempre sostuvo que este fenómeno era un aspecto válido de la teoría, y no sólo alguna aberración que debía ignorarse. El hecho de que en realidad nadie hubiera observado tal tendencia no le molestó. La razón por la que no vimos este tipo de cosas, dijo, era que simplemente no habíamos desarrollado tecnología que fuera lo suficientemente buena para medir este tipo de tarifas con precisión.
Pero la tecnología sí se puso al día. Basta con echar un vistazo a los siguientes datos (de Miller, J. Am.Chem. Soc. 1984, 3047).

No te preocupes porque ya no hay metales involucrados. Una transferencia de electrones es una transferencia de electrones. Aquí, se envía un electrón desde la subestructura aromática de la derecha a la subestructura de la izquierda. Al variar la parte de la izquierda, podemos ajustar el potencial de reducción (o el cambio de energía libre, como se informa aquí.
- Trazar los datos en la tabla anterior.
- ¿Cómo describirías la relación?
- Contestar a
-
a)

- Respuesta b
-
b) Podemos ver dos lados de una curva invertida. La reacción se vuelve mucho más rápida a medida que la energía libre se vuelve más negativa, pero en algún momento la velocidad comienza a disminuir de nuevo.
A medida que la reacción se vuelve más exergónica, la velocidad aumenta, pero luego alcanza un máximo y vuelve a disminuir. Datos como estos significan que la “Región Invertida Marcus” es un fenómeno real. ¿Estás convencido? También lo fueron otras personas. En 1992, Marcus fue galardonado con el Premio Nobel de Química por esta obra.
Echa un vistazo a la molécula donante/aceptora utilizada en el estudio de Williams, arriba. a) ¿Por qué supone que el cambio de energía libre es bastante pequeño para los tres primeros compuestos de la tabla? b) ¿Por qué el cambio de energía libre sigue creciendo con respecto a los tres últimos compuestos de la tabla?
- Contestar
-
El compuesto aceptor se convierte en un anión cuando acepta un electrón. Los tres primeros compuestos no parecen ser fuertemente electrofílicos; pueden aceptar electrones simplemente por la estabilidad de resonancia del anión resultante. Los tres últimos tienen grupos extractores de electrones (cloros y oxígenos) que estabilizarían aún más el anión.
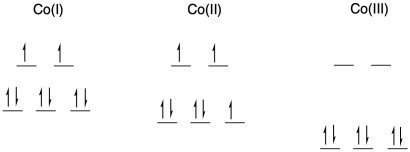
Las tasas de transferencia de electrones entre los complejos de cobalto del ligando bipiridilo bidentado, Co (bipy) 3 n+, dependen fuertemente del estado de oxidación en el par redox. La transferencia de electrones entre Co (I) /Co (II) ocurre con una constante de velocidad de aproximadamente 10 9 M -1 s -1, mientras que la reacción entre las especies de Co (II) /Co (III) procede con k = 18 M -1 s -1.
- ¿Qué geometría adoptan estos complejos?
- ¿Estas especies son de alto giro o bajo giro?
- Dibuja d diagramas de división orbital para cada complejo.
- Explique por qué la transferencia de electrones es mucho más fácil para el par Co (I) /Co (II) que para el par Co (II) /Co (III).
- Contestar a
-
a) octaédrico; bpy es un ligando bidentado.
- Respuesta b
-
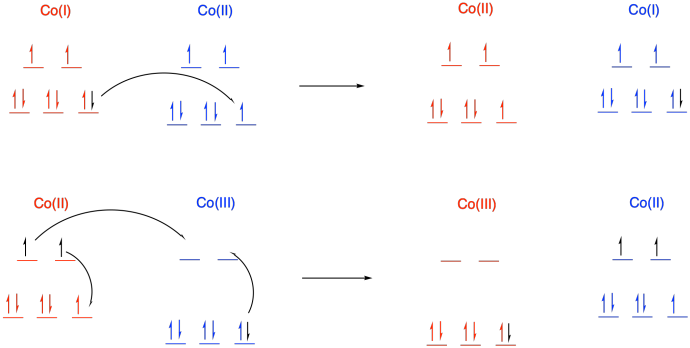
b) El Co es la primera fila; el Co (I) y el Co (II) tienen una carga relativamente baja. Por lo general, esperaríamos que fueran de alto giro. El Co (III) se encuentra en un punto de corte en la primera fila; es lo suficientemente electronegativo como para que generalmente tenga un giro bajo.
- Respuesta c
-
c)
- Respuesta d
-
d) En una transferencia de Co (II) a Co (III), se requiere una reorganización adicional debido a que el metal cambia entre espín alto y bajo. No sólo un electrón tiene que moverse de un metal a otro metal, sino que los electrones adicionales tienen que barajar de un orbital a otro sobre el mismo metal para acomodar el cambio. Estas reorganizaciones tienen una barrera, ralentizando la reacción.