12.8.2: Transferencia de electrones en la esfera interna
- Page ID
- 81461
En algunos casos, las transferencias de electrones ocurren mucho más rápidamente en presencia de ciertos ligandos. Por ejemplo, compare las constantes de velocidad para las siguientes dos reacciones de transferencia de electrones, involucrando casi exactamente los mismos complejos:
\[\ce{Co(NH3)6^{3+} + Cr^{2+} -> Co^{2+} + Cr^{3+} + 6 NH3} \: \: k = 10^{-4}M^{-1}s^{-1} \nonumber\]
\[\ce{Co(NH3)5Cl^{2+} + Cr^{2+} -> Co^{2+} + CrCl^{2+} + 6NH3} \: \: k=6 \times 10^{5} M^{-1}s^{-1} \nonumber\]
(Nota: los ligandos aqua se omiten por simplicidad. Los iones, a menos que se indique lo contrario, son complejos acuáticos).
Observe dos cosas: primero, cuando hay un ligando de cloruro involucrado, la reacción es mucho más rápida. Segundo, después de la reacción, el ligando cloruro ha sido transferido al ión cromo. Posiblemente, esos dos eventos forman parte del mismo fenómeno.
Mejoras de velocidad similares se han reportado para reacciones en las que otros ligandos haluro están involucrados en la esfera de coordinación de uno de los metales.
En la década de 1960, Henry Taube de la Universidad de Stanford propuso que los haluros (y otros ligandos) pueden promover la transferencia de electrones a través de efectos de puente. Lo que quiso decir fue que el ion cloruro podría usar uno de sus pares solitarios adicionales para unirse al ion cromo. Entonces estaría ligada a ambos metales al mismo tiempo, formando un puente entre ellos. Quizás el cloruro podría actuar como un conducto para la transferencia de electrones. El cloruro podría entonces permanecer unido al cromo, al que ya había formado un enlace, dejando atrás el cobalto.
Las transferencias de electrones que ocurren a través de ligandos compartidos por los dos metales sometidos a oxidación y reducción se denominan transferencias de electrones de “esfera interna”. Taube fue galardonado con el Premio Nobel de Química en 1983; el premio se basó en su trabajo sobre el mecanismo de las reacciones de transferencia de electrones.
Eche otro vistazo a las dos reacciones de transferencia de electrones que involucran el ion cobalto y cromo, arriba.
- ¿Qué geometría adoptan estos complejos?
- ¿Estas especies son de espín alto o bajo?
- Dibuja d diagramas de división orbital para cada complejo.
- Explique por qué la transferencia de electrones va acompañada de la pérdida de los ligandos de amoníaco del complejo de cobalto.
- El cloruro se pierde del complejo de cobalto después de la transferencia de electrones. ¿Por qué permanece en el cromo?
- Contestar a
-
a) octaédrica
- Respuesta b
-
b) En la primera fila, 2 + complejos son casi siempre de alto giro. Sin embargo, los complejos 3 + a veces son de bajo espín.
- Respuesta c
-
c)
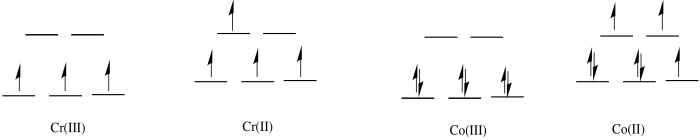
- Respuesta d
-
d) El complejo Co (II) es de alto espín y lábil. Los ligandos son fácilmente reemplazados por agua.
- Respuesta e
-
e) El complejo Cr (III) es solo d 3; es inerte.
Otros ligandos pueden estar involucrados en las transferencias de electrones de la esfera interna. Estos ligandos incluyen carboxilatos, oxalato, azida, tiocianato y ligandos de pirazina. Todos estos ligandos tienen pares solitarios adicionales con los que unirse a un segundo ion metálico.
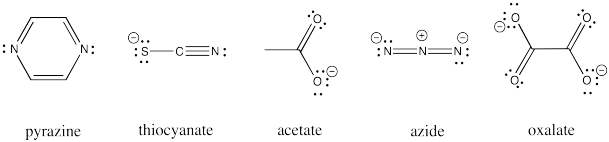
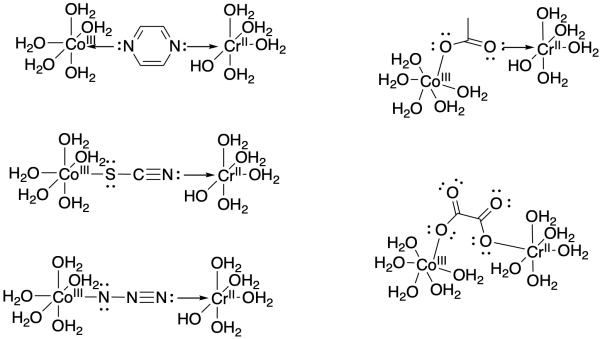
Dibuje un ejemplo de cada uno de los ligandos enumerados anteriormente que se unen entre un complejo aqua de cobalto (III) y cromo (II).
- Contestar
-
Explicar, con estructuras y d diagramas de división orbital, cómo se forman los productos en la siguiente reacción, en solución acuosa.
\[\ce{Fe(OH2)6^{2+} + (SCN)Co(NH3)5^{2+} -> (NCS)Fe(OH2)5^{2+} + Co(OH2)6^{2+} + 5NH3} \nonumber\]
- Contestar
-
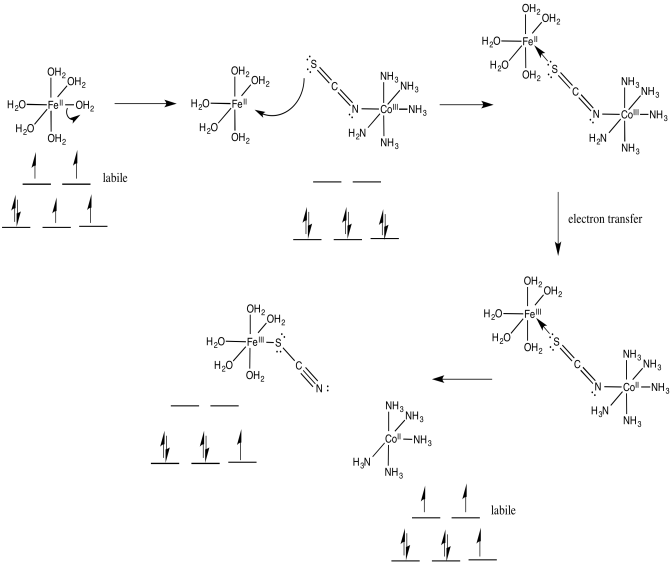
¿Cómo viaja el electrón sobre el puente?
Una vez que el puente está en su lugar, la transferencia de electrones puede realizarse a través de cualquiera de dos mecanismos. Supongamos que el ligando puente es un cloruro. El primer paso en realidad podría implicar una transferencia de electrones del cloro al metal; es decir, el cloruro podría donar un electrón de uno de sus pares solitarios ociosos. Este electrón podría ser sustituido posteriormente por una transferencia de electrones del metal al cloro.
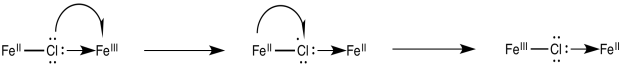
A veces, hablamos del lugar donde solía estar un electrón, describiéndolo como un “agujero”. En este mecanismo, el electrón donado del ligando de cloruro puente deja atrás un agujero. El agujero se llena entonces con un electrón donado del otro metal.
Alternativamente, un electrón podría transferirse primero del metal al cloro, que posteriormente pasa un electrón al otro metal. En el caso del cloro, esta idea puede ser insatisfactoria, porque el cloro ya tiene un octeto completo. Sin embargo, algunos de los otros ligandos puente pueden tener orbitales moleculares desocupados de baja altitud que podrían ser poblados por este electrón extra, temporalmente.
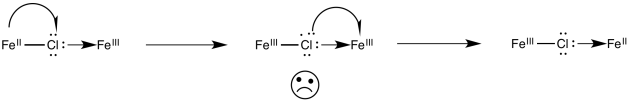
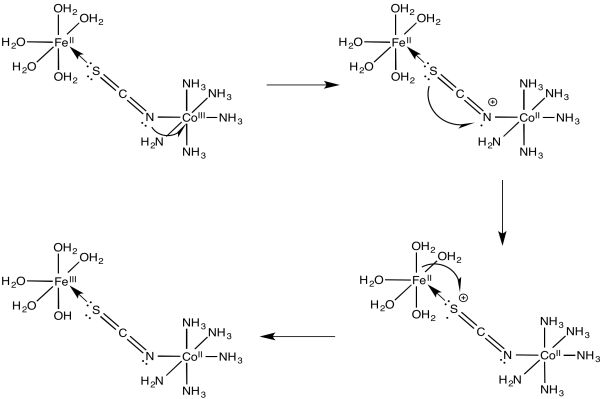
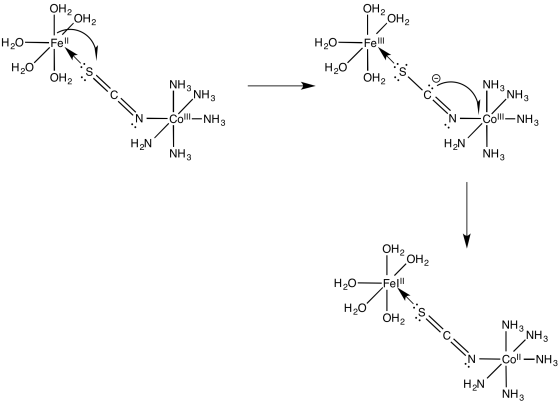
Para la transferencia de electrones hierro/cobalto en problema Ejercicio\(\PageIndex{3}\) (RO9.3.), mostrar
- un mecanismo de transferencia de electrones mediante una migración de agujeros a lo largo del puente
- un mecanismo de transferencia de electrones mediante una migración de electrones a lo largo del puente
- Contestar a
-
- Respuesta b
-
Una de las muchas contribuciones a la barrera para la transferencia de electrones entre iones metálicos es la reorganización electrónica interna.
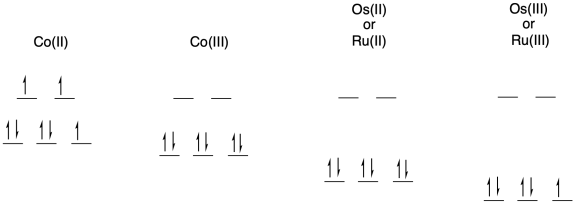
a) Dibujar d diagramas de división orbital para cada uno de los siguientes iones metálicos en un ambiente octaédrico.
Ru (II) u Os (II)
Ru (III) u Os (III)
Co (II)
Co (III)
La fotólisis instantánea es un método en el que un electrón se puede mover instantáneamente “cuesta arriba” de un metal a otro (por ejemplo, de M 2 II a M 1 III, a continuación); la tasa de transferencia de electrones se puede medir a medida que el electrón “cae” de nuevo de M 1 II a M 2 III.
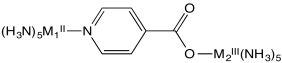
b) Explique las tasas relativas de reacción de transferencia de electrones en este sistema, medidas por fotólisis instantánea en la siguiente tabla.
| M 1 II | M 2 III | k obs s -1 |
| Os | Ru | > 5 x 10 9 |
| Os | Co | 1.9 x 10 5 |
c) ¿La reacción anterior probablemente ocurre a través de una esfera interna o por una vía de esfera externa? ¿Por qué?
- Contestar a
-
a)
- Respuesta b
-
b) La transferencia de electrones entre Os (II) y Ru (III) no implicará ninguna reorganización electrónica debido a que ambos son de espín bajo para empezar. Sin embargo, la transferencia de electrones entre Os (II) y Co (III) dará como resultado que el cobalto cambie de espín bajo a espín alto. La necesidad de mover electrones entre diferentes orbitales d sobre el cobalto se sumará a la barrera, ralentizando la reacción.
- Respuesta c
-
c) La vía es probablemente esfera interna debido al ligando puente. Además, la conjugación en el ligando puente ayudaría a conducir un electrón desde un extremo del ligando al otro, ya sea a través de un mecanismo electrónico o un mecanismo de agujero.
Las velocidades de transferencia de electrones de la esfera externa dependen del cambio de energía libre de la reacción (ΔG°) y la distancia entre oxidante y reductor (d) según la relación
Constante de velocidad =\(k = Ae^{(- \Delta G)} e^{-d}\)
a) ¿Qué sucede con la velocidad de reacción a medida que aumenta la distancia entre los reactivos?
Un problema potencial en la medición de las tasas de transferencia intramolecular de electrones (es decir, dentro de una molécula) es la competencia de la transferencia intermolecular de electrones (entre moléculas).
b) ¿Qué harías en el experimento de fotólisis flash anterior para desalentar la transferencia intermolecular de electrones?
c) ¿Cómo podría confirmar si tuvo éxito en desalentar la reacción intermolecular?
- Contestar a
-
a) La tasa disminuye exponencialmente a medida que aumenta la distancia.
- Respuesta b
-
b) Se podría mantener baja la concentración para aumentar la distancia entre las moléculas, reduciendo la probable campana de transferencia de electrones de una esfera externa.
- Respuesta c
-
c) Si ejecutara el experimento a una serie de diluciones, la transferencia intramolecular de electrones no se vería afectada pero la transferencia de electrones de la esfera externa no lo haría. Si las tasas fueran las mismas en diferentes concentraciones, la reacción probablemente sería intramolecular.
Stephan Isied y sus compañeros de trabajo de Rutgers midieron las siguientes tasas de transferencia de electrones entre centros metálicos separados por un péptido. (Chem Rev 1992, 92, 381-394)
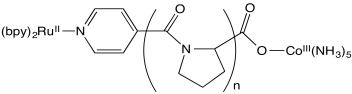
- La unidad repetitiva de prolina es crucial para asegurar un aumento constante de la distancia entre centros metálicos con unidades de repetición incrementadas, n. ¿Por qué?
- Se espera que una vía de esfera interna en este caso sea algo lenta debido a la falta de conjugación en el puente de poliprolina. Explique por qué.
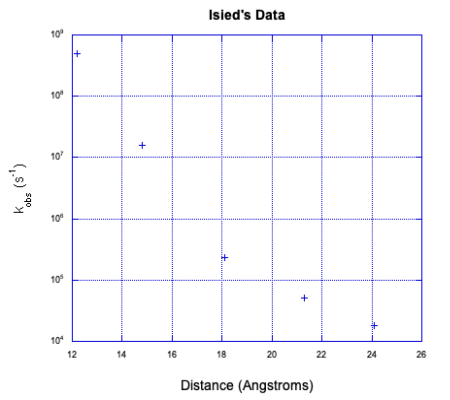
- Trace los datos a continuación, con log k en el eje y (rango de 4-9) y d en el eje x (12-24 Angstroms).
| n | d (Å) | k obs (s -1) |
| 1 | 12.2 | 5 x 10 8 |
| 2 | 14.8 | 1.6 x 10 7 |
| 3 | 18.1 | 2.3 x 10 5 |
| 4 | 21.3 | 5.1 x 10 4 |
| 5 | 24.1 | 1.8 x 10 4 |
d) Una relación lineal está de acuerdo con la teoría de Marcus; log k = - c x d. ¿Su trama es lineal?
Isied ofrece una serie de explicaciones posibles para los datos, todas las cuales involucran dos vías de reacción competitivas.
e) Sugerir una explicación para los datos.
- Contestar a
-
a) Los anillos se utilizan frecuentemente para introducir rigidez conformacional (o disminuir la flexibilidad conformacional), limitando el rango de formas potenciales que una molécula podría adoptar. Si la molécula no puede moverse tanto, entonces la distancia entre los extremos de la molécula debería ser más constante.
- Respuesta b
-
b) Aunque el ligando es puente, sería difícil imaginar un electrón o mecanismo de agujero de transferencia de electrones de esfera interna. Hay pocos enlaces pi o pares solitarios para usar como lugares para poner electrones o eliminar temporalmente electrones de, trasladando los electrones de un lugar a otro a lo largo del ligando. Un sistema conjugado sería mucho más probable que llevara a cabo la transferencia de electrones de la esfera interna.
- Respuesta c
-
c)
- Respuesta d
-
d) Los datos no son lineales.
- Respuesta e
-
e) Los datos parecen mostrar dos líneas que se cruzan. Ese es un síntoma clásico de dos mecanismos competidores. El mecanismo más rápido, a la izquierda, es probablemente una transferencia de electrones intramolecular. El mecanismo más lento, a la derecha, puede ser una transferencia de electrones intermolecular.


