13.2: Nomenclatura, Ligandos y Clasificación
- Page ID
- 81090
La nomenclatura de los compuestos de coordinación fue descrita en una sección anterior (Sección 9.2). Los compuestos organometálicos se nombran usando este mismo sistema, por lo que puede ser útil revisarlos antes de continuar. Aquí, señalaremos algunos de los símbolos y terminología que se utilizan mucho para nombrar complejos organometálicos.
Hapticidad
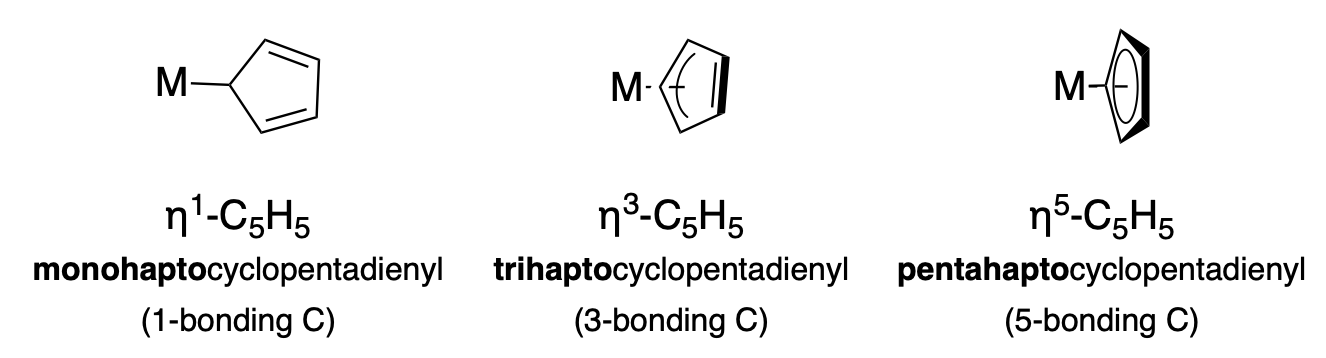
El símbolo eta (\(\eta\)) se utiliza para indicar la variable hapticidad de ligandos con\(\pi\) sistemas conjugados. Por ejemplo, el ligando del anión ciclopentadieno (Cp\(\ce{C_5H_5}\)) tiene la capacidad de coordinar un ion metálico de varias maneras debido a su\(\pi\) sistema conjugado cíclico. La hapticidad (el número de átomos involucrados en la interacción de enlace metálico) debe indicarse en la fórmula con la\(\eta ^n\) notación, y en el nombre con el prefijo apropiado. La figura\(\PageIndex{1}\) ilustra tres háptidades diferentes, y los símbolos y nombres de las fórmulas relevantes.
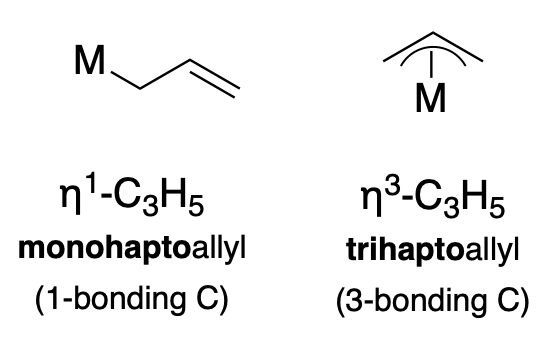
Otro ligando común es el anión\(\pi\) -alilo (\(\ce{C_3H_3}\)), que puede coordinarse de una\(\eta^3\) manera\(\eta^1\) o bien, como se ilustra a continuación (Figura\(\PageIndex{2}\)).
Ligandos de puente
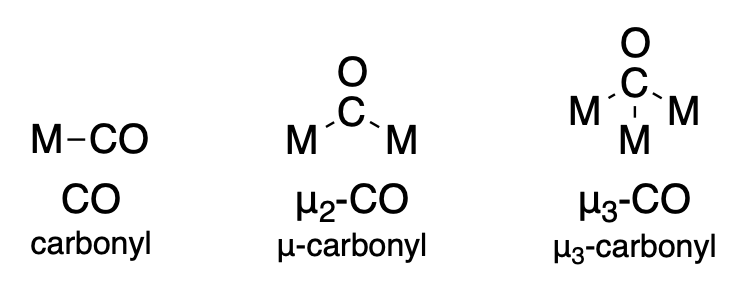
Los ligandos que unen dos o más iones metálicos se indican usando el símbolo, mu (\(\mu\)). Para un ligando que une iones\(n\) metálicos, el símbolo se escribe como\(\mu _n\). Sin embargo, el subíndice suele omitirse cuando\(n=2\). A continuación se dan algunos ejemplos del ligando carbonilo. Las reglas más específicas para nombrar se encuentran en la Sección 9.2.
Ligandos comunes y clasificaciones
Algunos ligandos orgánicos comunes que se encuentran en los compuestos organometálicos se enumeran a continuación con sus nombres y estructuras.
| Nombre | Estructura | Descripción de CBC |
|---|---|---|
| Alquilo | 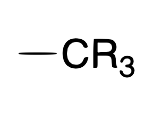 |
X |
| Carbonil | 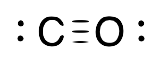 |
L |
| Carbeno (alquilido e ne) | 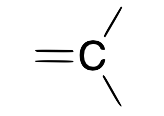 |
X 2 |
| Carbino (alquilido y ne) | 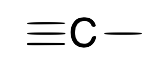 |
X 3 |
| Etileno | 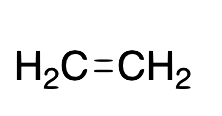 |
L |
| Acteileno | 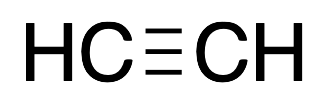 |
L |
| Acilo | 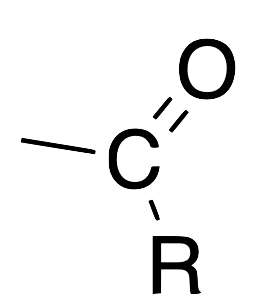 |
X |
| \(\pi\)-alilo (\(\ce{C_3H_5^-}\)) | 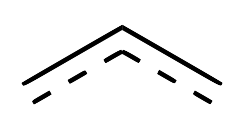 |
X para\(\eta^1\) LX para\(\eta^3\) |
| Ciclopropenilo (ciclo-\(\ce{C_3H_3}\)) |  |
X para\(\eta^1\) LX para\(\eta^3\) |
| Ciclobutadieno (ciclo-\(\ce{C_4H_4}\)) | 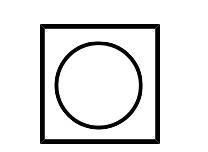 |
L 2 para\(\eta^4\) |
| Ciclopentadienilo (ciclo-\(\ce{C_5H_5}\), Cp) | 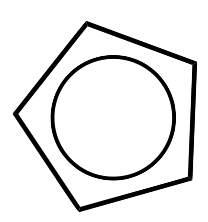 |
X para\(\eta^1\) LX para\(\eta^3\) L 2 X para\(\eta^5\) |
| Benceno | 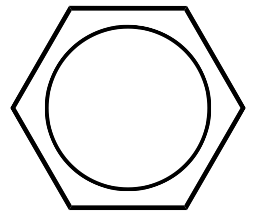 |
L 3 para\(\eta^6\) |
| 1,5-ciclooctadieno (1,5-DQO) | 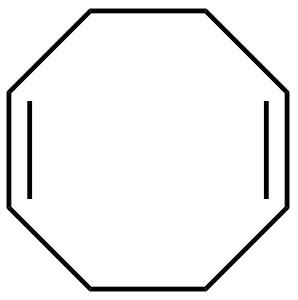 |
L 2 para\(\eta^4\) |
Método de clasificación de enlaces covalentes (CBC)
Más adelante en este capítulo, aprenderás a contar electrones. La forma en que cuentes depende del esquema de conteo que elijas usar. Pero en cualquier caso, la forma en que “contamos” los electrones de los ligandos depende del tipo de ligando. El método de clasificación de enlaces covalentes (CBC) ha estado en uso desde finales de la década de 1990 para clasificar ligandos en complejos organometálicos. Este método clasifica los ligandos en tres tipos principales de la siguiente manera. (ver Aplicación del Método de Clasificación de Enlace Covalente para la Enseñanza de la Química Inorgánica. Malcolm L. H. Green y Gerard Parkin, Revista de Educación Química 2014 91 (6), 807-816, DOI: 10.1021/ed400504f.)
| CBC Ligando Clase/Tipo | Ejemplos | Uso en el método de conteo de electrones con ligando neutro | Uso en el método de conteo de electrones por pares donantes |
|---|---|---|---|
| Tipo X | \(\ce{H^-, Cl^-, H_3C^-}\) | Considerado neutro Dona 1 electrón al metal |
Considerado aniónico Dona 2 electrones al metal |
| Tipo L | \(\ce{CO, NH_3, H_2O}\) | Considerado neutro Dona 2 electrones al metal |
Considerado neutro Dona 2 electrones al metal |
| Tipo Z (rara vez se usa) | \(\ce{BR_3}\), Ácidos de Lewis |
Considerado neutro Acepta 2 electrones |
Considerado catiónico dona 0 electrones |


