13.3.1: La regla de los 18 electrones
- Page ID
- 81078
Método A para el conteo de electrones: El Método de Par Donante
El método de pares donantes considera ligandos para donar pares de electrones al metal. Cada enlace ligando-metal se considera un par de electrones donados al metal por el ligando. El método consiste en los pasos descritos en el cuadro siguiente.
- Determinar el estado de oxidación del centro metálico. Esta etapa se puede hacer deconstruyendo primero el complejo para que cada ligando “mantenga” sus electrones unidos (Ver Figura\(\PageIndex{2}\)). al considerar la carga global del complejo y la carga de cada ligando, se puede determinar el estado de oxidación del centro metálico. Una alternativa a la deconstrucción es considerar la clase de cada ligando de acuerdo con el método de Clasificación de Enlace Covalente (CBC) discutido anteriormente.
- Determinar el número de electrones de valencia de iones metálicos. El número de electrones de valencia se puede determinar a partir del grupo del metal en la tabla periódica y su estado de oxidación. Si el estado de oxidación es positivo restamos electrones del número de grupo, si es negativo, lo cual es raro, entonces sumamos electrones.
- Determinar el número de electrones enlazados derivados de ligandos. Cada enlace sencillo de ligando proporciona dos electrones, los dobles enlaces proporcionan cuatro electrones, etc.
- Agregue el número de electrones de la valencia de iones metálicos (paso 2) al número de electrones unidos de los ligandos para obtener el recuento de electrones de valencia total para el complejo.
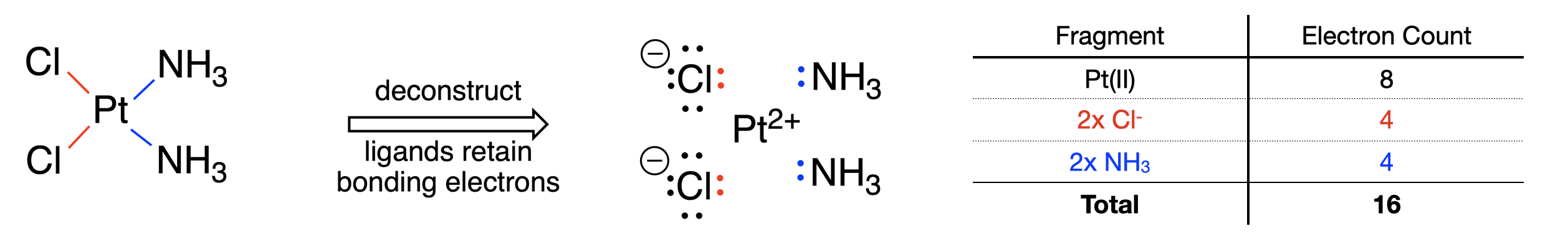
A continuación se muestra un ejemplo del uso del método de pares donantes para contar electrones en el fármaco de quimioterapia\(\ce{cis-[PtCl2(NH3)2]}\), también llamado cis-platino (Figura\(\PageIndex{1}\)). Este compuesto es neutro a cargo.
Paso 1: La deconstrucción del complejo usando el método del par donador convertiría cada enlace metal-ligando en un par de electrones en el ligando. Sin consultar el método de Clasificación de Enlace Covalente (CBC), podemos determinar la carga en cada ligando usando los diagramas de puntos de Lewis simples que resultan. Los ligandos consisten en dos amminas neutras y dos cloruros cargados negativamente. Los ligandos representan una carga negativa total de -2. Dado que el complejo metálico es neutro, debe haber un cambio +2 en el metal. Así, el estado de oxidación del metal es +2.
Paso 2: Con el conocimiento de que el Pt tiene un estado de oxidación de +2, y está en el grupo 10 de la tabla periódica, podemos determinar el número de electrones de valencia en Pt (II). Restar el estado de oxidación del número de grupo para obtener 8 electrones de valencia en el ion Pt (II).
Paso 3: Cada uno de los ligandos tenía un enlace a Pt, por lo que cada uno es un donante de 2 electrones. Los ligandos combinados aportan un total de 8 electrones.
Paso 4: Sumando los 8 electrones de Pt (II) y los 8 electrones de los ligandos da un recuento total de electrones de 16.
Método B para contar electrones: El método del átomo neutro (también conocido como método del ligando neutro)
El “método del átomo neutro”, a veces se llama “el método del ligando neutro”. En este método, se considera que cada ligando dona el número de electrones que haría si el ligando fuera neutro. El método del átomo neutro se lleva a cabo de acuerdo con las etapas que se describen a continuación.
- Determinar el número de electrones de valencia en el centro metálico, como si se tratara de un átomo neutro. Sumar esos electrones al recuento total.
Pista: El número de electrones de valencia es el mismo que el número de grupo del metal de transición en la tabla periódica (grupos 3-12 para los metales de transición). - Dar cuenta de la carga iónica en todo el complejo de coordinación. Si la carga es neutral, puede ignorar este paso. Si el complejo tiene una carga positiva, restas tantos electrones del recuento total. Si el complejo es un anión, se agrega la carga aniónica al recuento total de electrones.
- Determinar cuántos electrones son aportados por cada ligando. (Este es el paso más complicado)
- Deconstruir el ion metálico (romper sus enlaces M-L) para que cada fragmento de ligando resultante y el metal central sean neutros.
- Luego cuente el número de electrones de cada ligando que contribuyeron al enlace. Sumar la suma de esos electrones de todos los ligandos al recuento total.
(Recuerda que ya has contabilizado los electrones del átomo neutro en el paso #1)
- Agregar los electrones de valencia de iones metálicos (paso 1), los electrones ligando totales (paso 3), y contabilizar la carga del complejo (paso 2). La suma total es el recuento de electrones de valencia total para el complejo metálico.
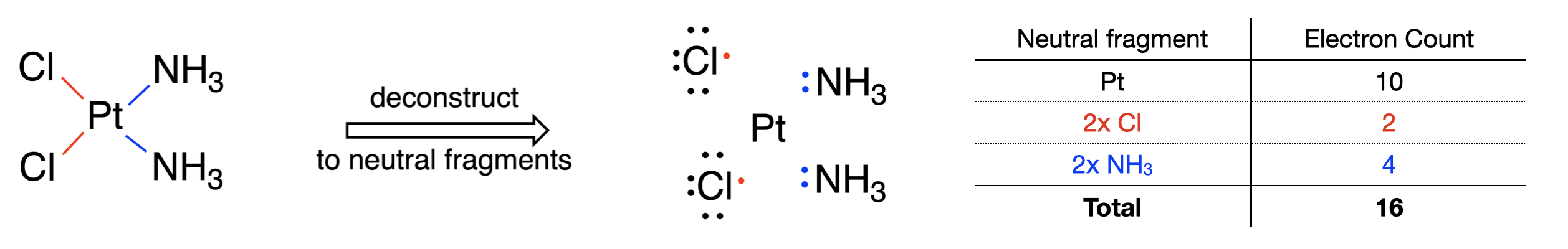
A continuación se muestra un ejemplo de aplicación del método de átomos neutros para contar electrones en el complejo cis-platino (\(\ce{[Pt(Cl)_2(NH_3)_2]}\)(Figura\(\PageIndex{2}\))).
Paso 1: El metal es platino el cual se encuentra en el grupo 10 de la tabla periódica. Por lo tanto, un átomo de platino neutro tiene diez electrones de valencia.
Paso 2: El complejo es neutral, esto podemos ignorar este paso.
Paso 3: Se considera que cada Cl dona 1 electrón y se considera que cada ligando de amina dona dos electrones. Los Cl donan un total de dos electrones, y las minas donan un total de cuatro electrones para dar un total de 6 de todos los ligandos.
Paso 4: Diez electrones de Pt y seis electrones de los ligandos se combinan para dar un recuento total de electrones de 16.
Hay pros y contras en cada uno de los métodos presentados anteriormente. El método del átomo neutro tiene la ventaja de que no tenemos que calcular las cargas de los ligandos o los estados de oxidación del metal para llegar a la respuesta final. Sin embargo, la desventaja es que debemos pensar en cómo escindir enlaces para crear fragmentos neutros. Es posible que necesitemos escindir los vínculos de una manera que sea contraria a la verdadera naturaleza donador-aceptor de un complejo de coordinación. El método donador-par da cuenta de la naturaleza donador-aceptor de un compuesto de coordinación porque los enlaces se consideran enlaces dativos, y los electrones se asignan a los ligandos y metales en consecuencia. Y la ventaja del método donor-pari es que no necesitamos pensar en cómo escindir los enlaces de manera artificial porque escindemos los enlaces siempre heterolépticamente. Sin embargo, la desventaja es que requiere que se calcuen cargas en los ligandos para determinar los estados de oxidación del metal, lo que es un paso adicional, no trivial.
La regla de los 18 electrones
El conteo de electrones es un paso crítico en el contexto de una regla importante en la química de coordinación: La regla de los 18 electrones. La regla de 18 electrones establece que los complejos de metales de transición son normalmente más estables cuando tienen un recuento total de 18 electrones en la capa de valencia. En otras palabras, para los complejos metálicos\(d\) -bloque, una configuración de valencia que llena todos los orbitales de valencia (\(ns^2 \; (n-1)d^{10} \; np^6\)) es más estable; es equivalente a una configuración nobel-gas para el átomo metálico, y es análoga a la “regla del octeto” para los elementos del grupo principal. Los complejos que tienen 18 electrones en su conteo se consideran coordinadamente sa turados. En general, los compuestos coordinadamente saturados se consideran relativamente estables, y cuando reaccionan suelen sufrir reacciones de disociación u oxidación que disminuyen el recuento de electrones. Si hay menos de 18 electrones, la especie está coordinadamente insaturada, y se considera menos estable que una especie con 18 electrones. En general, los complejos coordinativamente insaturados tienden a reaccionar de formas que pueden aumentar el recuento de electrones. Suelen sufrir reacciones que involucran asociaciones para agregar más electrones al sistema y/o tienden a ganar electrones a través de reacciones redox (el metal se reduce). Si una especie tiene más de 18 electrones está coordinadamente sobresaturada y tiende a perder ligandos. Por lo general, se oxida fácilmente. Tanto la pérdida de ligandos como la oxidación reducen al número de electrones a o al menos más cerca de 18.
Coordinativamente saturado: cuando el complejo tiene un recuento de electrones =18 electrones. Estos complejos se consideran más estables.
Coordinativamente insaturado: cuando el complejo tiene un recuento de electrones <18 electrones. Estos complejos tienden a añadir más ligandos, y a reducirse.
Coordinativamente sobresaturado: cuando el complejo tiene un recuento de electrones >18 electrones. Estos complejos tienden a perder ligandos y a oxidarse.
Excepciones a la regla de 18 electrones:
La regla de los 18 electrones tiene muchas excepciones y, por lo tanto, debe aplicarse con precaución. En particular, los complejos de los grupos 3, 4 y 10 se desvían a menudo de la regla de los 18 electrones.
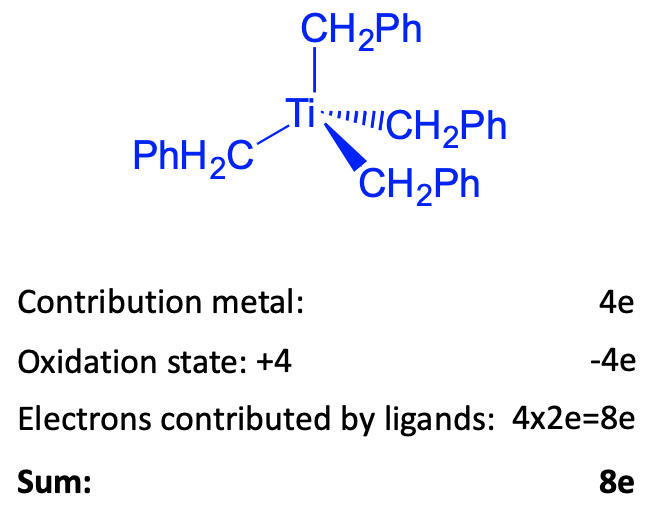
Para fines ilustrativos, contemos el número de electrones del complejo tetraédrico tetrabenciltitanio (0) mediante el método del estado de oxidación. También podríamos usar el método del átomo neutro, que daría los mismos resultados. Este complejo es un complejo del grupo 4 porque el titanio está en el grupo 4. ¿Cuántos electrones aportará el titanio? Debido a que el número de electrones es siempre el mismo que el número de grupo, aportará cuatro electrones. A continuación, ¿cuál es el estado de oxidación del Ti? Para determinarlo debemos determinar la carga en los ligandos. Para ello escindimos los enlaces heterolépticamente. Esto dará aniones bencilato con -1 carga. Hay cuatro de estos iones, y por lo tanto habrá cuatro cargas negativas en general. El complejo es de carga neutra, y por lo tanto el estado de oxidación es +4 porque -4+4=0. Por lo tanto, necesitamos restar cuatro electrones. Debido a que escindimos el enlace heterolépticamente, cada ligando aporta dos electrones, dando en general ocho electrones provenientes de los cuatro ligandos. Esto significa que tenemos en general ocho electrones, o un complejo de 8 electrones. Esto está muy, muy lejos de 18 electrones. Sin embargo, el complejo es estable. ¿Cómo podemos explicar esto? La respuesta es que para lograr 18 electrones se necesitaría agregar cinco ligandos adicionales si cada ligando es considerado un donante de 2 electrones. Esto aumentaría el número de coordinación a 9 que es demasiado alto para producir un complejo estable. Para reducir el complejo a un complejo de 18 electrones, se necesitarían agregar 10 electrones. Esto produciría un complejo con una carga -10 que es muy alta para ser estable. Los argumentos son generalizables para los complejos del grupo 3 y del grupo 4. Debido a que estos elementos solo tienen unos pocos electrones d, los ligandos necesitarían aportar muchos electrones para producir un complejo de 18 electrones. Esto requeriría simplemente demasiados ligandos para agregar. Los números de coordinación se pondrían demasiado altos. Si se agregan electrones en lugar de ligandos, la carga negativa en el complejo sería demasiado alta para ser estable en base a argumentos de repulsión electrón-electrón.
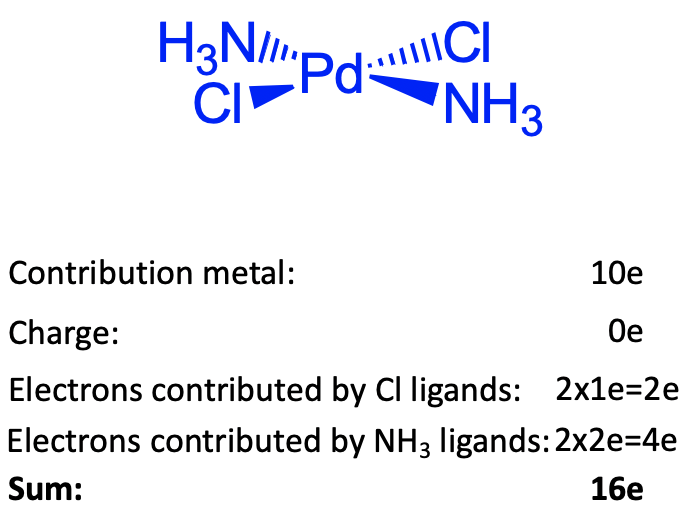
Estos argumentos no pueden aplicarse para los elementos del grupo 10, porque estos elementos tienen muchos d electrones. La explicación en este caso es que a estos elementos les gusta hacer complejos planos cuadrados cuando en el número de oxidación es +2. Los complejos planos cuadrados prefieren 16 en lugar de 18 electrones. Aprenderemos más adelante, cuando discutamos la vinculación en los compuestos de coordinación, por qué es esto. Se puede ver que el complejo de diamminedicloropaladio plano cuadrado que se muestra es plano cuadrado y tiene dieciséis electrones. Hay 10 electrones provenientes de Pd. Si usamos el método del átomo neutro, no es necesario agregar ni restar electrones debido a la carga en el complejo. El complejo es de carga neutra. Para evaluar cuántos electrones provienen de los ligandos necesitamos escindir los enlaces para que se produzcan ligandos neutros. Los enlaces Pd-Cl necesitan ser escindidos homolépticamente, los enlaces Pd-N necesitan ser escindidos heterolépticamente. Por lo tanto, los dos ligandos de cloro son donadores 1e, y los dos ligandos de amina son donantes 2e. Esto da 10+4+2 = 16 electrones.


