13.3.2: Simplificación del Complejo Organometálico por Deconstrucción
- Page ID
- 81079
Los complejos organometálicos, que consisten en metales ubicados en el centro y compuestos orgánicos periféricos llamados ligandos, son los caballos de batalla de la química organometálica. Al igual que los intermedios orgánicos, entender algo sobre la estructura de estas moléculas nos dice mucho sobre su reactividad esperada. Algunos esperaríamos que fueran estables, ¡y otros definitivamente no! Gran parte de nuestras primeras exploraciones implicarán describir, sistemáticamente, los principios que rigen la estabilidad de los complejos organometálicos. Desde el principio, diré que estos principios no están escritos en piedra y se aplican mejor a comparaciones bien controladas. No obstante, definitivamente vale la pena hablar de los principios, porque forman la base de todo lo demás que discutiremos. Comencemos explorando las características generales de los complejos organometálicos e identificando tres clases clave de ligandos orgánicos.
Cuando pensamos en metales solemos pensar en átomos electropositivos o incluso iones cargados positivamente, y muchos de los metales de la química OM encajan en este molde. En general, es útil imaginar ligandos orgánicos como donadores de electrones y metales como aceptores de electrones. Al mirar un par de electrones compartidos entre un metal de transición y un átomo del grupo principal (o hidrógeno), me imagino que el centro de metal catiónico y el átomo aniónico del grupo principal corren uno hacia el otro desde el olvido como amantes cruzados por las estrellas. En la dirección opuesta (con una advertencia importante que abordaremos pronto), podemos imaginar destrozar enlaces covalentes metal—R y dar ambos electrones del enlace al átomo orgánico. Este método de escisión de enlaces heterolíticos reproduce las cargas iniciales sobre el metal y el ligando. Como era de esperar, el metal es positivo y el ligando negativo.
Para su información, es posible que vea la bipiridina azul conocida como un ligando L2 en otra parte; esto solo significa que una sola molécula de bipiridina posee dos puntos de unión de tipo L. Los ligandos con múltiples puntos de unión también se conocen como ligandos quelantes o polidentados. Los ligandos quelantes pueden presentar modos de unión mixtos; por ejemplo, el ligando alilo es del tipo LX. Los ligandos quelantes también pueden unirse a dos centros metálicos diferentes; cuando actúan de esta manera, se llaman ligandos puente. ¡Pero no dejes que toda esta jerga te arroje! Deconstruir complejos un punto de unión a la vez, y no puedes equivocarte.
A continuación, analizaremos más de cerca el centro metálico y ampliaremos el propósito del proceso de deconstrucción descrito aquí.
“Contabilidad” a través de la deconstrucción de complejos organometálicos
Ahora es el momento de dirigir nuestra atención al centro metálico, y enfocarnos en lo que el proceso de deconstrucción puede decirnos sobre la naturaleza del metal en los complejos organometálicos. Volvamos ahora nuestra atención a un nuevo complejo. Yo he seguido adelante y lo deconstruí para nosotros.
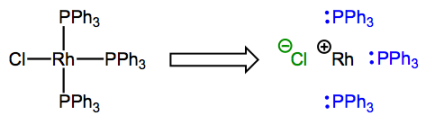
¡Saluda a rodio (Rh)! No te molestes; es solo un elemento del grupo 9.
El complejo posee un ligando tipo X y tres tipo L, por lo que el átomo de rodio termina con una carga formal de +1. El cargo formal sobre el centro metálico después de la deconstrucción tiene un nombre muy especial que definitivamente querrás comprometer con la memoria: se llama el estado de oxidación. Generalmente se indica con un número romano junto al símbolo atómico del metal (el “+” está implícito). En el complejo mostrado anteriormente, el rodio se encuentra en el estado de oxidación Rh (I) o +1. El estado de oxidación es más útil porque los cambios en el estado de oxidación indican cambios en la densidad de electrones en el centro del metal, y esto puede ser una ocurrencia favorable o desfavorable dependiendo de los otros ligandos alrededor. ¡Veremos este principio en acción muchas, muchas veces! Acostúmbrate a los cambios en el estado de oxidación como eventos cotidianos en mecanismos de reacción organometálicos. A diferencia del carbono (a excepción del carbeno... ¿cuál es su estado de oxidación?!) y otros elementos de la segunda fila, los metales de transición comúnmente exhiben múltiples estados de oxidación diferentes. Más sobre eso más tarde, aunque. Por ahora, entrenarse para identificar rápidamente el estado de oxidación de un metal complejado es lo más importante. Tenga en cuenta que cuando un complejo posee una carga general, ¡el estado de oxidación se ve afectado por esta carga!
estado de oxidación = número de ligandos de tipo X unidos al metal + carga global del complejo
¿Qué hay de este concepto de número de electrones d? Una manera muy útil de pensar sobre el “número de electrones d” es como el “número de electrones no enlazantes en el centro del metal”, y probablemente esté familiarizado con la identificación de electrones no enlazantes de la química orgánica. Los números de electrones de valencia de cada elemento orgánico se establecen en piedra: el carbono tiene cuatro, el nitrógeno tiene cinco, etcétera. Además, usando este conocimiento, es sencillo determinar el número de electrones de pares solitarios asociados a un átomo restando su número de enlaces covalentes de su número total de electrones de valencia. Por ejemplo, para un átomo de nitrógeno neutro en una amina NR3, 5 — 3 = 2 electrones de pares solitarios, típicamente. ¡La extensión a la química organometálica es natural! Podemos analizar centros metálicos complejados de la misma manera, pero tienden a tener muchos más electrones no enlazantes que átomos orgánicos, y el número depende del estado de oxidación del metal. Por ejemplo, el átomo de rodio deconstruido en la figura anterior tiene 8 electrones d: 9 electrones de valencia menos 1 utilizados para la unión a Cl. Los enlaces dativos no afectan el recuento de electrones d ya que ambos electrones en el enlace provienen del ligando.
número de electrones no enlazantes = número de electrones d = número de grupo del metal — estado de oxidación
Sacar todos los electrones d no enlazantes como pares solitarios abarrotarían las cosas, así que nunca se dibujan... ¡pero debemos recordar que están por aquí! ¿Por qué? Porque el número de electrones d afecta profundamente a la geometría de un complejo. Volveremos a esto pronto, pero la idea clave es que los ligandos arruinan las energías de los orbitales a medida que se acercan al metal (recuerden la idea de los “amantes cruzados por las estrellas”), y la forma más favorable de hacerlo depende del número de electrones no enlazantes en el centro metálico.
Estado de oxidación y d conteo de electrones: ¡dos herramientas sin las que el químico OM no puede vivir!
Este post nos introdujo a dos importantes herramientas de contabilidad, estado de oxidación y número de d electrones. En la entrega final de la serie “Simplifying the Organometallic Complex”, reuniremos todo y discutiremos el conteo total de electrones. Veremos que el recuento total de electrones puede usarse para extraer una variedad de conclusiones perspicaces sobre los complejos organometálicos.
Aplicar la deconstrucción para obtener información
Hasta ahora, hemos visto cómo la deconstrucción puede revelar propiedades útiles de “contabilidad” de los complejos organometálicos: número de electrones donados por ligandos, número de coordinación, estado de oxidación y d recuento de electrones (por nombrar algunos). Ahora, reunamos todo y discutamos el recuento total de electrones, la suma de electrones no enlazantes y de unión asociados con el centro metálico. Al igual que el estado de oxidación, el recuento total de electrones puede revelar la probable reactividad de los complejos OM; de hecho, a menudo es más poderoso que el estado de oxidación para hacer predicciones. Veremos que existe una norma definitiva para el recuento total de electrones, y cuando un complejo se desvía de esa norma, es probable que ocurran reacciones.
Empecemos con otro nuevo complejo. Esta molécula presenta los ligandos comunes e importantes de ciclopentadienilo y monóxido de carbono, junto con un ligando de etilo tipo X.
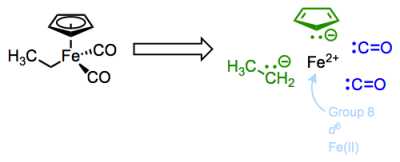
¿Cuál es el recuento total de electrones de este complejo Fe (II)?
El ligando Cp o ciclopentadienilo es un ligando L2X de seis electrones polidentado. Los dos enlaces pi del anión libre son ligandos dativos de tipo L, que veremos nuevamente en un futuro post sobre ligandos unidos a través de enlaces pi. Piense en los electrones del enlace pi como la fuente de un enlace dativo al metal. Dado que ambos electrones provienen del ligando, los enlaces pi son ligantes de tipo L. El carbono aniónico en Cp es un aglutinante tipo X aniónico bastante estándar. Los ligandos de monóxido de carbono son ejemplos interesantes de ligandos de tipo L de dos electrones; observe que los ligandos libres son neutros, por lo que estos se consideran de tipo L! El monóxido de carbono es un ligando intrigante que puede enseñarnos mucho sobre la unión metal-ligando en complejos OM... pero más sobre eso más adelante.
Después de la deconstrucción, vemos que el centro Fe (II) posee 6 electrones d no enlazantes. El recuento total de electrones es solo el recuento de electrones d más el número de electrones donados por los ligandos. Dado que el conteo de electrones d ya toma en cuenta la carga general, no necesitamos preocuparnos por ello siempre y cuando hayamos seguido correctamente el procedimiento de deconstrucción.
recuento total de electrones = número de electrones d + electrones donados por ligandos
Para el complejo Fe (II) anterior, el recuento total de electrones es así 6 + (6 + 2 + 2 + 2) = 18. Trabajemos a través de otro ejemplo: el complejo a continuación presenta una carga general de +1. El agua es un ligando dativo, ¡ese “2″ es muy importante!
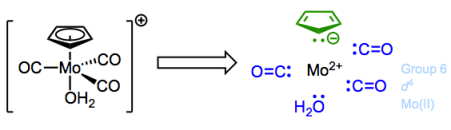
Tenga en cuenta que la carga total se agrupa en el estado de oxidación y el recuento de electrones d de Mo.
El estado de oxidación del molibdeno es +2 aquí... recuerda que la carga general influye en eso. Cuando todo está dicho y hecho, el recuento total de electrones es 4 + (6 + 2 + 2 + 2 + 2 + 2) = 18.
¿Qué pasa con 18? Resulta que 18 electrones es un número muy común para los complejos organometálicos estables. Tan común que el número tiene su propia regla, la regla de 18 electrones, que establece que los complejos estables de metales de transición poseen 18 electrones o menos. La regla es análoga a la regla del octeto de la química orgánica. La explicación típica de la regla de 18 electrones señala que hay 9 orbitales de valencia (1 s, 3 p, 5 d) disponibles para los metales, y el uso de todos estos para la unión parece producir los complejos más estables. Por supuesto, tan pronto como la regla dejó los labios de algún químico ansioso de orden, los investigadores se propusieron encontrar contraejemplos a la misma, y se conocen una serie de contraejemplos. Hartwig describe la regla como una “guía empírica” con poco apoyo teórico. De hecho, los estudios teóricos han demostrado que la participación de los orbitales p en los MO complejos es poco probable. Sé que eso no es lo que quieres oír—pero ¡quédese conmigo! La regla de 18 electrones sigue siendo una guía muy útil. Es de lo más interesante, de hecho, cuando no está satisfecho.
Un último ejemplo... ¿cómo esperarías que reaccionara el complejo de abajo?
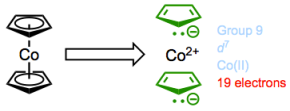
Cobaltoceno: jonesing para el cambio químico.
Si asumimos que la regla de los 18 electrones es cierta, entonces el cobaltoceno tiene un problema real. Posee 7 + (6 + 6) = ¡19 electrones de valencia total! Sin embargo, también podemos razonar que este complejo probablemente reaccionará para aliviar la tensión de no tener 18 electrones renunciando a un electrón. ¿Adivina qué? En la práctica, el cobaltoceno es un gran agente reductor de un electrón, y puede usarse para preparar complejos aniónicos mediante transferencia de electrones.
\[CoCp_2 + ML_n → [CoCp_2]+[ML_n]^–\]
Este post describió cómo calcular el recuento total de electrones e introdujo el poder de la regla de 18 electrones para predecir si un complejo donará o aceptará electrones. ¡Definitivamente volveremos a ver estas ideas! Pero, ¿qué sucede cuando los recuentos de electrones de dos complejos que nos interesa comparar son los mismos? Necesitaremos más información. En el siguiente post, exploraremos las tendencias periódicas de la serie de transición. Nuestro objetivo será hacer comparaciones significativas entre complejos de diferentes metales.


