13.5.4: Complejos de Fullereno
- Page ID
- 81071
Los\(\pi\) sistemas de fullerenos (eg buckmisterfullereno\(\ce{C60}\)) también actúan como ligandos para complejos metálicos. La mayoría de los complejos de metal de transición-fullereno se derivan de\(C_{60}\). La estructura de\(\ce{C60[IrCl(CO)(PMe3)2]2}\) se muestra en la Figura\(\PageIndex{1}\).

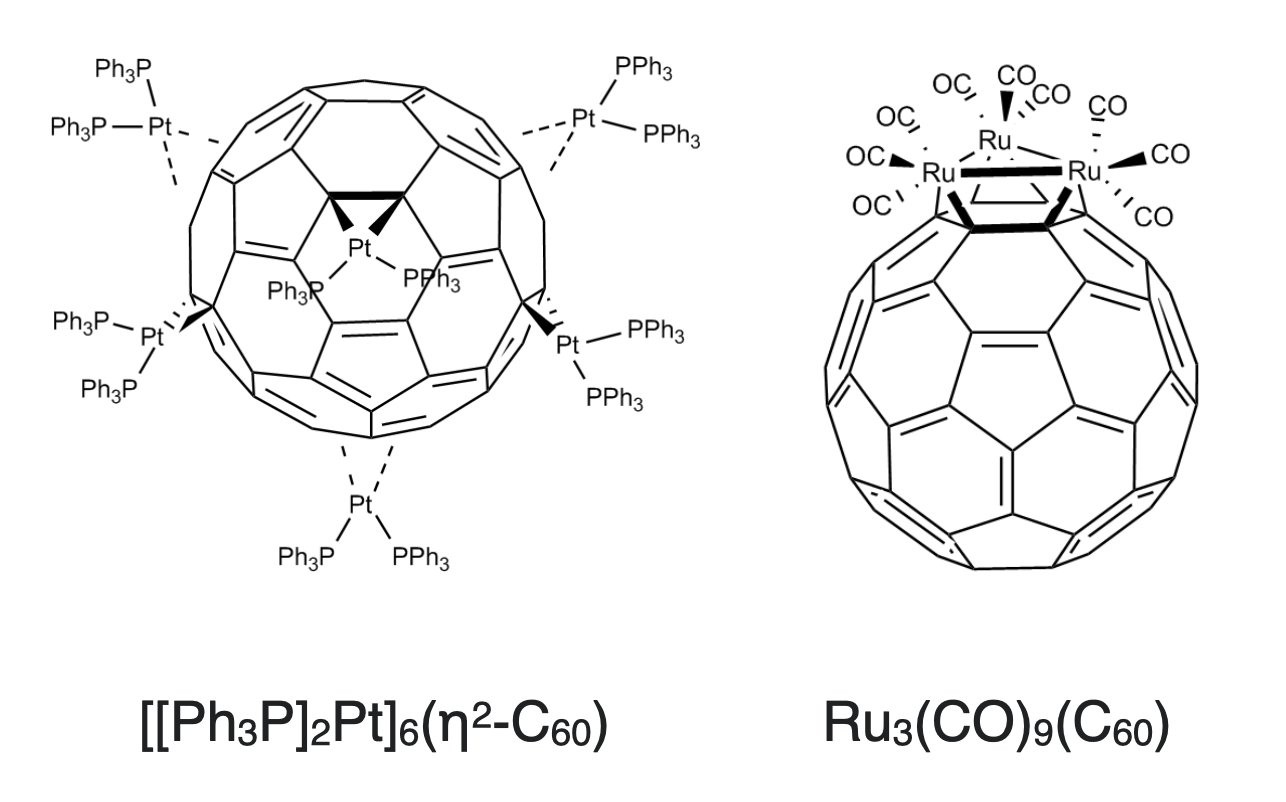
Como ligandos, los fullerenos se comportan de manera similar a los alquenos deficientes en electrones, y prefieren la coordinación a los centros metálicos ricos en electrones (iones metálicos con carácter más suave como los de los metales de transición 4d y 5d). Casi siempre se coordinan de manera dihapto (\(\eta^2\)). La unión\(\eta^2\) metálica ocurre con mayor frecuencia en la unión de dos anillos de 6 elementos, como se muestra a\(\ce{[[Ph3P]2Pt]6(\eta^2-C60)}\) la izquierda de la Figura\(\PageIndex{2}\). En (\ ce {Ru3 (CO) 9 (C60)}\), el fullereno se une a la cara triangular del cúmulo como se muestra a la derecha en la Figura\(\PageIndex{2}\).
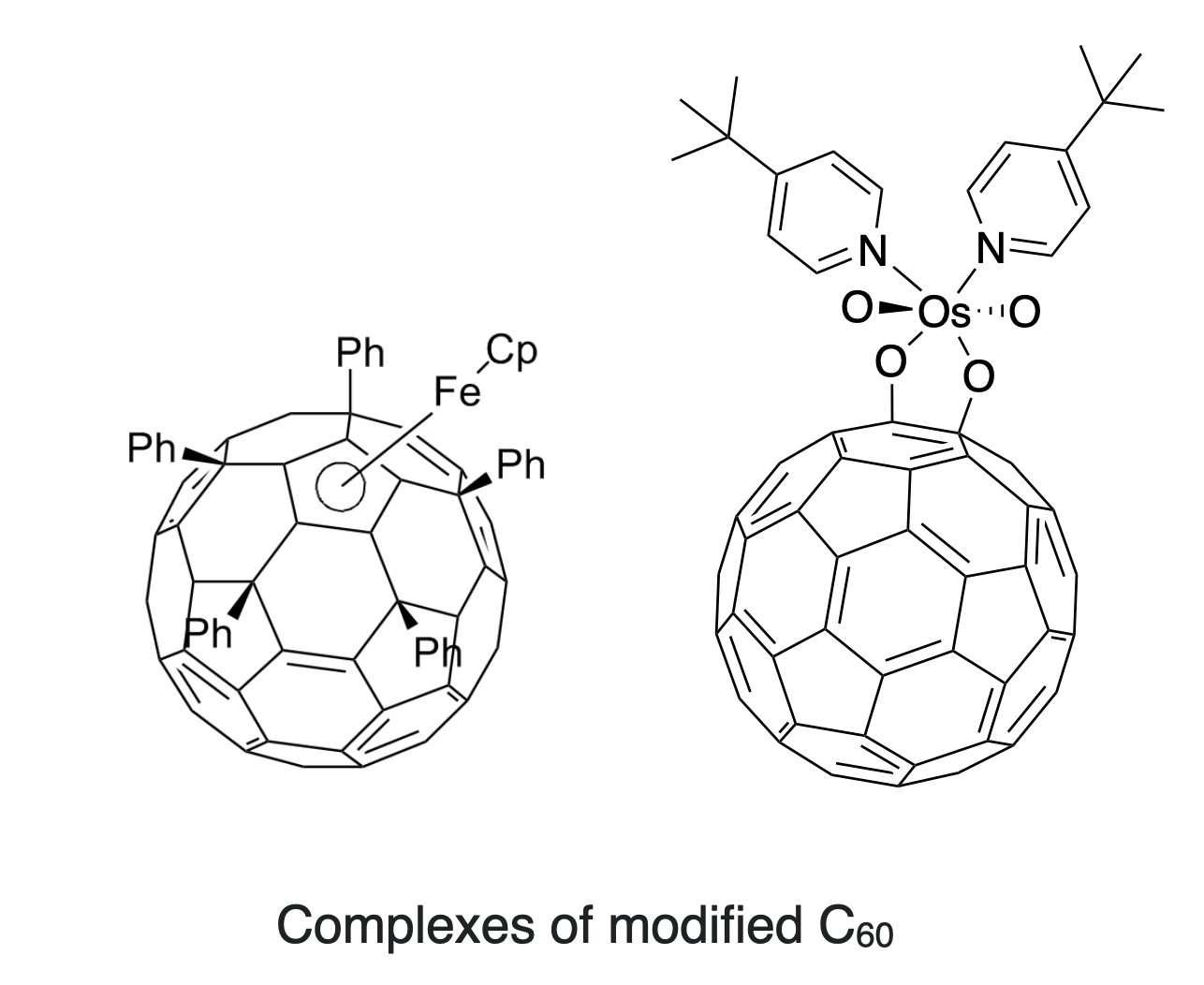
La unión de hexahapto y pentahato es posible, pero es menos común que la coordinación dihapto. La modificación del fullereno con sustituyentes de finilo hace que el fullereno sea un ligando más rico en electrones, por lo que la coordinación penta y hexahapto es más favorable. Por ejemplo, el anión pentafenilo,\(\ce{C60Ph5^-}\), se une al Fe de manera pentahpto (\(\eta^5\)), similar a las interacciones en ferroceno (Izquierda, Figura\(\PageIndex{3}\)).
(CC-BY-SA; Kathryn Haas).
La primera estructura de rayos X que dio una idea de la estructura esférica de los fullerenos se derivó de un aducto de oxígeno de tetroóxido de osmio (Derecha, Figura\(\PageIndex{3}\)).

