15.2: La analogía de Isolobal
- Page ID
- 81361
La analogía isolobular (también conocido como principio isolobal) es una estrategia utilizada en la química organometálica para relacionar la estructura de fragmentos moleculares orgánicos e inorgánicos con el fin de predecir las propiedades de unión de compuestos organometálicos. Roald Hoffmann describió los fragmentos moleculares como isolobal: "si el número, las propiedades de simetría, la energía aproximada y la forma de los orbitales fronterizos y el número de electrones en ellos son similares —no idénticos, sino similares”. Se puede predecir la unión y reactividad de una especie a partir de la de una especie mejor entendida si los dos fragmentos moleculares tienen orbitales fronterizos similares; el orbital molecular ocupado más alto (HOMO) y el orbital molecular desocupado más bajo (LUMO). Los compuestos isolobales son análogos a los compuestos isoelectrónicos que comparten el mismo número de electrones de valencia y estructura.
Las especies isolobales se indican con un símbolo de flecha isolobal; una flecha de doble punta con media órbita (Figura\(\PageIndex{1}\)).

El concepto de isolobalidad fue desarrollado por Roald Hoffmann (Figura\(\PageIndex{2}\)), quien ganó el premio Nobel de Química en 1981. Proviene de las palabras griegas “isos” que significa “similar” y “lobos” que significa lóbulo. De ahí que “isolobal” signifique “lóbulos similares”. En su discurso Nobel definió la isolobalidad de la siguiente manera: “Los fragmentos moleculares son isolobales si el número, las propiedades de simetría, la energía aproximada y la forma de los orbitales fronterizos y el número de electrones en ellos son similares, no idénticos, sino similares. “Cuando los fragmentos moleculares son isolobales entonces pueden probablemente se combinen para formar una molécula estable. Así, los fragmentos isolobales son bloques de construcción compatibles para la construcción de moléculas estables. También podemos decir que el concepto de isolobalidad nos ayuda a predecir cuándo se forma un vínculo estable. Siempre que dos fragmentos moleculares sean isolobales, probablemente formarán enlaces estables entre ellos.

Isolobal Fragmentos de elementos del grupo principal
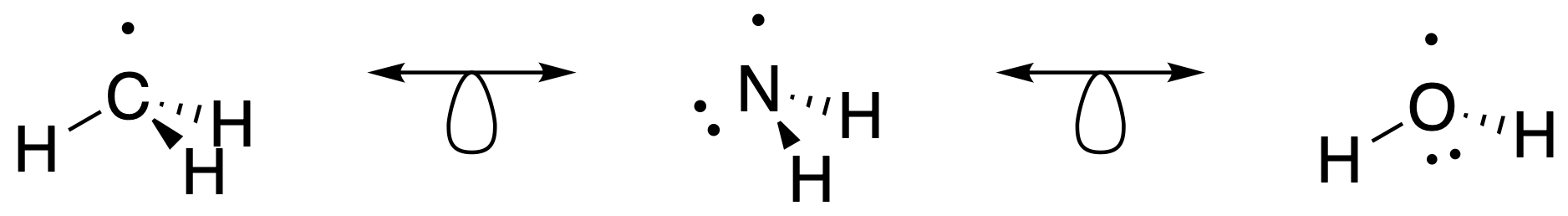
Existe un medio sencillo para determinar si los fragmentos son isolobales. En la química de grupos principales la regla del octeto es una guía muy útil, especialmente para el periodo 2 elementos (B, C, N, O, F) para los que la regla del octeto se sostiene de manera bastante estricta. La diferencia entre el número “8" y el número de electrones de valencia (VE) del fragmento molecular es igual al número de orbitales fronterizos y al número de electrones en él.
# de orbitales fronterizos = # de electrones en orbitales fronterizos = 8 — VE
Así, cuando dos fragmentos (de elementos del grupo principal) tienen el mismo número de electrones de valencia, pueden considerarse isolobales. Por ejemplo, el\(\ce{CH3}\) fragmento creado por escisión homolítica de un\(\ce{C-H}\) enlace del mismo\(\ce{CH4}\) se muestra en la Figura\(\PageIndex{1}\). Este\(\ce{CH3}\) fragmento tiene 7 VE en el carbono, y por lo tanto tiene un orbital fronterizo con un electrón (Figura\(\PageIndex{1}\)). Lo mismo es cierto para los fragmentos\(\ce{NH2}\) (7 VE) y\(\ce{OH}\) (7 VE) mostrados en XXX. Todos estos fragmentos tienen 7 VE y una frontera orbital (Figura\(\PageIndex{3}\)).
De acuerdo con la analogía isolobular, debería ser posible combinar fragmentos isolobales para formar moléculas estables. Probemos esto en los fragmentos que se muestran en la Figura\(\PageIndex{3}\). Todas las combinaciones posibles se muestran en la Figura\(\PageIndex{4}\). Se pueden combinar dos\(\ce{CH3}\) fragmentos para formar una molécula de etano que se sabe que es estable. La combinación de\(\ce{CH3}\) y\(\ce{NH2}\) da metilamina que es estable, y la combinación de\(\ce{CH3}\) y\(\ce{OH}\) da metanol, que también es estable. Dos\(\ce{NH2}\) fragmentos dan hidrazina, H 2 N-NH 2 que existe, la combinación de\(\ce{NH2}\) y\(\ce{OH}\) da la molécula de hidroxilamina conocida\(\ce{NH2OH}\). La combinación de dos\(\ce{OH}\) fragmentos da peróxido de hidrógeno\(\ce{H2O2}\).

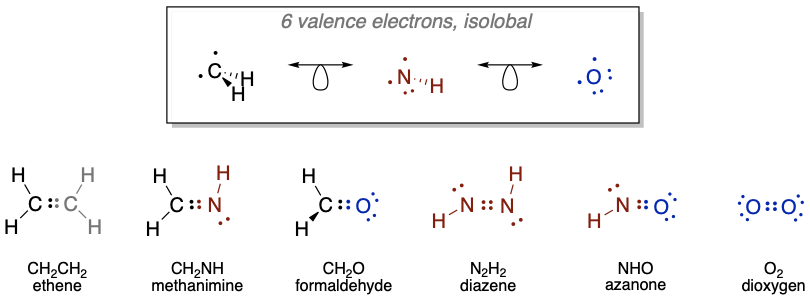
Como otro ejemplo, un\(\ce{CH2}\) fragmento es un fragmento de 6 VE, por lo que hay 8-6=2 orbitales fronterizos con un total de dos electrones en ellos (Figura\(\PageIndex{5}\)). Un\(\ce{NH}\) -fragmento y un O-átomo también tienen 6 VE, y por lo tanto son isolobales a\(\ce{CH2}\). En\(\ce{NH}\) hay 5+1 = 6 electrones de valencia, y un átomo de oxígeno tiene 6 electrones de valencia. Podemos combinar dos\(\ce{CH2}\) fragmentos para formar eteno\(\ce{H2C=CH2}\). Combinando\(\ce{CH2}\) con\(\ce{NH}\) y\(\ce{O}\), respectivamente, da metanimina\(\ce{H2CNH}\), y formaldehído\(\ce{H2C=O}\), respectivamente. La metilenimina es estable en fase gaseosa, y se oligomeriza en concentraciones más altas para formar un hexámero, llamado urotropina. También se conocen otros oligómeros y polímeros. La combinación de dos\(\ce{NH}\) fragmentos da la molécula conocida diazeno\(\ce{HN=NH}\), y la combinación con un\(\ce{O}\) átomo da\(\ce{HN=O}\), que se conoce como nitroxilo o azanona, y es estable en la fase gaseosa. La combinación de dos átomos de oxígeno da la conocida molécula de O 2.
La analogía también podría extenderse a 5 fragmentos VE (no mostrados). El fragmento CH tiene 4+1=5 VE, y un átomo de N tiene 5 VE también, por lo que pueden considerarse isolobales. Dos fragmentos de CH dan acetileno C 2H 2, y dos átomos de N dan la molécula de dinitrógeno N 2. La combinación de un fragmento CH con un fragmento N da H-CN, bien conocido como cianuro de hidrógeno.
Fragmentos isolobales de elementos de transición
En la forma en que la regla del octeto puede ayudar a predecir el número de orbitales fronterizos y los electrones en ellos para los fragmentos de elementos del grupo principal, la regla de 18 electrones puede usarse para predecir el número de orbitales fronterizos y electrones para fragmentos organometálicos, incluyendo fragmentos carbonilo. El número de orbitales fronterizos y el número de electrones en ellos es 18 menos el número de electrones de valencia que tiene el fragmento organometálico:
# orbitales fronterizos = # de electrones en orbitales fronterizos = 18 — VE
Por ejemplo, un complejo metálico con una cuenta de 17 electrones, como\(\ce{Mn(CO)5}\), hay un orbital fronterizo con un electrón. Esto implica que un fragmento carbonilo de 17 VE es isolobular a un fragmento orgánico de 7 VE tal como\(\ce{CH3}\). Para un fragmento de 16 VE como\(\ce{Fe(CO)4}\) hay dos orbitales fronterizos con un electrón en cada uno de ellos, y para un fragmento de 15 VE como\(\ce{(CO)3Co}\) hay tres orbitales fronterizos con tres electrones de valencia en general (Figura\(\PageIndex{6}\)). De manera similar, un fragmento carbonilo metálico de 16 VE es isolobular a un fragmento de 6 VE tal como\(\ce{CH2}\), y un fragmento de 15 VE es isolobal a un fragmento de 5 VE como CH (Figura\(\PageIndex{6}\)).

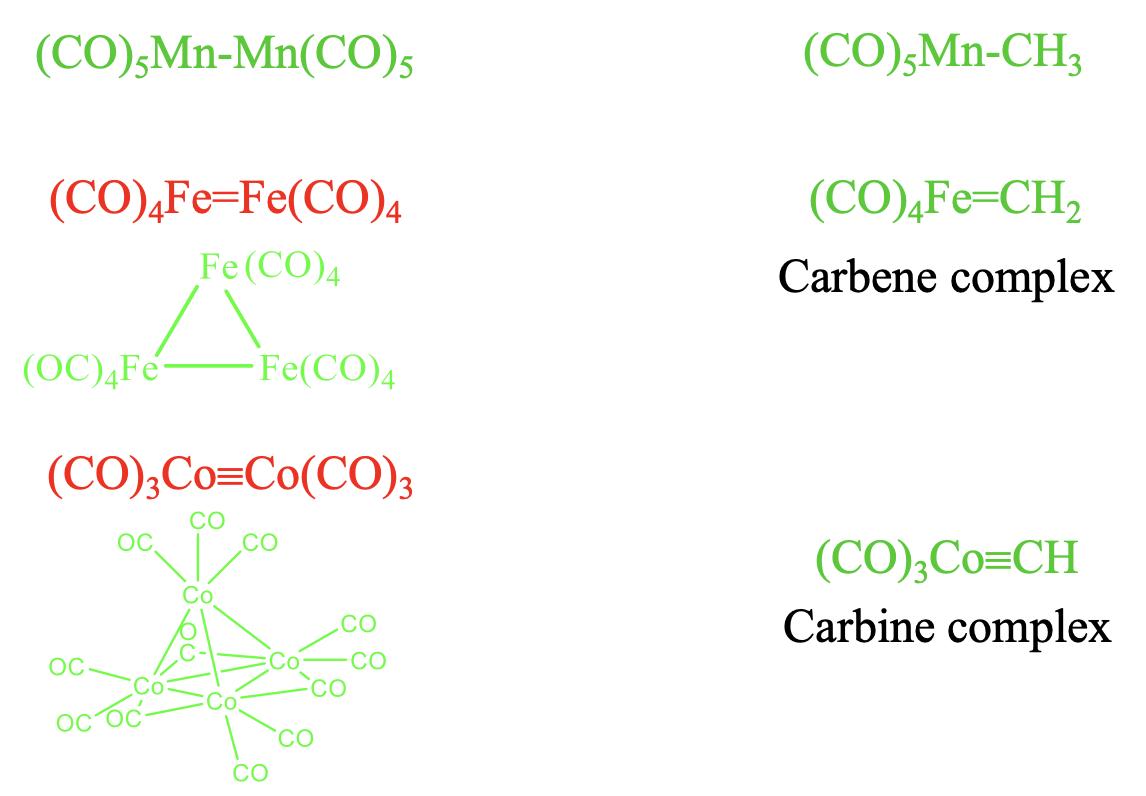
Debería ser posible combinar los fragmentos isolobales de la Figura\(\PageIndex{6}\) para formar moléculas estables. Comprobemos qué tan bien funciona esto (Figura\(\PageIndex{7}\)). Debería ser posible combinar los dos fragmentos de electrones de 17 VE como\(\ce{Mn(CO)5}\) para formar\(\ce{(CO)5Mn-Mn(CO)5}\). Esta es una molécula conocida. Recuerde que lo encontramos anteriormente cuando discutimos los carbonilos homolépticos de metales con un número impar de electrones. Combinar este fragmento con un\(\ce{CH3}\) fragmento de 7 VE conduce al\(\ce{(CO)5Mn-CH3}\) cual también es estable.
¿También podemos combinar dos fragmentos de electrones de 16 VE para formar\(\ce{(CO)4Fe=Fe(CO)4}\) con un doble enlace Fe=Fe? La respuesta es no. Los dobles enlaces metal-metal, y también los triples enlaces metal-metal en los complejos carbonílicos no se forman. En cambio, se realizan agrupaciones con enlaces simples. El número de enlaces simples que hace un metal es igual al número de sus orbitales fronterizos. En el caso de 16 fragmentos VE se forman agrupaciones triméricas con enlaces sencillos. En este cúmulo los dos orbitales fronterizos de cada fragmento forman dos enlaces simples a otros dos fragmentos. En contraste, un fragmento carbonilo de 16 VE tal como se\(\ce{(CO)4Fe}\) puede combinar con un fragmento de 6 VE para formar un compuesto con un doble enlace Fe=C. Un compuesto con un doble enlace metal-carbono se llama complejo de carbeno. De igual manera, la combinación de 15 fragmentos VE del tipo\(\ce{Co(CO)3}\) no conduce a una\(\ce{(CO)3Co≡Co(CO)3}\) molécula estable con un\(\ce{Co≡Co}\) triple enlace. En cambio, la naturaleza realiza un cúmulo tetraédrico tetramérico en el que los tres orbitales fronterizos de cada fragmento de 15 VE forman tres enlaces simples con los otros tres fragmentos de VE de 15. En las agrupaciones los ligandos de CO pueden no solo ser terminales, también pueden ser puentes. En el Co-cluster tetramérico, hay nueve Coligandos terminales y tres de puente. Los tres ligandos de CO puente están conectando los tres átomos de Co en la cara triangular base del tetraedro. ¿Qué pasa con la combinación de un fragmento de 15 VE con un fragmento orgánico de 5 VE? La combinación de un fragmento de 15 VE como Co (CO) 3 con un fragmento orgánico de 5 VE como CH para producir complejos estables como el\(\ce{(CO)3Co≡CH}\) complejo con un\(\ce{Co≡C}\) triple enlace. Los complejos con enlaces triples metal-carbono se llaman complejos de carabina.
Síntesis de Carbonilos de Cluster Teramérico
¿Cómo podemos hacer un grupo de carbonilo como ((Co (CO) 3) 4?
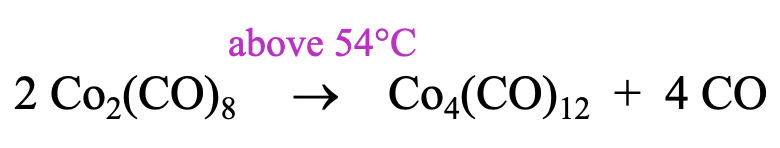
Se puede preparar calentando el Co 2 (CO) 8 a una temperatura superior a 54°C, por encima de esta temperatura el reactivo pierde cuatro ligandos de CO y se reorganiza para formar el conglomerado (Fig. \(\PageIndex{8}\)). Curiosamente, los homólogos superiores del Co-cluster, el Rh 4 (CO) 12 y el Ir 4 (CO) 12 se forman espontáneamente a partir de los elementos. Recuerde, que previamente determinamos que el Rh 2 (CO) 8 y el Ir 2 (CO) 8 no son estables. Rh e Ir favorecen los conglomerados tetraméricos con 12 CoS sobre el dímero con 8 ligandos de CO.
Estructuras de Co 4 (CO) 12, Rh 4 (CO) 12 e Ir 4 (CO) 12
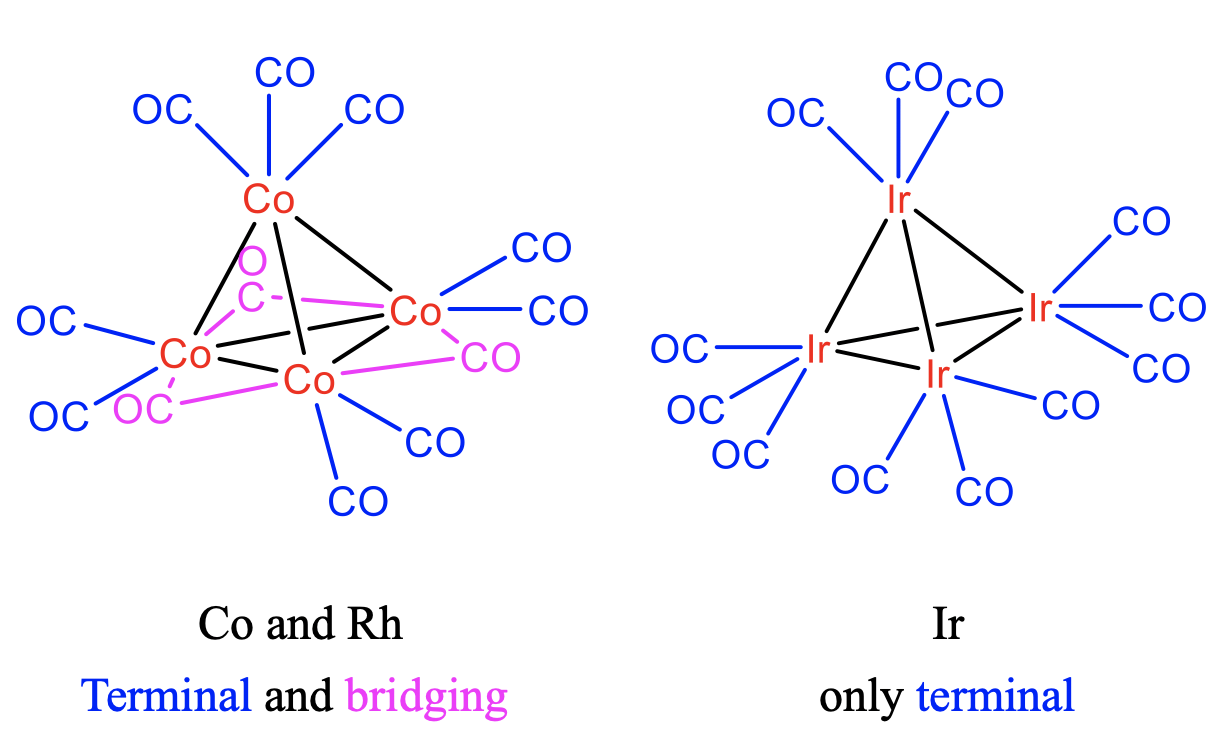
Al igual que en el grupo Co-cluster, hay 9 ligandos de CO terminales y tres puentes en el cluster Rh 4 (CO) 12. Por el contrario, solo hay ligandos de CO terminales en el cúmulo de iridio (Fig. \(\PageIndex{9}\)). Esto puede explicarse por la mayor longitud de unión IR-Ir en comparación con las longitudes de enlace Co-Co y Rh-Rh. La observación refleja la regla general de que solo los elementos 3d y 4d tienen ligandos CO puente, mientras que solo se observan ligandos terminales en metales con electrones 5d.
Grupos de carbonilo cargados isoelectrónicos
Los conglomerados previamente discutidos fueron de carga neutra. ¿Podemos construir isoelectrónicos cargados con diferentes metales, y cuál es su estabilidad? Comencemos con el Co-cluster tetramérico formado por cuatro fragmentos de 15 VE. El elemento que queda al Co es el Fe. Tiene un electrón menos, por lo tanto Fe (CO) 3 - es el fragmento de electrones 15 VE que es isoelectrónico al fragmento neutro de Co (CO) 3. Su tetrámero sería un clúster Fe 4 (CO) 12 4-. Este clúster no se conoce. El clúster ya lleva una carga 4 que es demasiado alta para soportar bonos estables de Fe-Fe. Cada Fe lleva formalmente una carga 1-negativa y hay demasiada repulsión electrostática entre los átomos de Fe. Otra posibilidad de realizar un fragmento de 15 VE con Fe es un fragmento (CO) 4 Fe +. Aquí se agrega un ligando adicional aportando dos electrones, y se elimina un electrón dando como resultado un fragmento con una carga 1+. El fragmento se pudo combinar para formar un grupo Fe 4 (CO) 16 4+. Sin embargo, dicho cúmulo tampoco es estable. Esto se debe a que el número de coordinación sería 7, que es demasiado alto para un carbonilo. Además, existe el efecto desestabilizador de la carga positiva sobre el enlace Fe-C. De igual manera, tampoco se conocen los tetrámeros de los 15 fragmentos VE Mn (CO) 4, Cr (CO) 4 - y (CO) 5 Cr +. También en estos casos, los números de coordinación serían demasiado altos. El Mn (CO) 4 y el Cr (CO) 4 - conducirían a un número de coordinación de 7, en el caso del fragmento Cr (CO) 5 + el número de coordinación sería incluso 8. Aquí vemos las limitaciones del concepto de isolobalidad. La presencia de isolobalidad no siempre es suficiente para hacer una molécula estable, también hay que considerar otros factores como los números de coordinación y la carga. ¿Qué pasa con los clústeres isoelectrónicos cargados hechos de 16 VE? Anteriormente vimos que el fragmento neutro 16 VE Fe (CO) 4 dio un trímero Fe 3 (CO) 12. Si pasamos del Fe al Mn, el fragmento isoelectrónico de 16 VE sería un fragmento Mn (CO) 4 - porque Mn tiene un electrón menos que Fe. Este fragmento de hecho se puede trimerizar para dar un grupo estable de Mn 3 (CO) 12 3- con una carga 3-. Esta carga aún no es demasiado alta para desestabilizar el enlace Mn-Mn y el número de coordinación de 6 es ideal para la estabilidad de los carbonilos. Podríamos agregar un ligando y eliminar dos electrones para producir un fragmento 15 VE Mn (CO) 5 +. Sin embargo, en este caso el número de coordinación se convertiría en 7 tras la trimerización, que es demasiado alto para producir un cúmulo estable. Además, la carga positiva desestabiliza el enlace Mn-C. Reemplazar Mn por Cr en Mn (CO) 5 + daría un fragmento neutro de 16 VE Cr (CO) 5, pero su trímero no es estable porque también en este caso el número de coordinación se vuelve demasiado alto. Reemplazar Fe en Fe (CO) 4 por Co requeriría una carga 1+ dando un fragmento de Co (CO) 4 + 16 VE. Su trímero tendría el número de coordinación 6, pero llevaría una carga 4+ que es demasiado alta. Un fragmento de Co (CO) 3 - también tendría 16 VE, pero tampoco se conoce su trímero, posiblemente porque el número de coordinación relativamente pequeño de 5, que es menos favorable que un número de coordinación de 6. En general podemos decir como regla para la estabilidad de los conglomerados de carbonilo que no debe haber cargas positivas, y no altas cargas negativas. No debe haber altos números de coordinación.
Clusters con 16 fragmentos VE y 6 VE
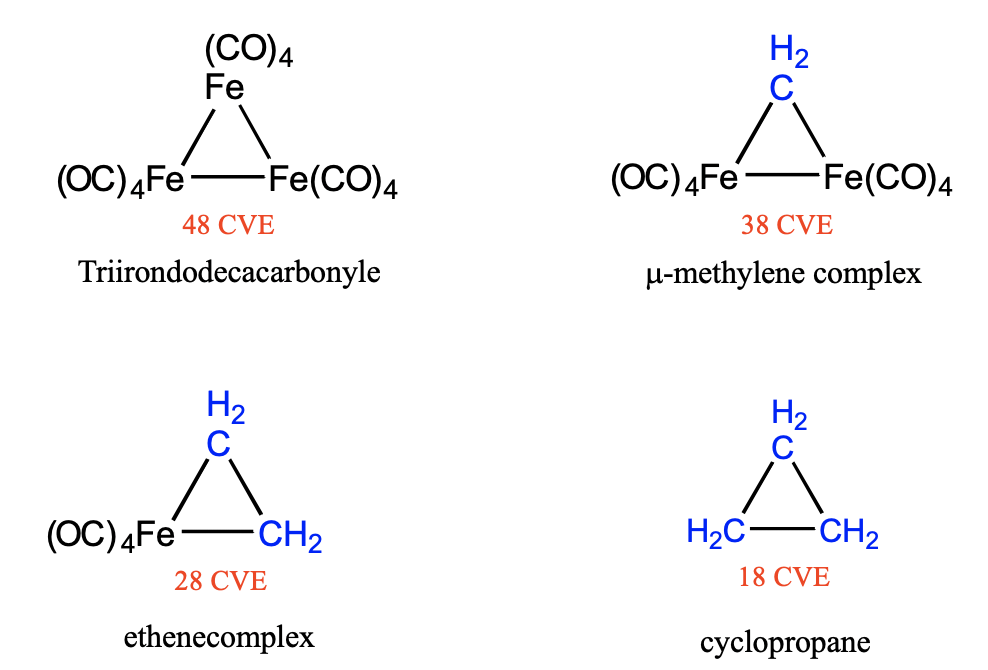
La química de conglomerados de los carbonilos es aún más versátil debido a la posibilidad de sustituir 16 y 15 fragmentos VE por 6 y 5 fragmentos VE, respectivamente. Por ejemplo, podemos reemplazar un fragmento 16 VE Fe (CO) 4 por un fragmento 6 VE CH 2 en el grupo trimérico trihierro dodecacarbonilo Fe 3 (CO) 12 (Fig. \(\PageIndex{10}\)). En el grupo resultante un grupo metileno une dos átomos de Fe, por lo que el complejo puede considerarse un complejo μ-metileno. La sustitución reduce el número de electrones de valencia agrupada (CVE) de 48 a 38. Una segunda sustitución de otro fragmento de hierro tetracarbonilo de 16 VE por otro fragmento de metileno de 6 VE da un grupo con dos enlaces Fe-C y un enlace carbono-carbono que tiene 28 electrones de valencia de racimo. Este complejo puede considerarse como un complejo de eteno en el que una molécula de eteno se une de lado a un fragmento 15 VE Fe (CO) 4. Tras la unión, los dos enlaces Fe-C se forman a expensas del enlace π C-C y el orden de enlace en el enlace C-C se reduce de 2 a 1. Si sustituimos el último fragmento de tetracarbonil-hierro por una tercera unidad CH 2, entonces resulta una molécula completamente orgánica, el ciclopropano. Se sabe que todas las moléculas son moléculas estables, y su estabilidad se puede entender muy bien usando el concepto de isolobalidad.
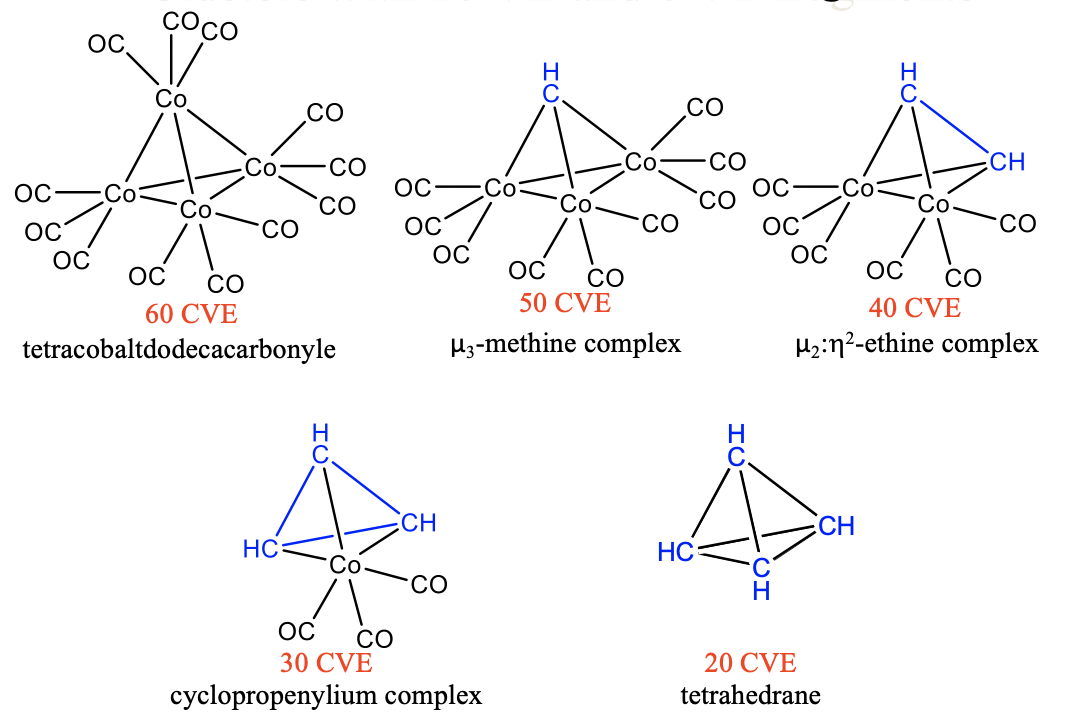
De igual manera, podemos sustituir 15 unidades VE de tricarbonil cobalto por 5 VE fragmentos CH en tetracobaltodecacarbonilo Co 4 (CO) 12. Una primera sustitución da un grupo de 50 VE con un fragmento CH que hace tres enlaces a tres fragmentos de Co (CO) 4 (Fig. \(\PageIndex{11}\)). Debido a que el grupo CH une tres átomos metálicos, se considera un complejo μ 3-metino. Una segunda sustitución produce un grupo de 40 VE con una unidad orgánica CH-CH que hace cuatro enlaces a dos átomos de Co de dos fragmentos de 15 VE Co (CO) 3. El fragmento CH-CH puede considerarse una molécula de etina que se une de lado a un fragmento de dicobaltoexacarbonilo, por lo que los dos enlaces p en la etina se gastan para formar cuatro enlaces sencillos Co-C. El cúmulo puede considerarse un complejo μ 2:2-etino porque el etino une dos átomos de Co y ambos carbonos están involucrados en la unión con Co. Una tercera sustitución conduce a un grupo de 30 CVE con tres unidades CH que se unen a un fragmento de Co (CO) 3. Hay tres enlaces simples C-C y tres enlaces Co-C en el cluster. Las tres unidades CH forman un complejo de ciclopropenilio que se une de lado a un fragmento de Co (CO) 4. Una molécula de ciclopropenlio libre es una molécula de 3 anillos con tres electrones π que están deslocalizados en el anillo. Por lo tanto, el orden de enlace en una molécula de ciclopropenlio libre es 1.5. En el complejo se están utilizando los tres electrones π para hacer los tres enlaces simples con los átomos de cobalto. El orden de enlace en el ciclopropenilio se reduce de 1.5 a 1. Finalmente, la cuarta sustitución de un fragmento de tricarbonil cobalto por un fragmento de metino produce la molécula de tetraedrano completamente orgánica. Esta molécula y las otras discutidas anteriormente son estables. El concepto de isolobalidad nos permite racionalizar fácilmente estas complejas estructuras y comprender su estabilidad.
Síntesis de Complejos de Cluster a partir de Alquinos
La opinión de que los 40 racimos VE son racimos de alquinos no es solo una visión formal. Se pueden sintetizar a partir de alquinos. Por ejemplo, los racimos de alquino-dicobalto son accesibles desde octacarbonilo y alquinos de dicobalto (Fig. \(\PageIndex{12}\)).
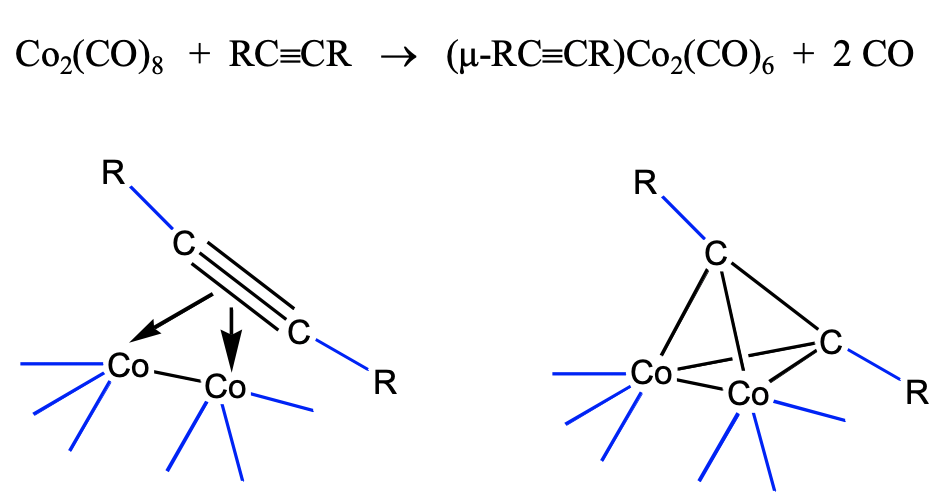
El cúmulo se forma a través de la donación de los cuatro electrones π de los alquinos en los d-orbitales metálicos del carbonilo de cobalto dimérico. Esto conduce a una pérdida de dos ligandos de CO, y la formación de cuatro enlaces Co-C. En condiciones más duras, el triple enlace C-C también puede escindirse y esto puede dar acceso a complejos de metino.
Hidridos de Carbonyl
Ahora dejemos los compuestos del grupo carbonilo y hablemos de otra interesante clase de carbonilos: los hidruros de carbonilo. También pueden ser racionalizados por el concepto de isolobalidad. Un átomo de hidrógeno puede concebirse como una especie con un orbital fronterizo que contiene un electrón. En este caso el orbital fronterizo es simplemente el orbital 1s del hidrógeno. Así, debería ser posible combinar un átomo de H con un fragmento carbonilo de 17 VE como tetracarbonilcobalto.
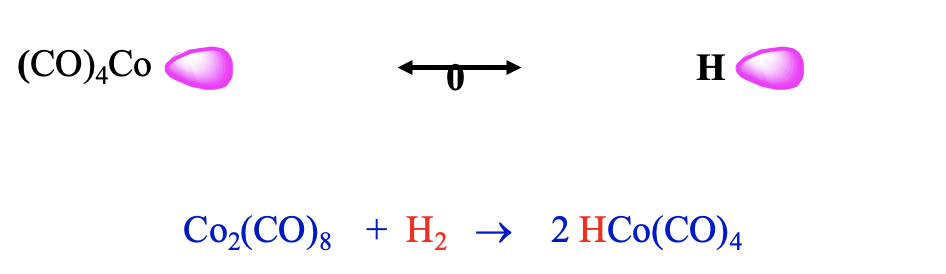
De hecho, se pueden combinar dichos fragmentos para formar hidruros de carbonilo estables tales como tetracarbonilhidrido cobalto (0). Esta molécula se puede sintetizar por reducción de bis (tetracarbonilcobalto) (0) con dihidrógeno (Fig. \(\PageIndex{13}\)). Contra-intuitivamente, esta molécula es un ácido fuerte, tiene una acidez similar a la del ácido sulfúrico. Uno pensaría que el vínculo Co-H estaría polarizado hacia H basado en argumentos de electronegatividad. Sin embargo, este no es el caso. El fragmento carbonilo tiene un orbital fronterizo que es energéticamente más alto que el de H, y así el enlace se polariza hacia H. En otro punto de vista podemos explicar que la alta acidez es el hecho de que la pérdida del protón conduce al muy estable 18 VE tetraédrico Co (CO) 4 - anión. Así, la pérdida del protón ocurre fácilmente.
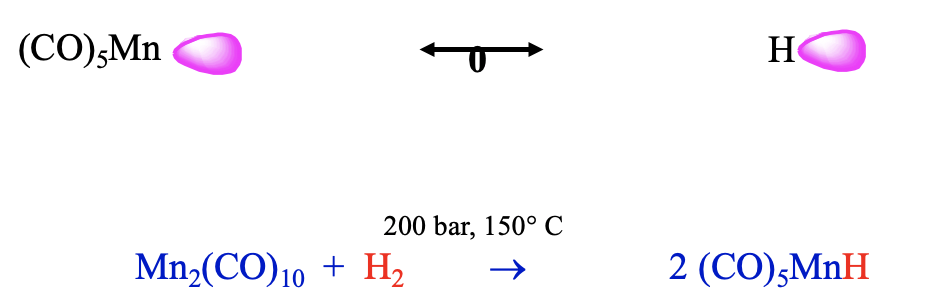
Otro fragmento de electrones de 17 VE es el fragmento Mn (CO) 5. También este fragmento se puede combinar con un fragmento H isolobal para formar una molécula estable, la cual tiene la composición HMn (CO) 5 (Fig. \(\PageIndex{14}\)). Se puede preparar a partir de bis (pentacarbonilmanganeso) y dihidrógeno a 200 bar y 150°C.Este hidruro de carbonilo es un ácido débil, tiene una acidez similar a H 2 S. Podríamos argumentar que esta menor acidez puede deberse a que la pérdida del protón reduce su número de coordinación de 6 a 5. El número de coordinación de 6 es el número de coordinación preferido para los carbonilos y por lo tanto la tendencia a perder el protón es relativamente pequeña. El diferente metal y el número de ligandos de carbonilo probablemente conducirán a una energía diferente del orbital fronterizo en comparación con el ejemplo anterior, lo que conduce a una polaridad diferente.
En general, se pueden ajustar las propiedades en hidruros de carbonilo de altamente ácidos a hidrídicos mediante la elección del metal el número de coordinación, y también por la elección de ligandos adicionales L distintos del carbonilo. Las propiedades electrónicas y estéricas de los ligandos influyen en la energía del HOMO del fragmento, y así en la polaridad del enlace metal-hidrógeno, y la acidez.


