15.2.1: Extensiones de la Analogía
- Page ID
- 81374
La analogía isolobal tiene aplicaciones más allá de los simples complejos octaédricos. Se puede utilizar con una variedad de ligandos, especies cargadas y complejos no octaédricos.
La analogía isolobal también se puede utilizar con fragmentos i soelectrónicos que tengan el mismo número de coordinación, lo que permite considerar especies cargadas. Por ejemplo,\(\ce{Re(CO)5}\) es isolobal con\(\ce{CH3}\) y por lo tanto,\(\ce{[Ru(CO)5]^+}\) y también\(\ce{[Mo(CO)5]^−}\) son isolobal con\(\ce{CH3}\). Cualquier complejo metálico de 17 electrones sería isolobal en este ejemplo.
En un sentido similar, la adición o eliminación de electrones de dos fragmentos isolobales da como resultado dos nuevos fragmentos isolobales. Ya que\(\ce{Re(CO)5}\) es isolobal con\(\ce{CH3}\),\(\ce{[Re(CO)5]^+}\) es isolobal con\(\ce{CH3^+}\).
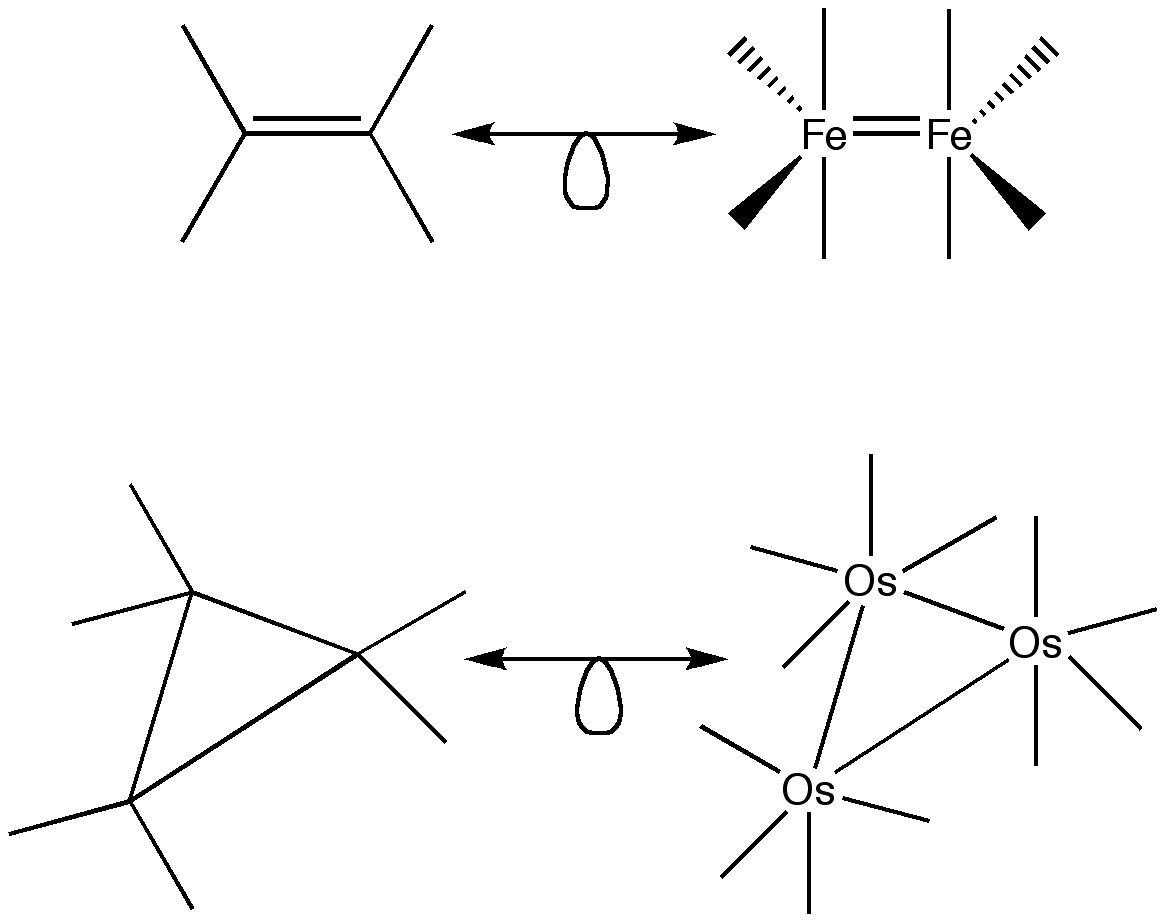
La analogía se aplica a otras formas además de las geometrías tetraédricas y octaédricas. Las derivaciones utilizadas en geometría octaédrica son válidas para la mayoría de otras geometrías. La excepción es cuadrado-planar porque los complejos cuadrado-planares suelen cumplir con la regla de 16 electrones. Suponiendo que los ligandos actúan como donantes de dos electrones, el centro metálico en moléculas cuadrado-planares es\(d^8\). Para relacionar un fragmento octaédrico, ML n, donde M tiene una configuración d x electrón con un fragmento análogo plano cuadrado, la fórmula ML n −2 donde M tiene una configuración de electrones d x +2 debería ser seguido.
| Octaédrico ML n | Plano Cuadrado ML n |
|---|---|
| \(d^6: \quad \ce{Mo(CO)5}\) | \(d^8: \quad \ce{[PdCl3]^-}\) |
| \(d^8: \quad \ce{Os(CO)4}\) | \(d^10: \quad \ce{Ni(PR3)2}\) |
Se muestran ejemplos adicionales de la analogía isolobal en diversas formas y formas