1.3: Propiedades periódicas de los átomos
- Page ID
- 70068
La Tabla Periódica de los Elementos
Habiendo entendido el principio de Aufbau ahora podemos entender la tabla periódica de los elementos. La tabla periódica se inventó mucho tiempo antes de que se desarrollara el modelo de átomos cuánticos mecánicos. Fue introducido por primera vez por Mendeleev y Meyer quienes ordenaron a los elementos según sus masas seguidas. Siempre que un elemento tenía una propiedad similar a un elemento que ya se consideraba anteriormente se comenzaba una nueva fila. Esto dio una tabla con filas y columnas. Dentro de una fila aumentaría la masa de los elementos, dentro de una columna se encontrarían los elementos que tuvieran propiedades similares. Las filas se llamarían periodos, y las columnas se llamarían grupos, de ahí el nombre tabla periódica de los elementos. En el momento en que Mendeleev y Meyer inventaron la tabla periódica, todavía había muchos elementos por descubrir visibles como “agujeros” dentro de la tabla periódica. Sin embargo, con el tiempo la tabla periódica se completó (Fig. 1.3.1).
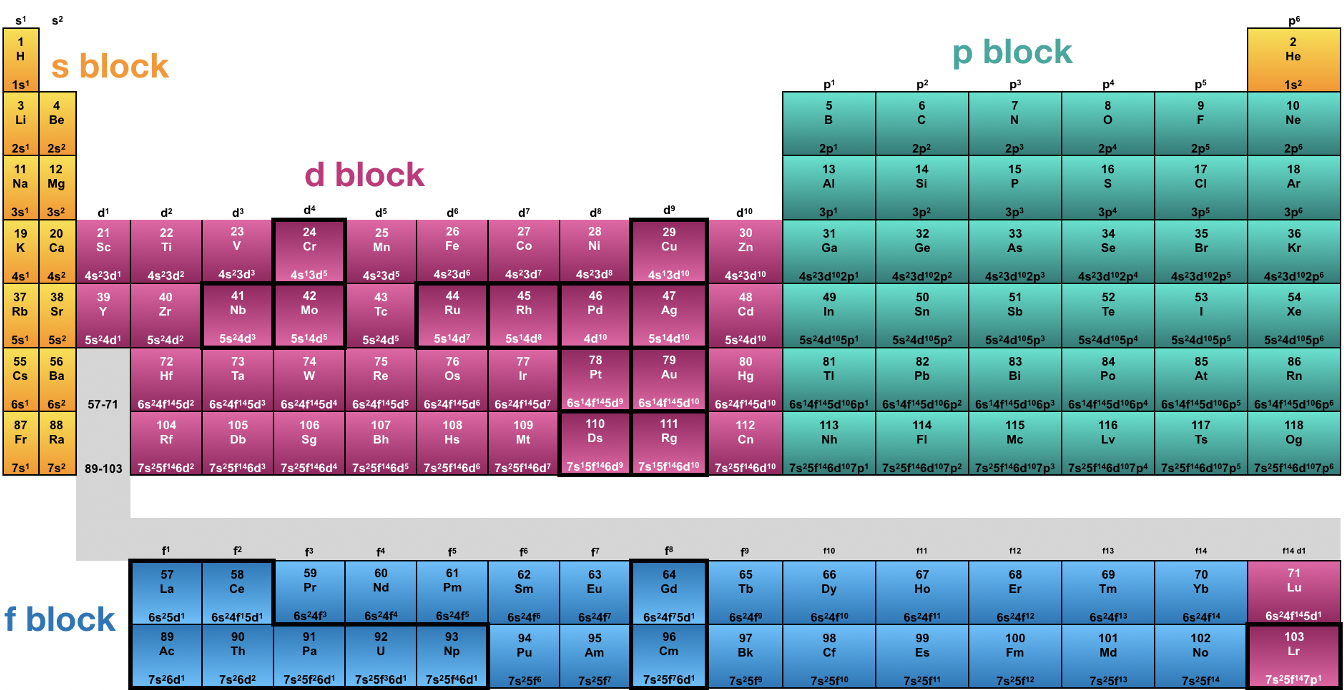
Hoy conocemos 118 elementos que completan siete periodos y 18 grupos. Hoy en día, los elementos no están ordenados por masa, sino por el número atómico (número de protones), sin embargo esto no cambió mucho la tabla periódica original porque a excepción de muy pocos elementos la masa de los elementos sigue al número atómico. Antes de que se desarrollara el modelo cuántico-mecánico, no se entendía por qué los elementos dentro del mismo grupo tenían propiedades similares. Cuando se analiza la configuración electrónica de los átomos se puede ver que todos los átomos del mismo grupo tienen el mismo tipo de electrones más externos, también llamados electrones de valencia. Estos electrones son los electrones que tienen la mayor distancia del núcleo y tienen las energías más altas. Debido a que tienen las energías más altas, también son los electrones que son más reactivos, y determinan las propiedades químicas y físicas del elemento. Por ejemplo, en el primer grupo todos los elementos tienen un electrón s como el electrón de valencia. Debido a que estos electrones tienen la mayor energía y son los más reactivos, determinan las propiedades del átomo, y así los elementos del primer grupo tienen propiedades similares.
Cuando se mira en el grupo 2, todos los electrones tienen dos electrones s como los electrones de valencia. Una excepción es el elemento helio que se coloca en el grupo 18 que se llama el grupo de los gases nobles. El otro grupo 18 elementos tienen dos electrones s y seis p del mismo número cuántico n que los electrones de valencia. El comportamiento de He es mucho más similar al del otro grupo 18 elementos, es decir, es un gas con reactividad extremadamente baja. Esta propiedad se debe a que al igual que los otros gases nobles tiene una cáscara llena. Los elementos con una capa completa son particularmente poco reactivos porque las conchas completas representan configuraciones de electrones particularmente estables, también llamadas configuraciones de gas noble.
Grupo 1, grupo 2 y He son llamados el bloque s de la tabla periódica porque son los elementos que solo tienen s electrones como electrones de valencia. Del grupo 3 al grupo 12 hay elementos con electrones s y d como electrones de valencia. Estos elementos son el bloque d de la tabla periódica. El bloque d comienza con el grupo 3 donde solo hay un electrón d junto con dos electrones s, y termina con el grupo 12 donde hay diez electrones d y dos s. En el grupo 12 la subcapa d está completamente llena de electrones. Del grupo 13 al grupo 18 encontramos electrones que tienen electrones p como electrones de valencia. Hay seis grupos porque los orbitales p pueden acomodar hasta seis electrones p. En el grupo 13 sólo hay un electrón p valencia, en el grupo 14 hay dos, en el grupo 15 hay tres, en el grupo 16 cuatro, en el grupo 17 cinco, y en el grupo 18 hay un seis excepto el Helio que ya discutimos previamente. Al grupo 13 al 18 se le llama el bloque p de la tabla periódica. El bloque s y los elementos del bloque p juntos también se denominan elementos del grupo principal, los elementos del bloque d se denominan metales de transición. Los elementos de los grupos principales tienen nombres específicos. Los elementos del grupo 1 excepto hidrógeno se denominan los metales alcalinos, el grupo 2 elementos los metales alcalinotérreos, el grupo 13 los trieles, el grupo 14 elementos los tetreles, el grupo 15 elementos los pnictidos, el grupo 16 elementos son los calcógenos, el grupo 17 elementos los halógenos y el grupo 18 elementos los gases nobles.
Por último, está el bloque f de la tabla periódica. El bloque f contiene los elementos con electrones de valencia f. Debido a que hay siete orbitales f para un número cuántico dado n, los orbitales f pueden acomodar hasta 14 electrones, y así hay 14 grupos. El bloque f se encuentra realmente entre el bloque s y el bloque d de la tabla periódica, pero normalmente se escribe debajo del resto de la tabla periódica. Esto se hace porque la tabla periódica se volvería demasiado ancha si se colocara entre el bloque s y el d. Tenga en cuenta que los elementos del bloque f no tienen un número de grupo. Obsérvese también que los elementos en el extremo izquierdo del bloque f, lantano y actinio, en realidad no tienen electrones de valencia f. En realidad son elementos del grupo 3 ubicados debajo de los elementos escandio e itrio. La primera fila del bloque f se llama lantánidos, que es el griego que significa los elementos que siguen al lantano. Sólo los elementos que siguen al lantano tienen electrones de valencia f. Análogamente, el actinio no es un elemento real del bloque f, solo los elementos que siguen al actinio. Se les llama los actínidos.
El modelo mecánico cuántico de los átomos también explica por qué la tabla periódica tiene periodos. Cada periodo se asocia con un número cuántico n, el primer periodo con n=1, el segundo periodo con n=2 y así sucesivamente. Dentro de un periodo se están llenando los orbitales de valencia s y p disponibles de un número cuántico específico n. Las subcapas de un número cuántico menor también se pueden llenar dentro del período. Por ejemplo, el subshell 3d se llena dentro del cuarto período, y el subshell 4f se rellena en el sexto período.
Los elementos con configuraciones de electrones que se desvían de la configuración electrónica esperada se resaltan en negrita (Figura 1.3.1). Solo hay excepciones para los elementos d-block y f-block. Ya discutimos algunos de ellos, por ejemplo el Cr y el Cu. Además, por ejemplo, Pd tiene la configuración de electrones 4d 10 en lugar de 5s 2 4d 8, y Pt tiene la configuración de electrones 6s 1 5d 9 en lugar de 6s 2 5d 8. Podemos explicar estas excepciones al considerar las complejas interacciones electrostáticas y magnéticas de los electrones en átomos multielectrónicos. No todo puede explicarse por los conceptos simples de las reglas de Slater y la regla de Hund.
Como químicos siempre debemos conocer nuestra tabla periódica. Aprender es más fácil con la música, y hay una canción fabulosa de Tom Lehrer que puede ayudarte a aprender la tabla periódica. El enlace a un respectivo video de YouTube se proporciona a continuación.
Radios atómicos
Veamos ahora lo que se llama las propiedades periódicas de los átomos. Estas son propiedades que cambian debido a la posición del elemento dentro de la tabla periódica. Consideremos primero cómo los radios atómicos de los átomos dependen de la posición del átomo en la tabla periódica, Fig. 1.3.2.
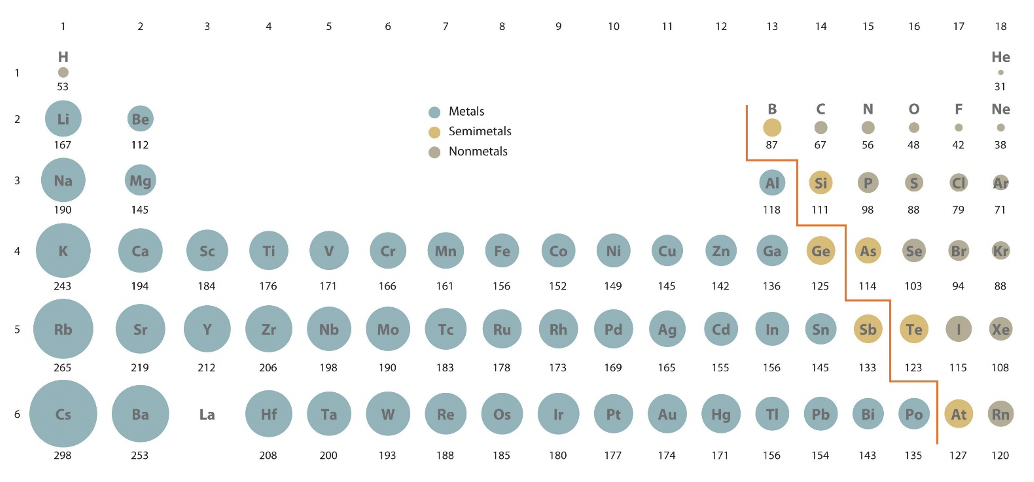
Cuando miras cómo cambian los radios atómicos dentro de un periodo puedes ver fácilmente que disminuyen de izquierda a derecha en la tabla periódica. La disminución es más significativa para los elementos de bloque s y p en comparación con los elementos de bloque d. Podemos explicar este efecto utilizando el concepto de carga nuclear efectiva. A medida que vamos de izquierda a derecha en la tabla periódica agregamos electrones a la misma concha. Debido a que también se agrega un protón al núcleo con cada electrón agregado, el electrón experimenta una mayor fuerza de atracción desde el núcleo. Este efecto tiende a incrementar la carga nuclear efectiva. Sin embargo, también hay un efecto contrario. Debido a que hay un electrón más, hay más repulsión electrón-electrón y efectos de blindaje, y esto tiende a disminuir la carga nuclear efectiva. Debido a que el nuevo electrón se agrega a la misma concha, los efectos de blindaje no compensan completamente la fuerza adicional de Coulomb proveniente del protón adicional en el núcleo, y así la carga nuclear efectiva aumenta. Esta mayor carga nuclear efectiva acerca los electrones al núcleo, y así el tamaño del átomo disminuye. Para los elementos del bloque d se agregan nuevos electrones d a una subcapa más interna, por ejemplo, para los elementos del bloque d del 4to período los electrones d se agregan a la subcapa 3d. Debido a eso, estos electrones 3d pueden proteger de manera más efectiva la carga nuclear de los dos electrones 4s más externos, y así la disminución del radio atómico es menos pronunciada. En resumen:
Tendencia 1: El radio atómico disminuye continuamente dentro de un periodo.
Una segunda tendencia es que cada vez que se inicia un nuevo periodo el radio atómico salta dramáticamente. Por ejemplo salta de 31 pm a 167pm a medida que vamos del helio al litio, y de 38 pm a 190pm a medida que vas del neón al sodio. Esta tendencia se debe a que los electrones se llenan en una nueva capa más externa cuando se inicia un nuevo periodo. Esta capa exterior se ubica mucho más lejos del núcleo, y así aumenta el radio del átomo. Además, los electrones en las conchas internas pueden proteger de manera muy efectiva la carga nuclear del electrón agregado a la nueva capa que tiende a aumentar el radio del átomo. En resumen:
Tendencia 2: El radio atómico salta cuando se inicia un nuevo periodo.
Como tercera tendencia se puede ver que los radios atómicos aumentan a medida que baja un grupo. Esto se debe a que dentro de un grupo hay el mismo número y tipo de electrones de valencia, pero los electrones de valencia están en una capa más externa asociada a un número cuántico mayor n. En una visión algo diferente también podemos argumentar que las dos primeras tendencias se suman para dar la tercera tendencia. El efecto de salto de radio atómico cuando se inicia un nuevo periodo es mayor que el efecto de disminución del radio dentro de un periodo. Como resultado, el radio tiende a aumentar a medida que baja un grupo. En resumen:
Tendencia 3: El radio atómico aumenta continuamente dentro de un grupo.
La determinación de un radio atómico no es tan trivial en que pueda parecer. Se puede obtener ya sea a partir de cálculos mecánicos cuánticos, o determinarlo experimentalmente. Si lo calculas, entonces el radio se define como el radio que define el volumen en el que se puede observar el electrón con 90% de probabilidad. Los radios que se ven en la Figura 1.3.2 son realmente radios calculados. Si determina el radio experimentalmente, entonces nuevamente hay diferentes subtipos de radios. Los llamados radios metálicos o cristalinos, los radios de VanderWaals y los radios covalentes. El radio covalente es la mitad de la distancia entre dos, mismos átomos en una molécula que se mantienen unidos en un solo enlace covalente.
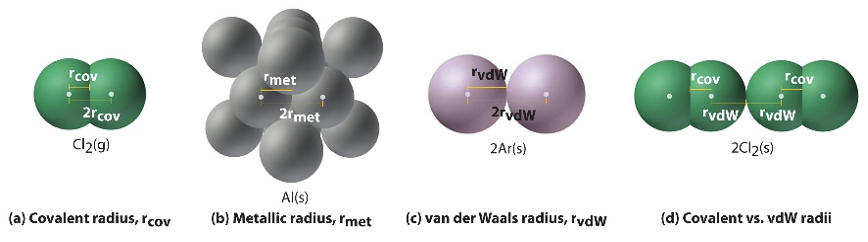
Esto es inequívoco para moléculas como Cl 2, los otros halógenos, y para otros casos como hidrógeno, carbono (como diamante), azufre, y algunos otros casos. Sin embargo, para el oxígeno, O 2, la situación es menos clara ya que el orden del enlace oxígeno-oxígeno es 2. En este caso, es necesario inferir el radio covalente a partir de moléculas que contienen enlaces simples O-O o de moléculas que contienen un enlace sencillo E-X (E=elemento) en el que se conoce el radio covalente de X. El radio de van der Waals es la mitad de la distancia entre dos mismos átomos en un cristal cuando no hay unión real entre el átomo excepto fuerzas débiles de van der Waals. Por ejemplo, en el argón sólido, solo hay fuerzas de van der Waals entre los átomos, y la mitad de la distancia entre los átomos en argón sólido es el radio de Van der Waals. Para el cloro, por ejemplo, el radio de van der Waals es la mitad de la distancia entre dos átomos de cloro de dos moléculas diferentes de Cl 2 en Cl 2 sólido. Tenga en cuenta que el radio de cloro de van der Waals es diferente al radio covalente del cloro. Esto demuestra nuevamente que existe cierta ambigüedad a la hora de determinar un radio atómico, y por lo tanto siempre es importante decir qué definición de radio atómico usas. Por último, también está el radio metálico que se aplica a los metales sólidos en los que los átomos metálicos se mantienen unidos por unión metálica. El radio metálico se define como la mitad de la distancia entre los centros de dos átomos metálicos dentro de un metal.
Primera Energía de Ionización
La primera energía de ionización es otra propiedad periódica importante de los elementos. Se define como la energía requerida para eliminar un electrón de un átomo neutro en la fase gaseosa. Es importante entender que aquí nos referimos a un átomo en la fase gaseosa, pues sólo en la fase gaseosa los átomos no interactúan significativamente entre sí. Por lo tanto, solo al mirar un átomo en la fase gaseosa podemos determinar verdaderamente las propiedades de los átomos individuales y aislados. Veamos las dos imágenes (Figura 1.3.4) para determinar tendencias periódicas.
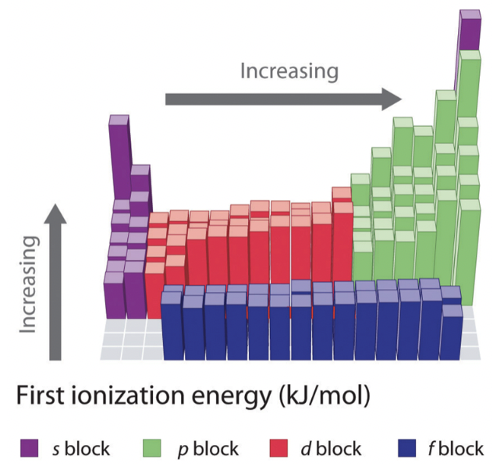
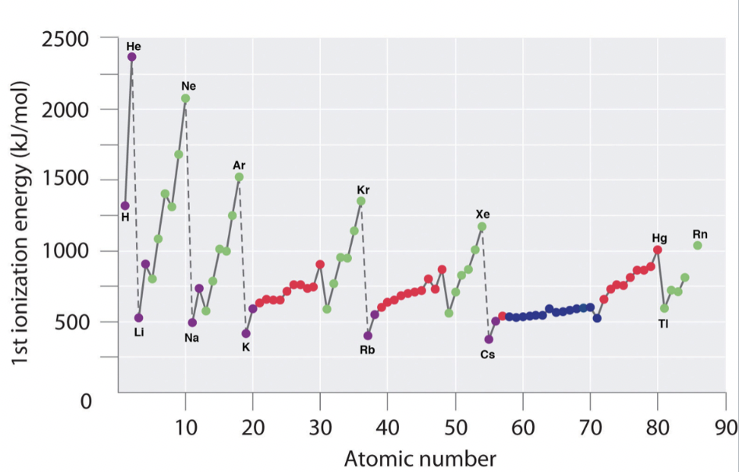
En primer lugar tenemos que darnos cuenta de que todas las energías de 1ra ionización son positivas. Esto quiere decir que siempre requiere energía para eliminar un electrón de un átomo neutro. Esto se puede entender cuando se considera que todos los electrones en un átomo están unidos al núcleo a través de una energía de unión. Si una energía de ionización fuera negativa entonces esto significaría que el átomo perdería espontáneamente un electrón, e ionizaría espontáneamente. Esto sería irrazonable.
Ahora veamos cómo cambia la primera energía de ionización dentro de un periodo. Podemos ver que aumenta a medida que vamos de izquierda a derecha dentro de un periodo. Esta tendencia puede explicarse por el hecho de que la carga nuclear efectiva aumenta de izquierda a derecha dentro de un periodo. A medida que aumenta la carga nuclear efectiva, aumenta la atracción del núcleo sobre el electrón más externo y, por lo tanto, más difícil es eliminar este electrón del átomo. Se puede ver, sin embargo, que dentro de los elementos principales del grupo la tendencia se rompe dos veces. Los elementos del grupo 13 tienen una energía de ionización menor que los elementos del grupo 2, y el grupo 16 elementos tienen una energía de ionización menor que el grupo 15 elementos. Este fenómeno puede explicarse por el hecho de que las subcáscaras llenas y semillenas en el grupo 2 y el grupo 15 representan configuraciones de electrones particularmente estables, y así los electrones dentro de estas subcapas tienen una energía inusualmente baja. Por esa razón estos electrones son más difíciles de eliminar de los átomos. Los elementos del grupo 2 tienen subcapas s rellenas, y el grupo 15 elementos tienen subcapas p medio rellenas. También puedes notar que el aumento en la energía de ionización es menos pronunciado dentro del bloque d, e incluso menos pronunciado con en el bloque f. Esto se debe a que la carga nuclear efectiva en los electrones más externos no aumenta tanto porque los orbitales d y f internos se están llenando. También se puede ver que los elementos del grupo 13 tienen una energía de ionización menor que los elementos del grupo 12. Esto se debe a que en el grupo 13 se inicia una nueva subcapa p y los nuevos electrones se agregan al caparazón más externo donde los efectos de blindaje son más pequeños.
Como segunda tendencia se puede ver que cada vez que se inicia un nuevo periodo, la energía de ionización disminuye drásticamente. Esto se debe a que el nuevo electrón se agrega a una nueva capa más externa donde la carga nuclear efectiva que actúa sobre el nuevo electrón es mucho menor. La tercera tendencia es que la energía de ionización se vuelve más pequeña a medida que bajamos de grupo. Esto se debe a que la carga nuclear efectiva en los electrones de valencia disminuye debido a que aumenta el número cuántico n de los electrones de valencia. Hay una peculiaridad que necesita una explicación adicional. La caída de la energía de ionización del hidrógeno al litio en el primer grupo es inusualmente grande. Esto se debe a que el hidrógeno es el único elemento para el que no hay efectos de blindaje, simplemente porque el hidrógeno tiene un solo electrón. Por esa razón, el electrón de valencia 1s del hidrógeno es mucho más difícil de eliminar que los electrones de valencia de los otros elementos del grupo 1.
Afinidad de electrones
Ahora consideremos la primera afinidad electrónica (Figura 1.3.5). Se define como la energía requerida o liberada cuando se agrega un electrón a un átomo neutro en la fase gaseosa. Nuevamente, miramos un átomo en la fase gaseosa, porque queremos considerar un átomo aislado que no haga interacciones significativas con otros átomos.
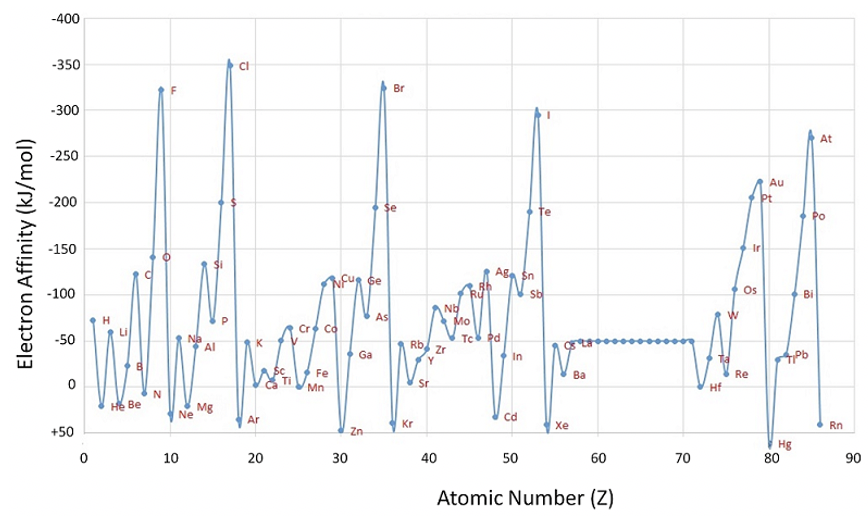
Podemos ver en la gráfica que la mayoría de los elementos tienen afinidades electrónicas negativas, es decir, que la adición de un electrón libre a un átomo neutro es exotérmica, y libera energía, sin embargo, no siempre es así. Algunos elementos tienen afinidades negativas de electrones, en particular los gases nobles, pero también Be, N, Mg, Zn, Cd y Hg. Zn, Cd y Hg, son elementos del grupo 12 con una subcapa d completa que es particularmente estable. Se necesitaría agregar un electrón adicional a un orbital p de una capa superior que es energéticamente bastante desfavorable. Del mismo modo, Be y Mg tienen subconchas rellenas que también son bastante estables. Agregar un electrón adicional necesitaría comenzar una nueva subcapa, que energéticamente no es favorable. Se puede ver que Ca y Sr tienen afinidades electrónicas de aproximadamente 0, y la de Ba es sólo ligeramente negativa mostrando que periodos más altos hacen que la adición de un electrón a una nueva capa p sea ligeramente más favorable. El nitrógeno tiene una subcapa p medio llena, que también es una configuración electrónica bastante estable, y por lo tanto agregar un electrón no es favorable. La adición de un electrón es ligeramente más favorable para los otros 15 elementos del grupo, sin embargo, estos también tienden a tener afinidades electrónicas bastante bajas.
Generalmente, para los elementos del grupo principal la afinidad electrónica tiende a aumentar del grupo 1 al grupo 17. Sin embargo, la tendencia se rompe para los elementos del grupo 2 y del grupo 15 debido a que estos elementos tienen subcapas llenas y medias rellenas, respectivamente. Además, es de destacar que los elementos del grupo 1 tienen mayores afinidades electrónicas que los elementos del grupo 3. Esto se debe a que agregar un electrón a un elemento del grupo 1 produce una subcapa s completa que es bastante estable. Para los elementos del bloque d, la afinidad electrónica tiende a aumentar del grupo 3 al grupo 11, pero la tendencia se rompe varias veces mostrando que cada elemento necesitaría ser investigado individualmente lo que está más allá del alcance aquí. Hay una gran caída en la afinidad electrónica del grupo 17 al grupo 18 lo cual se explica fácilmente por el hecho de que la adición de un electrón a un elemento del grupo 17 produce una cáscara llena, mientras que un elemento del grupo 18 ya tiene una capa completa, y la adición de un electrón iniciaría una nueva concha. De igual manera, hay una fuerte caída en la afinidad electrónica del grupo 11 al grupo 12, ya que una adición de un electrón a un átomo del grupo 11 produce una subcapa completa, mientras que la adición de un electrón a un elemento del grupo 12 requeriría el inicio de una nueva subcapa más externa. Para los elementos del bloque p la afinidad electrónica tiende a aumentar primero del periodo 2 al 3, y luego disminuir. Para el bloque s hay una disminución constante por un grupo. Para los elementos de bloque d no hay una tendencia clara para la afinidad electrónica.
Electronegatividad
Por último, estudiemos la electronegatividad como propiedad periódica. La electronegatividad es la medida de la capacidad de un átomo para atraer electrones dentro de un enlace químico. Se relaciona con la afinidad electrónica en el sentido de que ambas propiedades de periodo miden la fuerza por la cual un electrón es atraído hacia un átomo neutro. Sin embargo, la afinidad electrónica está asociada con átomos aislados, que no hacen enlaces a átomos vecinos, mientras que la electronegatividad se refiere a átomos que están unidos a átomos vecinos. La importancia de la electronegatividad se deriva en gran medida de su capacidad para predecir y comprender la naturaleza de la unión entre los átomos, en particular, los enlaces covalentes, iónicos y metálicos.
Escalas de Electronegatividad
La electronegatividad fue un concepto desarrollado por primera vez por Linus Pauling para describir la polaridad relativa de enlaces y moléculas. Argumentó que la electronegatividad de un átomo podría derivarse de las diferencias de energía de enlace entre enlaces homolépticos y heterolépticos (Ec. 1.3.1).

Ecuación 1.3.1 Electronegatividad según Pauling, eV = electrón voltios.
Por ejemplo, la energía requerida para romper el enlace en H 2 es 432 kJ mol -1, y para F 2 es 159 kJ mol -1. Sin embargo, la energía requerida para romper un enlace en HF es 565 kJ mol -1, que es mucho mayor de lo esperado solo al promediar la energía de los dos enlaces homonucleares (296 kJ mol -1). Pauling argumentó que la diferencia podría asignarse a las atracciones electrostáticas entre los “extremos” F y H de la molécula, por lo que el extremo F tiene más densidad de electrones y el extremo H tiene menos densidad electrónica. Cuanto mayor sea la diferencia entre la energía promedio de los enlaces homolépticos y los enlaces heterolépticos, mayor será la diferencia de electronegatividad entre los átomos, y mayor será la polaridad del enlace heteroléptico.
Primero, Pauling utilizó las medias aritméticas de las energías de enlace heterolépticas, posteriormente utilizó las medias geométricas, porque encontró empíricamente que funcionaba mejor (Ecuación 1.3.1). La media geométrica de las energías de enlace homolépticas es la raíz cuadrada del producto de las energías de enlace homolépticas. Este método solo proporcionó diferencias de electronegatividad. Por lo tanto, necesitaba definir un átomo de referencia con un valor de electronegatividad definido arbitrariamente, para luego determinar los valores de electronegatividad de todos los demás átomos relativos a ese valor. Eligió el átomo más electronegativo, el átomo de flúor, como estándar y le asignó un valor de 4.0. Los valores de todos los demás átomos varían entre 0.7 (Fr) y 3.44 (O), y se muestran en la tabla periódica a continuación (Fig. 1.3.6).
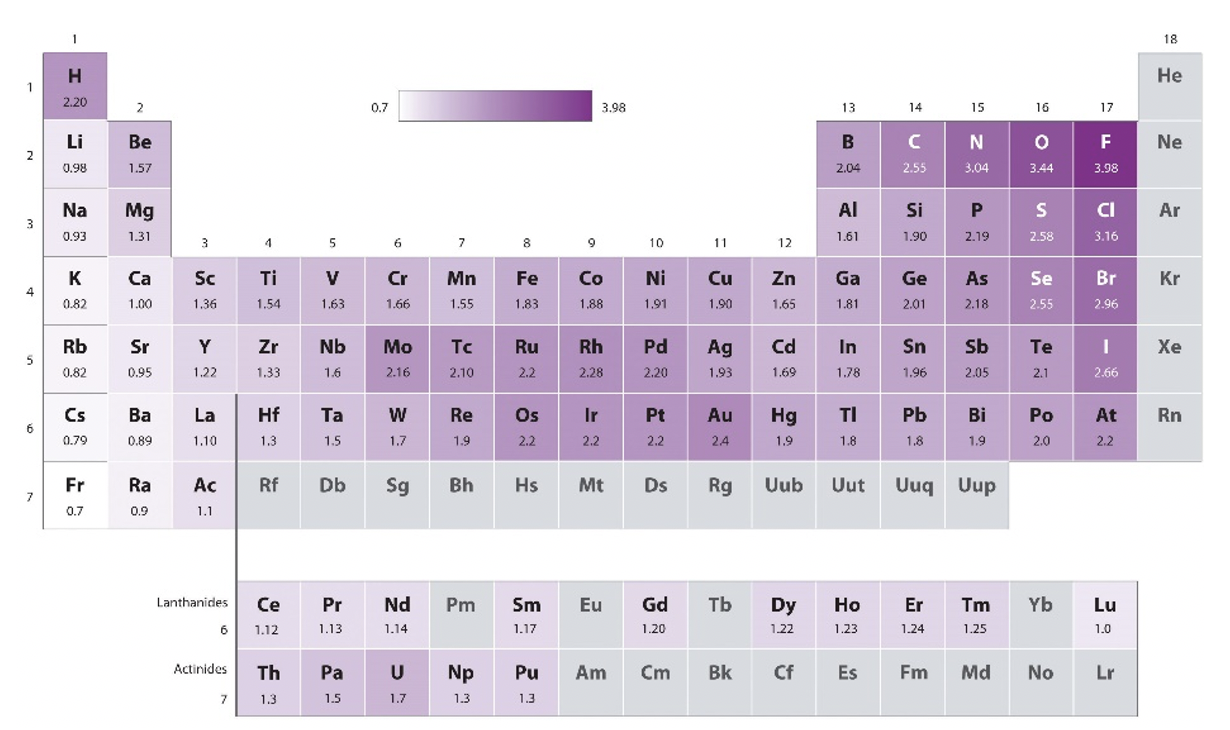
¿Cuáles son las tendencias periódicas? Se puede ver que dentro de un periodo los valores de electronegatividad de los elementos del grupo principal aumentan estrictamente con el número de grupo. Tenga en cuenta, sin embargo, que los gases nobles no tienen una electronegatividad Pauling porque, con pocas excepciones, los gases nobles no producen compuestos y por lo tanto no hay energías de enlace disponibles para ellos. También podemos ver que para los elementos del grupo principal la electronegatividad disminuye estrictamente en un grupo. Esto hace que el flúor sea el átomo más electronegativo, y el cesio el átomo menos electronegativo. El cesio tiene un valor de electronegatividad de 0.7. Aquí ignoramos el francio radiactivo. Para el bloque d, las tendencias son menos estrictas, pero hay una tendencia de incremento de electronegatividad del grupo 3 al grupo 11. Todos los elementos del grupo 12 tienen electronegatividades más pequeñas en comparación con sus elementos vecinos del grupo 11. ¿Qué pasa con las tendencias dentro de un grupo? En el grupo 3 al grupo 5 hay una pequeña disminución en la electronegatividad en un grupo. Para los grupos 6 y 9, los elementos del periodo 5 tienen valores mayores que sus elementos vecinos en los periodos 4 y 6. Para el grupo 10 al 12 la electronegatividad aumenta en un grupo. El elemento d-block con mayor electronegatividad es el oro, tiene un valor de 2.4. Tenga en cuenta que esto es similar a la electronegatividad de no metales como I, S y P. Por estas razones, a veces el oro puede comportarse como un no metal en compuestos con muy baja electronegatividad. Por ejemplo, está el compuesto aurida de cesio (CSau) que es un compuesto cristalino iónico transparente debido a la alta diferencia de electronegatividad entre el cesio y el oro. Los elementos del bloque f generalmente tienen baja electronegatividad.
La escala de electronegatividad de Pauling se deriva de datos empíricos sobre energías de enlace. Funciona muy bien en la práctica y es hasta la fecha la escala de electronegatividad más utilizada. Sin embargo, no para relacionar la electronegatividad con otras propiedades periódicas, y el modelo cuántico-mecánico de los átomos. Una escala de electronegatividad que aborda este defecto la escala Allred-Rochow. Se relaciona la electronegatividad con la fuerza Coulomb que actúa sobre un electrón en la superficie de un átomo. La fuerza de Coulomb es proporcional a la carga nuclear efectiva Z* e inversa proporcional al radio atómico cuadrado. Z*/r 2 se multiplica con un factor de 3590 y se agrega un valor de 0.744 a este término. Estos números se eligen empíricamente para que los valores de la escala Allred-Rochow sean comparables a la escala Pauling.
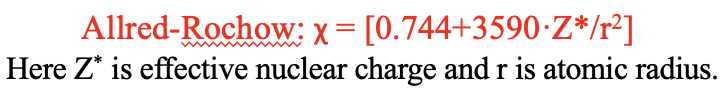
Ecuación 1.3.2 Definición de electronegatividad Allred-Rochow
Otra escala de uso frecuente es la escala de electronegatividad de Mulliken. La escala Mulliken relaciona la electronegatividad con la suma de la primera energía de ionización IE y la primera afinidad electrónica EA. Intuitivamente estaríamos de acuerdo en que la capacidad de un átomo para atraer electrones dentro de un enlace químico es mayor, más difícil es eliminar un electrón de un átomo aislado, y más fácil es agregar un electrón a un átomo aislado. Los números 0.118 y -0.207 se eligen empíricamente para hacer comparaciones con la escala de Pauling posibles. La escala Mulliken está relacionada con la escala Allred-Rochow en el sentido de que se pueden explicar las energías de ionización y las afinidades electrónicas de los átomos con el concepto de la carga nuclear efectiva.

Ecuación 1.3.3 Definición Mulliken de electronegatividad
Otra escala de electronegatividad ha sido desarrollada por Leland C. Allen. Se diseñó para elementos del grupo principal en particular. Argumenta que la electronegatividad es proporcional a la energía promedio de los electrones de valencia s y p en el átomo. Este concepto de electronegatividad también tiene una relación con el de Allred-Rochow, porque las energías orbitales pueden calcularse a partir de la carga nuclear efectiva.
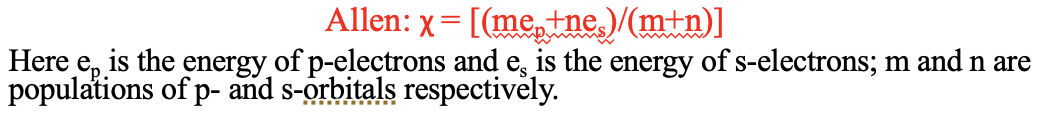
Ecuación 1.3.4 Definición de electronegatividad de Leland C. Allen
En general, se puede ver que las escalas de electronegatividad están interrelacionadas, dicen esencialmente lo mismo, pero presentan la electronegatividad desde una perspectiva algo diferente.
Electronegatividad de los Elementos y Adhesión Química
Uno de los atributos más poderosos de la electronegatividad es que puede predecir qué tipo de enlace químico es esperar en elementos y compuestos. Veamos primero la unión entre los elementos.
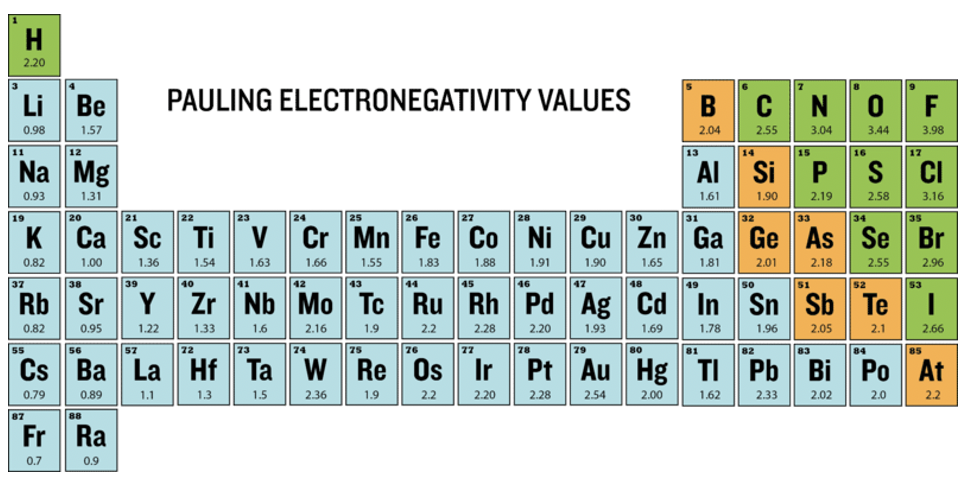
En la tabla periódica representada (Figura 1.3.7) se puede ver el tipo de enlace químico entre átomos indicados por diferentes colores. Hay unión metálica en los metales, indicada por el color azul. En los enlaces metálicos los electrones se comparten entre átomos pero se deslocalizan sobre muchos átomos en el metal. El color verde indica unión covalente observada en no metales. En la unión covalente los electrones son compartidos, pero localizados entre típicamente dos átomos. Los metaloides tienen unión química con una mezcla de carácter covalente y metálico que se muestra en naranja. Hay intercambio de electrones con un grado moderado de deslocalización. Los valores de electronegatividad Pauling de los elementos se escriben debajo de los símbolos del elemento.
¿Podemos relacionar los valores de electronegatividad con la unión química en los elementos? Podemos ver claramente que los elementos con altos valores de electronegatividad significativamente por encima de 2.0, los no metales, tienden a hacer enlaces covalentes entre ellos. Todos los metaloides con un carácter híbrido covalent-metálico, tienen electronegatividad intermedia alrededor de 2.0. La mayoría de los metales tienen valores bajos de electronegatividad por debajo de 2.0 excepto metales nobles como Pt y Au. En general, podemos decir que existe una clara relación entre el tipo de unión en un elemento y su electronegatividad. Ahora veamos si la electronegatividad también puede predecir la unión química en los compuestos.
Triángulo de Ketelaar
La capacidad de la electronegatividad para predecir el tipo de unión en compuestos puede ser entendida por el triángulo de Ketelaar, llamado así por J.A.A. Ketelaar.
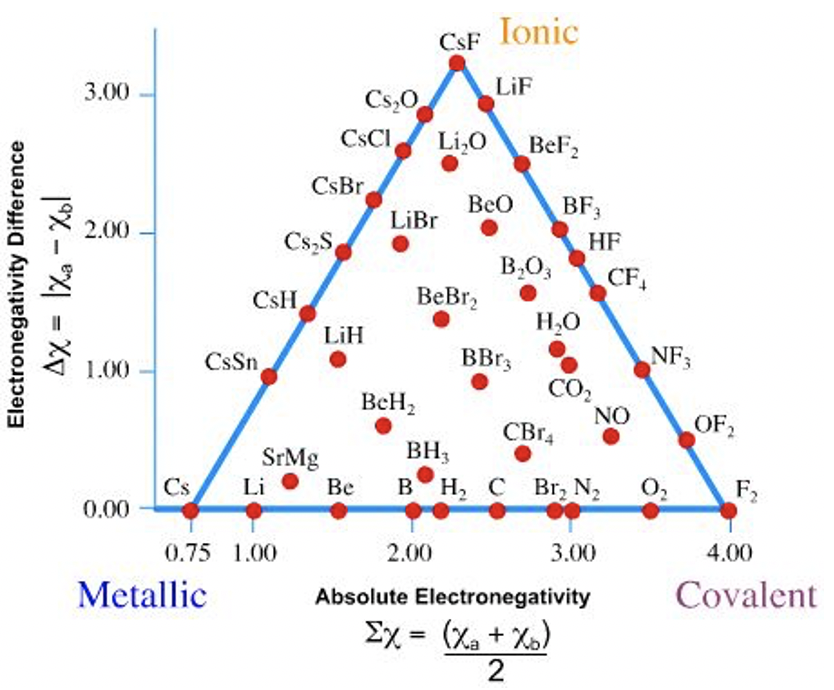
Se puede ver que el triángulo de Ketelaar tiene tres esquinas (Figura 1.3.8). Dos de las esquinas están ocupadas por los elementos F y Cs, y la tercera esquina está ocupada por CsF. Todos los elementos están ubicados en el borde horizontal del triángulo, y hay muchos compuestos indicados por puntos ya sea en los otros dos bordes o dentro del triángulo. No hay compuestos ni elementos fuera del triángulo. ¿Cómo podemos entender este triángulo y qué dice sobre la relación entre el carácter de unión y la electronegatividad? Para entender esto, mira los dos ejes. El eje x horizontal representa la electronegatividad promedio de los átomos en un elemento o un compuesto. El eje y vertical representa la diferencia de electronegatividad entre los átomos en los elementos o el compuesto. Para los elementos la diferencia de electronegatividad entre los átomos es cero, pues en un elemento todos los átomos son del mismo tipo. Por lo tanto, todos los elementos se encuentran en el borde orientado horizontalmente del triángulo. Debido a que Cs es el elemento con la electronegatividad más baja, se encuentra más a la izquierda en este borde. El flúor es el elemento con la electronegatividad más alta, y así se encuentra el más alejado del lado derecho. Los demás elementos están ubicados entre el cesio y el flúor en el borde. Cuanto mayor sea la electronegatividad de los elementos, más a la derecha su posición en este borde del triángulo.
Para los compuestos, la diferencia de electronegatividad entre los átomos nunca es exactamente cero, por lo tanto, todos los compuestos se encuentran por encima del borde horizontal del triángulo. El compuesto con la mayor diferencia de electronegatividad es el CsF. Su electronegatividad promedio es la suma la electronegatividad de Cs y F dividida por 2: Por lo tanto, CsF define la tercera esquina del triángulo. Todos los demás compuestos deben estar en los bordes o dentro del triángulo. Todos los compuestos de cesio se encuentran en el borde entre el Cs y el CsF, y todos los compuestos de flúor se encuentran en el borde entre CsF y F2. Los compuestos de todos los demás elementos están dentro del triángulo. La posición del compuesto sobre o en el triángulo define su carácter de unión. Cuanto más cerca esté la posición del compuesto hacia la esquina Cs, más metálica, más cerca está la posición de la esquina F2, más covalente, y cuanto más cerca está de la esquina CsF, más iónica. Por ejemplo Li 2 O se localiza cerca de CsF, y el enlace sería predominantemente iónico, aunque también hay un pequeño grado de unión covalente y metálica. En contraste con eso, sRMg tiene principalmente enlaces metálicos, un poco de enlace covalente e incluso menos enlaces iónicos. La situación de unión en LiH está entre metálico e iónico, con un poco de carácter de enlace covalente mezclado. Tenga en cuenta que no es posible un enlace iónico 100% porque la diferencia de electronegatividad es finita, y por lo tanto siempre debe haber cierto grado de compartición de electrones. En contraste con eso, un enlace 100% covalente es posible porque los electrones pueden ser igualmente compartidos entre dos átomos cuando la diferencia de electronegatividad es cero.
El mensaje para llevar a casa es que en compuestos y elementos suele haber una mezcla de tipos de unión, y ni un solo tipo de unión, incluso a través de un tipo de unión puede dominar fuertemente. El concepto de electronegatividad, y el triángulo de Ketelaar en particular, es extremadamente útil para predecir en qué grado están presentes los tres tipos de unión en una sustancia.


