8.1: Microestados y Términos
- Page ID
- 70219
Una mirada más cercana a los espectros electrónicos
Echemos un vistazo más de cerca a los espectros de absorción óptica, también llamados espectros electrónicos de compuestos de coordinación. Anteriormente hemos argumentado que la teoría de campos de ligandos puede predecir y explicar los espectros electrónicos. Sin embargo, solo en relativamente pocos casos la teoría de campo de ligandos (LFT) es suficiente para explicar los espectros. Por ejemplo, el ion complejo hexaaqua níquel (2+) es un ion octaédrico de complejo d 8. Según la teoría del campo de ligandos, los orbitales d metálicos en un campo octaédrico son los orbitales t 2g y e g —orbitales (Fig. 8.1.1). Seis electrones están en los orbitales t 2g, y dos electrones están en los orbitales e g. La teoría del campo de ligandos predeciría que existe una transición electrónica posible, a saber, la promoción de un electrón de un t 2g a un orbital e g. Este proceso sería desencadenado por la absorción de luz por lo que la longitud de onda de la luz dependería de la Δ o entre los orbitales t 2g y e g. En general, esto debería conducir a una sola banda de absorción en el espectro de absorción del complejo. Podemos verificar esta predicción registrando experimentalmente el espectro de absorción del complejo (Fig. 8.1.1).
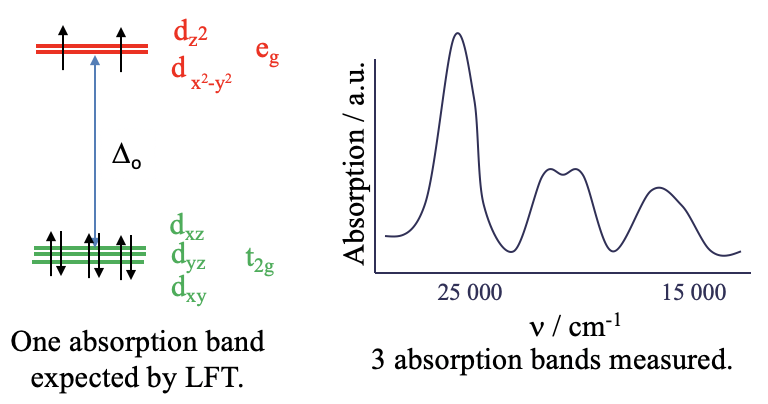
Lo que encontramos es que el espectro de absorción es mucho más complejo de lo esperado. En lugar de solo una sola banda de absorción hay múltiples. Obviamente, la teoría del campo de ligandos es incapaz de explicar este espectro. La pregunta es ¿por qué? La respuesta es: LFT asume que no hay interacciones electrón-electrón. Sin embargo, en realidad hay repulsión entre electrones en d-orbitales y esto tiene un efecto sobre su energía.
Efecto de las interacciones electrón-electrón
Veamos más de cerca esto. Para simplificar el problema consideremos primero un ion d 2 en un campo de ligando octaédrico (Fig. 8.1.2).
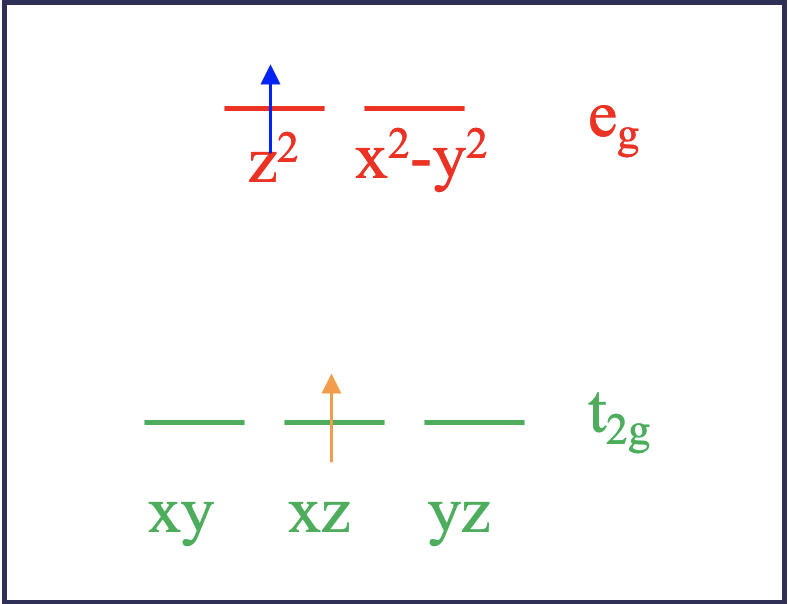
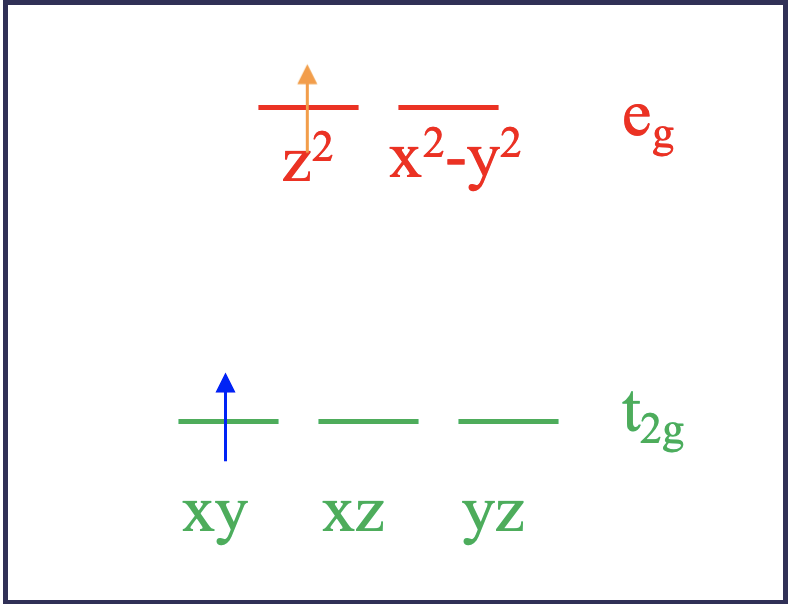
De acuerdo con la teoría del campo de ligandos, los dos electrones estarían en los orbitales t 2g cuando se encuentran en el estado fundamental. Por ejemplo, podrían estar en los orbitales xy, y xz. A esto se le llama microestado. Se le llama microestado de un estado porque hay otras combinaciones de orbitales posibles. Por ejemplo, el estado fundamental también se realizaría si los dos electrones estuvieran en los orbitales xz e yz. Esta combinación sería otro microestado asociado con la configuración electrónica del estado fundamental. Tras la excitación usando luz, el electrón en el orbital d xy podría promoverse a un orbital e g, que podría ser el d z 2 o el d x 2 -y 2. Esas dos posibilidades reflejan diferentes microestados asociados con el estado excitado (Fig. 8.1.2). Supongamos que el electrón entra en el orbital d z 2. En este microestado un electrón estaría en el orbital d xz y el otro en el orbital d z 2. Ahora hay otra posibilidad de cómo excitar un electrón. Podríamos suponer que no el electrón d xy se promueve al orbital d z 2, sino que se promueve el electrón d xz. En este caso, realizaríamos un microestado en el que un electrón en el orbital d xy y el otro en el orbital d z 2.

Ahora comparemos los dos casos. La teoría del campo del ligando argumentaría que ambos microestados excitados tienen la misma energía. No obstante, de hecho no lo hacen. ¿Por qué? Eso se debe a que los electrones en los dos microestados excitados interactúan de manera diferente. Esto se vuelve plausible al considerar las formas orbitales (Fig. 8.1.3). El orbital d xz tiene densidad electrónica en el eje z, mientras que el orbital d xy no. Por lo tanto, se esperaría que los electrones en estos orbitales interactuaran de manera diferente con un electrón en un orbital d z 2 que tiene la mayor parte de su densidad electrónica en el eje z. En consecuencia, los dos microestados excitados no tienen la misma energía. Esto significa que para promover el electrón a los dos microestados diferentes necesitamos diferentes cantidades de energías. Así, el complejo absorbería la luz con más de una sola longitud de onda. Esto contrasta con lo que predice la teoría del campo de ligandos. ¿Qué tendremos que hacer para predecir correctamente cuántas bandas de absorción obtenemos? La respuesta es, debemos encontrar todos los microestados posibles para la configuración de electrones d 2 y agrupar los que tienen la misma energía. Un grupo de microestados con la misma energía se llama término. El número de transiciones de electrones puede entonces predecirse a partir del número de términos.
Russell Saunders Acoplamiento de Electrones en Iones Libres
Nuestra tarea es ahora encontrar todos los términos para el complejo octaédrico con configuración de electrones d 2. Para simplificar las cosas veamos primero un ion d 2 libre. Un ion libre es un ion que no está coordinado por ningún ligando.

La energía de los microestados depende de los números cuánticos m l y m s de los electrones (Fig. 8.1.4 y Fig. 8.1.5). Esto se debe a que estos números cuánticos de determinan cómo interactúan los electrones. Esto también se llama el acoplamiento Russell-Saunders de electrones. Veamos primero cómo el número cuántico m l de los electrones influye en el término símbolo. El término está determinado por el microestado con el número cuántico más alto M L, por lo que M L es la suma de los números cuánticos m l de los electrones individuales. El valor máximo M L también se llama el número cuántico de momento angular orbital total L. El valor L también le indica cuántos microestados pertenecen a un término debido a estas interacciones magnéticas. El número de microestados es 2L+1. Esto se debe a que M L puede variar entre —L y +L. Entonces, por ejemplo, si L=2, M L puede adoptar los valores -2, -1, 0, +1 y +2, y eso se traduce en 2L+1 = 5 microestados.
El número cuántico L por sí solo no define el término todavía. Además, también debemos considerar la interacción de los espines de los electrones (Fig. 8.1.5).

El número cuántico de espín m s de un solo electrón puede ser +1/2 o -1/2. Cuando los espines de los electrones interactúan, sus números cuánticos de espín se suman, definiendo el momento angular de giro total M s. El microestado con el valor máximo de M s define el número cuántico de momento angular de giro total S. El número de microestados debido a las interacciones espín-espín que pertenecen al término es 2S+1. Esto también se llama multiplicidad de espín (Fig. 8.1.6).
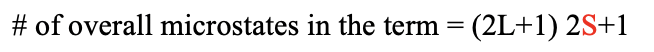
En general el término tiene (2L+1) (2S+1) microestados. El número cuántico angular orbital total L y el número cuántico de espín orbital total S definen el término símbolo (Fig. 8.1.7).
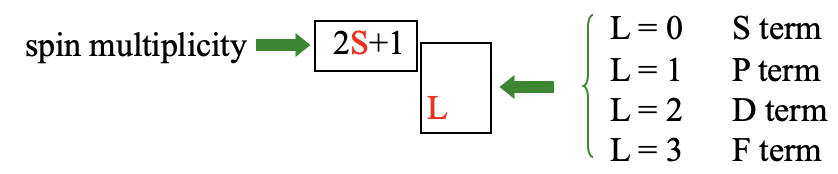
Cuando L=0 tenemos un término S, cuando L=1, tenemos un término P, cuando L=2, lo llamamos término D, y cuando L=3 lo llamamos término F. Estos símbolos se eligen en analogía con los símbolos s, p, d y f para orbitales. La multiplicidad de espín 2S+1 se escribe entonces como un superíndice frente a la letra definida por L. Esto da el símbolo general del término para un término. Llamamos a un término con una multiplicidad de espín de 1 un término singlete, cuando 2S+1=2, llamamos al término término doblete. Un término con una multiplicidad de espín de tres se denomina término triplete, uno con una multiplicidad de espín de 4 un término de cuarteto, y así sucesivamente.
Microestados para un ion d 2 libre
¿Cuáles son los posibles microestados y el número total de microestados para un ion libre con configuración de d-2 electrones? Esto lo podemos expresar en una llamada tabla de microestados (Fig. 8.1.8).
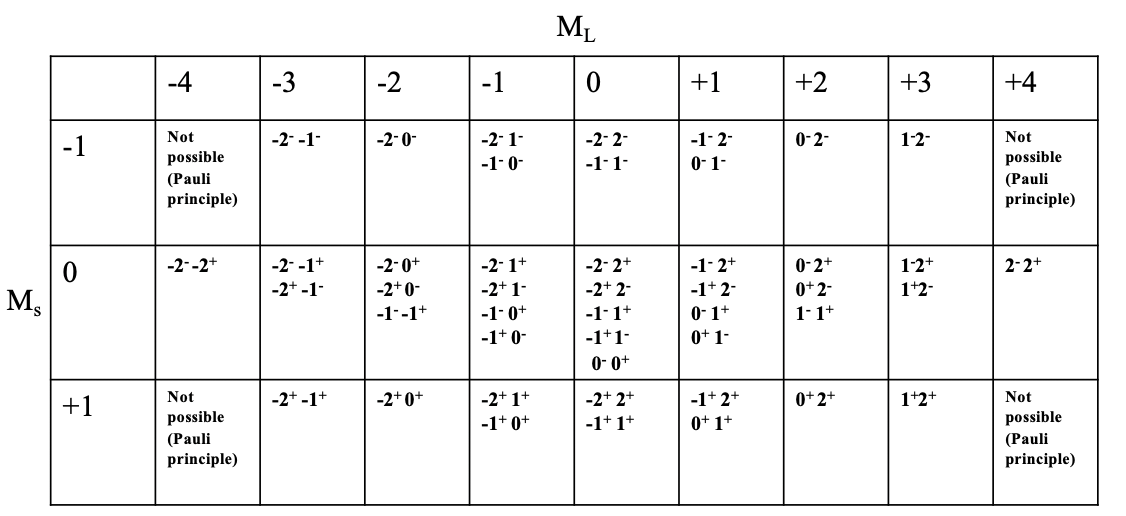
Puede ver la tabla de microestados para la configuración de electrones d 2 representada anteriormente. Cada columna representa un posible valor M L. Para la configuración d 2, M L puede adoptar valores de -4 a +4, de ahí que existan 9 columnas. Cada fila representa el posible valor de M s. Para la configuración de electrones d 2, M s puede variar entre +1 y -1. +1 significa que ambos electrones tienen el espín +1/2, 0 significa que un electrón tiene el espín +1/2 y el otro tiene el espín -1/2. El valor M s de -1/2 se adopta cuando ambos electrones tienen el espín -1/2. Ahora podemos combinar cada valor M s con cada valor M L que define un campo particular en la tabla. Se puede ver que algunos campos están vacíos debido al principio Pauli. Por ejemplo, el campo para M L =-4 y M s =-1 no está lleno porque en este caso ambos electrones tendrían los mismos números cuánticos, a saber m l =-2, y m s =-1/2. Podemos ver además que para algunos campos sólo es posible una combinación de electrones, mientras que para otros hay múltiples. Por ejemplo, para el campo con M L =4 y M s =0 solo hay una combinación de electrones posible. Se puede ver el símbolo “2 - 2 +” en este campo. Esto significa que el primer electrón tiene un valor m l de 2 y un espín de -1/2 y el segundo electrón también tiene un valor m l de 2 y un valor de m s de +1/2. El campo más poblado es el campo para M L =0 y M s =0. En general hay cinco microestados con esa combinación de valores M L y M s. Si contamos el número total de microestados en la tabla entonces llegamos al número 45. Esto es consistente con lo que esperaríamos de acuerdo con la fórmula #microstates = (2L+1) (2S+1). En nuestro ejemplo L=4 y S = 1, y así el número de microestados es ((2x4) +1) ((2x1) +1) =45. En general para una configuración de electrones d n con n electrones d el número de microestados es (¡10!) /((10-n)! n!).
Una propiedad útil de una tabla de microestados es que podemos derivar los términos y símbolos de término para una configuración de electrones particular a partir de ella. Por razones de simplificación, indicamos un posible microestado en la tabla simplemente por una “x”. Luego dibujamos la caja rectangular más grande posible en la microestable que contiene solo campos con al menos una posible combinación de electrones (Fig. 8.1.9).
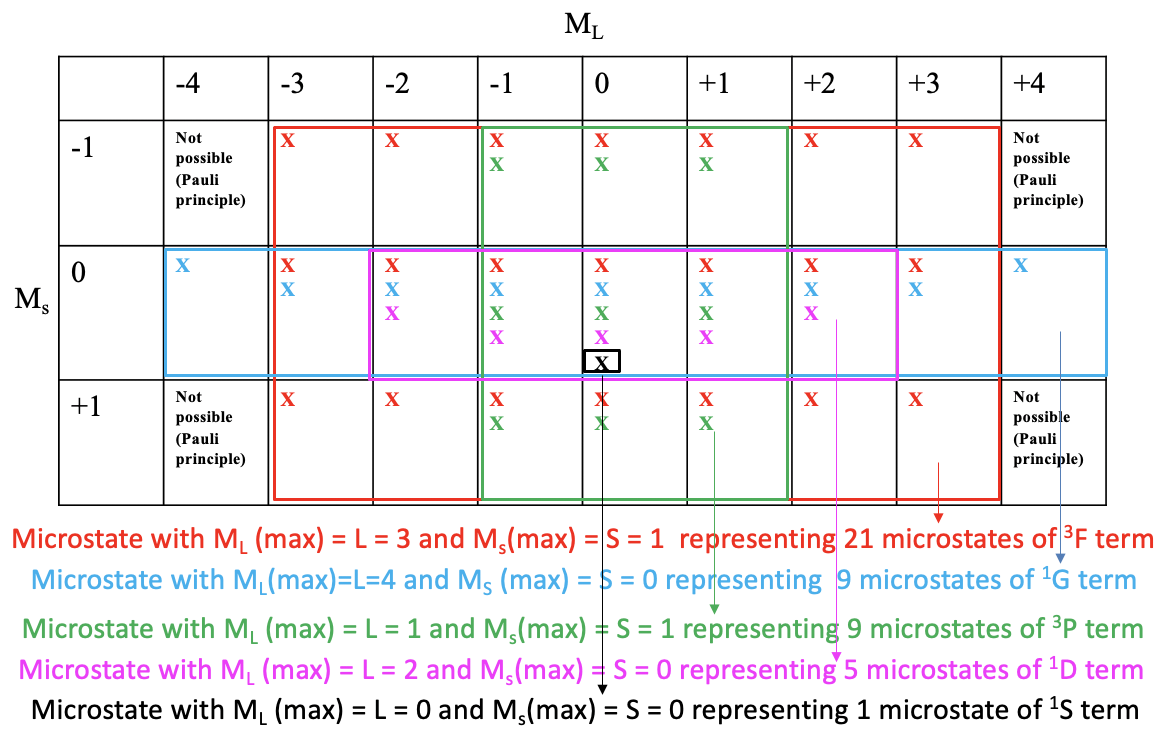
Se puede ver que la caja más grande posible es la caja roja dibujada (Fig. 8.1.9). Esta caja contiene los microestados que pertenecen al primer término de la configuración electrónica d 2. El número de microestados es igual al número de campos dentro del cuadro rojo. Eso hace 7x3=21 microestados. ¿Cuál es el término símbolo para este término? Para responder a esta pregunta necesitamos encontrar el microestado en la caja roja que tenga el mayor M L y el mayor valor de M s. Se puede ver que es el que tiene M L =3 y M s = 2. Así, L=3 y S=1. Esto define el término como un término 3 F porque 2S+1 = 3, y L=3 corresponde al término símbolo F. Este término es un término triplete. Tenga en cuenta que un término triplete también incluye microestados con giros emparejados. En general, siete de los 21 microestados tienen M s =0.
A continuación, miramos cuál es la siguiente caja rectangular más grande que podemos dibujar, y que contiene microestados que aún no consideramos. Podemos ver que la caja azul contiene nueve campos que equivalen a nueve microestados. El microestado dentro de esta caja que tiene los valores más altos de M L y M s es el que tiene M L =4 y M s =0. Esto define un término de 1 G. Este es un término singlete. Tenga en cuenta que un término singlete SOLAMENTE tiene microestados con espines emparejados (M s =0).
Hay otra caja rectangular que también contiene nueve microestados. Es el verde. El microestado con los valores más altos de M L y M s es el que tiene M L =1 y M s =1. Así, L =1, y 2S+1=3 que define un término de 3 P. Tenga en cuenta que a pesar de ser un término triplete, el término también contiene tres microestados con giros emparejados.
La siguiente caja más grande es la morada que contiene cinco campos y cinco microestados. ¿Cuál es el término con los valores más altos de M L y M s? Es el que tiene M L =2 y M s =0. Esto significa que L=2 y S=0 que definieron un término de 1 D. Este es un término singlete. Un término singlete contiene solo microestados con giros emparejados. Queda un microestado que no consideramos hasta el momento. Es uno con M L =0 y M s = 0. Estos son los valores más altos de M L y M s porque no hay otro microestado. Así, este término contiene sólo un microestado y el término símbolo es 1 S. Ahora hemos encontrado todos los términos y símbolos de términos.
La energía de los términos
¿Cuál es la energía relativa de los términos? Primero debemos considerar la regla de Hund que establece que cuanto mayor sea la multiplicidad de espín, menor será la energía de un término.
Por lo tanto, primero necesitamos clasificar los términos con respecto a la multiplicidad de giro. En segundo lugar, debemos considerar el valor del número cuántico de momento angular orbital total L. Cuanto mayor sea el valor, menor será la energía para el término. Esto significa que la energía de términos disminuye de S, a P, a D, a F.
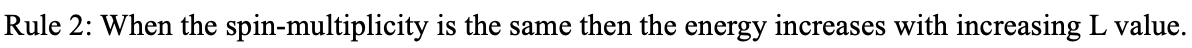
Tenga en cuenta que esto es contrario a las energías orbitales que aumentan de s, a p, a d, a f. Por lo tanto, ¿cuál sería la secuencia de energía esperada para los términos asociados a un ion libre d 2? Debe ser: 3 F< 3 P< 1 D< 1 S. Sin embargo, la secuencia de energía real es 3 F< 1 D< 3 P< 1 G< 1 S. Esto significa que, inesperadamente, el término 1 D es energéticamente más bajo que el término 3 P. Podemos entender de esto es por qué la regla de Hund es una regla llamada y no una ley porque hay excepciones. En la mayoría, pero no en todos los casos, un término triplete tiene una energía menor que un término singlete.
Términos de iones libres de otras configuraciones de electrones d
¿Cuál es el término de las otras configuraciones de electrones d (Fig. 8.1.10)?
Se puede ver arriba que solo hay un solo término de 2 D para un ion libre d 1. ¿Cómo podemos explicar este término? Debido a que no hay otro electrón, no hay interacciones electrón-electrón, y así cada microestado posible tiene la misma energía. Esto explica por qué sólo hay un término. ¿Por qué es 2 D? El término símbolo está determinado por el microestado con el valor M L más alto y el valor M s más alto. Esto se logra cuando llenamos el espín de electrones en el orbital d con m l =2 (Fig. 8.1.10). Debido a que solo hay un electrón, m l =M L =L=2. Esto hace que el término sea un término D. Es un término doblete porque M s se maximiza cuando el electrón es spin-up o m s =+1/2. Así, m s =M s =S=1/2. 2S+1=2×1/2+1=2, así tenemos un estado de doblete. ¿Cuántos microestados están asociados a este término? (2L+1) (2S+1) =5×2=10. ¿Qué significa eso? Esto significa que podemos llenar el único electrón que tenemos ya sea spin-up o spin down en cualquiera de los cinco orbitales d. Todos los 10 microestados son energéticamente iguales.
Cuando pasas de d 2 a d 3 a d 4 a d 5 puedes ver que el número de los términos aumenta dramáticamente. Esto se debe a que con el aumento de los números de electrones aumenta el número de posibles permutaciones, y así el número de microestados posibles. En consecuencia, hay más términos. De d 6 a d 10 el número de términos vuelve a disminuir. Los términos para d 6 son los mismos que los términos para d 4, los términos d 7 son idénticos a los de d 3, los términos d 8 son los mismos que los términos d 2 y los términos d 9 son los mismos que los términos para la configuración electrónica d 1. ¿Por qué es eso? Esto se debe a que los estados desocupados en orbitales permutan de la misma manera que lo hacen los ocupados. Por ejemplo, en la configuración de electrones d 3 tiene tres estados ocupados y siete desocupados, mientras que la configuración de electrones d 7 tiene siete estados ocupados y tres desocupados. La configuración de electrones d 10 tiene también solo un término con el término símbolo 1 S (Fig. 8.1.10). ¿Podemos explicar esto? En la configuración de electrones d 10, no hay forma de permutar los electrones, de ahí que solo hay un microestado posible. En este microestado L=0. ¿Por qué es eso? Cuando sumamos los m l -valores individuales de los diez electrones, entonces esta suma es M L = L = 2× (-2) +2 (-1) +2× (0) +2× (+1) +2× (+2) =0. La multiplicidad de espín del término es 1 porque todos los electrones están emparejados (2S+1= (2×0) +1=1). De ahí que tengamos un término singlete 1 S.
Acoplamiento Spin-Orbit
Todavía no hemos considerado todas las interacciones electrón-electrón. Además de la interacción entre los momentos magnéticos angulares y las interacciones magnéticas entre los espines, también hay interacciones magnéticas entre los momentos angulares y los espines. A esto se le llama el acoplamiento espín-órbita. Se expresa por un número cuántico adicional J. J puede correr de L+S a L-S.

El número cuántico J se agrega como subíndice detrás de la letra que describe el término. Por lo que un símbolo de término completo se describe como 2S+ 1 L J. El acoplamiento espín-órbita puede dar lugar a términos adicionales dependiendo de L y S (Fig. 8.1.11).
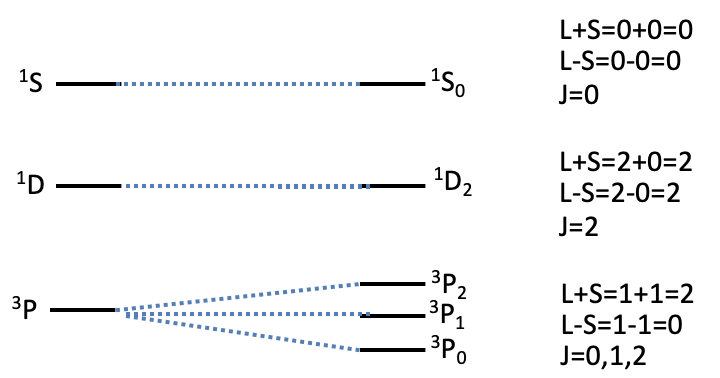
Por ejemplo, para un término de 3 P, S=1 y L=1. Así, J puede adoptar valores entre L+S=1+1=2 y L-S=1-1=0. Así, J general puede adoptar los valores, 0, 1, 2. Esto significa que un término de 3 P se divide en tres términos debido al acoplamiento espín-órbita. Sus símbolos de término son 3 P 0, 3 P 1 y 3 P 2. Su energía aumenta al aumentar el número cuántico J. 1 S y 1 D términos por otro lado para no dividirse en términos adicionales. Para un término de 1 S L+S=0+0=0, y L-S=0-0=0. El símbolo de término completo es 1 S 0. Para el término 1 D, L+S=2+0=2 y L-S=2-0=2, así el símbolo del término completo es 1 D 2. En general, las diferencias de energía entre términos debido a J son muy pequeñas, en el orden de decenas de números de onda, y órdenes de magnitudes menores que las diferencias de energía debidas al acoplamiento RS, que suelen ser del orden de decenas de miles de números de onda. Por lo tanto, usualmente ignoramos el efecto de J al interpretar espectros electrónicos.


