8.5: Halouros de Fósforo
- Page ID
- 69453
Trihaluros de fósforo
Los trihaluros de fósforo, PX 3, se producen a partir de la reacción directa del fósforo con el halógeno apropiado, (8.5.1). El fluoruro se obtiene fácilmente a partir de la reacción de intercambio de haluro de PCl 3 con sales de fluoruro, (8.5.2). Los trihaluros mixtos se forman por intercambio de haluros, (8.5.3).
\[ \rm P_4 + 6 Cl_2 \rightarrow 4 PCl_3\]
\[ \rm 2 PCl_3 + 3 CaF_2 \rightarrow 2 PF_3 + 3 CaCl_2\]
\[ \rm PCl_3 + PBr_3 \rightleftharpoons PCl_2Br + PClBr_2\]
En la Tabla se presenta un resumen de las propiedades físicas de los trihaluros de fósforo\(\PageIndex{1}\). Todos los compuestos tienen una estructura piramidal en fase vapor y en solución.
| Compuesto | Mp (°C) | Bp (°C) | P-X (Å) | X-P-X (°) |
| PF 3 | -151.5 | -101.8 | 1.56 | 96.3 |
| PCl 3 | -93.6 | 76.1 | 2.04 | 100 |
| PBr 3 | -41.5 | 173.2 | 2.22 | 101 |
| PI 3 | 61.2 | 200 (dic.) | 2.43 | 102 |
Los trihaluros de fósforo se hidrolizan a ácido fosfórico, (8.5.4), y se someten a alcohólisis para formar el derivado de fosfito de trialquilo, (8.5.5). El trifluoruro de fósforo solo se hidroliza lentamente por el agua, pero reacciona fácilmente con las soluciones de alakalina. En contraste, el triyoduro de fósforo es un sólido rojo inestable que reacciona violentamente con el agua. El tricloruro de fósforo en particular es un excelente sintón para la mayoría de las trialquilfosfinas, (8.5.6).
\[ \rm PCl_3 + 3 H_2O \rightarrow H_3PO_3 + 3 HCl\]
\[ \rm PCl_3 + 3 HOR \rightarrow P(OR)_3 + 3 HCl\]
\[ \rm PCl_3 + 3 RMgBr \rightarrow PR_3 + 3 MgBrCl\]
Al igual que con otros compuestos P (III) como las trialquilfosfinas, los trihaluros de fósforo pueden oxidarse para dar el óxido de fosfeno análogo, por ejemplo, (8.5.7).
\[ \rm 2 PCl_3 + O_2 \rightarrow \text{O=P}Cl_3\]
Los trihaluros de fósforo forman complejos ácido-base de Lewis con metales del grupo principal, pero la unión a los metales de transición d n (n ≠ 0) ocurre de la misma manera que la de la trialquilfosfina, es decir, con la donación de dπ-pπ. De hecho, uno de los primeros ejemplos de complejación de fósforo a un metal de baja oxidación fue la formación de complejos PF 3 con Fe-porfirina.
Pentahalidas de fósforo
La reacción del fósforo blanco con exceso de halógeno produce las pentahalidas, (8.5.8). Sin embargo, el pentafluoruro se prepara mejor por intercambio de haluro, (8.5.9).
\[ \rm P_4 + 10 Cl_2 \rightarrow 4 PCl_5\]
\[ \rm 2 PCl_5 + 5 CaF_2 \rightarrow 2 PF_3 + 5 CaCl_2\]
Se desconoce el pentaiodido, sin embargo, se dan propiedades físicas seleccionadas para los demás en la Tabla\(\PageIndex{2}\).
| Compuesto | Mp (°C) | Bp (°C) |
| PF 5 | -93.78 | -84.5 |
| PCl 5 | 166.8 | 160 (subl.) |
| PBr 5 | 100 | 106.0 |
Las estructuras de las pentahalidas de fósforo son todas bipiramidales trigonales en fase gaseosa (Figura\(\PageIndex{1}\)). El pentafluoruro de fósforo mantiene la estructura bipiramidal trigonal en estado sólido, pero el cloruro y el bromuro son sólidos iónicos, [PCl 4] + [pCl 6] - y [PBr 4] Br (Figura\(\PageIndex{2}\)), respectivamente. El ion tetraédrico [PCl 4] + también se forma con la reacción de PCl 5 con otros aceptores de iones cloruro, (8.5.10) y (8.5.11).
\[ \rm PCl_5 + TiCl_4 \rightarrow [PCl_4]^+[Ti_2Cl_9]^-\]
\[ \rm PCl_5 + NbCl_5 \rightarrow [PCl_4]^+[NbCl_6]^-\]
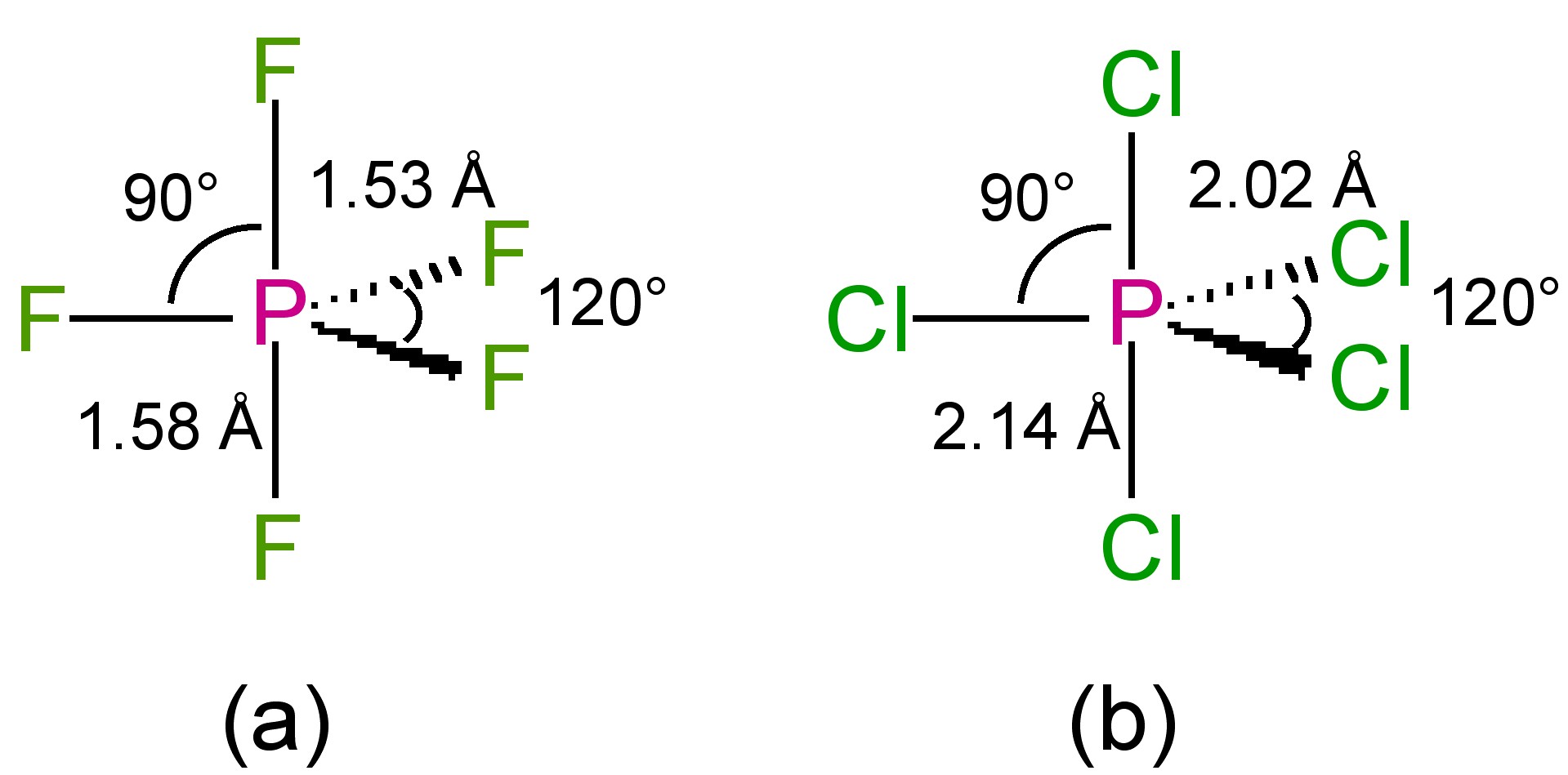

Todos los pentahalidos sufren descomposición térmica, (8.5.12).
\[ \rm PX_5 \rightleftharpoons PX_3 + X_2\]
La hidrólisis cuidadosa de las pentahalidas produce el óxido del trihaluro apropiado, (8.5.13), mientras que el exceso de hidrólisis produce ácido fosfórico, (8.5.14).
\[ \rm PX_5 + H_2O \rightarrow \text{O=}PX_3 + HX\]
\[ \rm PX_5 + 4 H_2O \rightarrow H_3PO_4 + HX\]


