8.4: Óxidos y Oxoácidos
- Page ID
- 69454
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Óxidos de nitrógeno
En la Tabla se da un resumen de las propiedades físicas de los óxidos de nitrógeno\(\PageIndex{1}\).
| Óxido | Fórmula | Mp (°C) | Bp (°C) |
| Óxido nitroso | N 2 O | -90.8 | -88.5 |
| Óxido nítrico | NO | -163.6 | -161.8 |
| Trióxido de dinitrógeno | N 2 O 3 | -100.6 | 3.5 (dic.) |
| Dióxido de nitrógeno (tetroóxido de dinitrógeno) | NO 2 /N 2 O 4 | -11.2 (NO 2) | 21.2 (N 2 O 4) |
| Pentóxido de nitrógeno | N 2 O 5 | 30 | 47 |
Óxido nitroso
El óxido nitroso gaseoso (N 2 O) se prepara mediante la cuidadosa descomposición térmica del nitrato amónico (NH 4 NO 2), (8.4.1). El óxido nitroso es una molécula lineal (Figura\(\PageIndex{1}\) a) que es isoelectrónica (e isoestructural) con dióxido de carbono. A pesar de su uso como una mejora de potencia para automóviles, el óxido nitroso en realidad no es muy reactivo y un uso importante es como propelente de aerosol.
\[ \rm NH_4NO_2 \xrightarrow{\Delta} N_2O + 2 H_2O \]

Óxido nitroso como fármaco anestésico
El óxido nitroso es conocido como “gas de la risa” debido a los efectos eufóricos de inhalarlo, propiedad que ha llevado a su uso recreativo como alucinógeno. No obstante, es como anestésico que tiene una aplicación legítima.
El primer uso de óxido nitroso como fármaco anestésico fue cuando el dentista Horace Wells (Figura\(\PageIndex{2}\)) con asistencia de Gardner Quincy Colton (Figura\(\PageIndex{3}\)) y John Mankey Riggs (Figura\(\PageIndex{4}\)), demostró insensibilidad al dolor de una extracción dental en diciembre de 1844. Posteriormente, Wells atendió a 12-15 pacientes, y según su propio registro solo falló como anestésico en dos casos. A pesar de estos resultados, el método no fue adoptado de inmediato, probablemente porque durante su primera manifestación pública solo tuvo éxito parcial.


El método no entró en uso general hasta 1863, cuando Colton lo utilizó con éxito para más de 25 mil pacientes. Como tal, el uso de óxido nitroso se convirtió rápidamente en el método anestésico preferido en odontología. Debido a que el gas es lo suficientemente suave como para mantener al paciente en un estado consciente y conversacional, y sin embargo en la mayoría de los casos lo suficientemente fuerte como para suprimir el dolor causado por el trabajo dental, sigue siendo el gas anestésico preferido en la odontología actual.
Nitroso: el secreto para más poder.
En los deportes de motor, el óxido nitroso (a menudo referido como nitroso o NOS) permite que el motor queme más combustible, lo que resulta en una combustión más potente, y por lo tanto mayores caballos de fuerza. El gas en sí no es inflamable, pero entrega más oxígeno (33%) que el aire atmosférico (21%) al descomponerse a temperaturas elevadas. Cuando el N 2 O se descompone durante la combustión del combustible, la descomposición del nitroso es exotérmica, contribuyendo al aumento general de la potencia.
El óxido nitroso se almacena como un líquido comprimido (Figura\(\PageIndex{5}\)); la evaporación y expansión del óxido nitroso líquido en el colector de admisión provoca una gran caída en la temperatura de carga de admisión, resultando en una carga más densa, permitiendo además que más mezcla de aire/combustible ingrese al cilindro. El óxido nitroso a veces se inyecta en (o antes) el colector de admisión, mientras que otros sistemas inyectan directamente justo antes del cilindro (inyección de puerto directo) para aumentar la potencia.
Uno de los principales problemas de usar óxido nitroso en un motor reciprocante es que puede producir suficiente potencia para dañar o destruir el motor. Son posibles aumentos de potencia muy grandes, y si la estructura mecánica del motor no está debidamente reforzada, el motor puede resultar gravemente dañado o destruido durante este tipo de operación.
Óxido nítrico
El óxido nítrico (NO) se forma por la oxidación a alta temperatura del nitrógeno, (8.4.2), o la oxidación catalizada por platino del amoníaco a 800 °C, (8.4.3).
\[ \rm N_2 + O_2 \rightleftharpoons 2 NO\]
\[ \rm 4 NH_3 + 5 O_2 \xrightarrow{Pt} 4 NO + 6 H_2O \]
El óxido nítrico (Figura\(\PageIndex{6}\) b) es electrónicamente equivalente al dinitrógeno (N 2) más un electrón, y como consecuencia es paramagnético con un electrón desapareado. La ubicación del electrón desapareado en el orbital π* (Figura\(\PageIndex{6}\) a) da como resultado un orden de enlace de 2.5 en lugar del triple enlace observado para N 2 (Figura\(\PageIndex{6}\) b). La distancia N-O de 1.15 Å es intermedia entre la distancia de triple enlace en NO + (1.06 Å) y la distancia típica de doble enlace (ca. 1.20 Å). Además, debido a la ubicación del electrón es fácil oxidar el óxido nítrico al ion nitrosonio (NO +), (8.4.4).
\[ \rm NO \rightarrow NO^+ + e^- \]
\[ \rm 2 NO + O_2 \rightarrow 2 NO_2\]
El óxido nítrico es inestable al calor, (8.4.6), y la oxidación, (8.4.5). También reaccionará con halógenos para formar los haluros de nitrosil, XNO.
\[ \rm 3 NO \rightarrow N_2O + NO_2\]
Trióxido de dinitrógeno
El trióxido de dinitrógeno (N 2 O 3) se forma a partir de la reacción estequiométrica entre NO y O 2 o NO y N 2 O 4. El trióxido de Dinitrogen tiene un color azul intenso en la fase líquida y un color azul pálido en estado sólido. La disociación térmica de N 2 O 3, (8.4.7), ocurre por encima de -30 °C, y se observa cierta autoionización del líquido puro, (8.4.8). La estructura asimétrica de N 2 O 3 (Figura\(\PageIndex{1}\) c) da como resultado una molécula polar (Figura\(\PageIndex{7}\)).
\[ \rm N_2O_3 \rightleftharpoons NO + NO_2 \]
\[ \rm N_2O_3 \rightleftharpoons NO^+ + NO_2^-\]
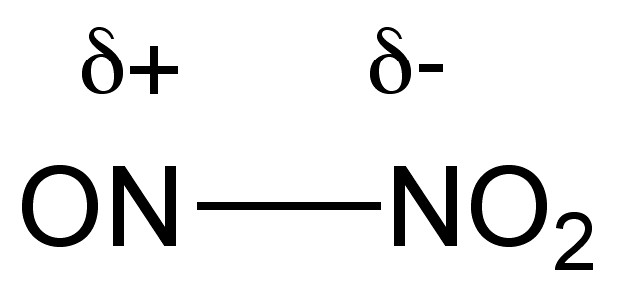
Dióxido de nitrógeno (y tetroxido)
Formado a partir de la oxidación del óxido nítrico, (8.4.9), el dióxido de nitrógeno marrón está realmente en equilibrio con su forma dimérica incolora, el tetroóxido de nitrógeno (N 2 O 4), (8.4.10).
\[ \rm 2 NO + O_2 \rightleftharpoons 2 NO_2\]
\[ \rm \underset{brown\\paramagnetic}{2NO_2} \rightleftharpoons \underset{colorless\\diamagnetic}{N_2O_4}\]
El dióxido de nitrógeno (Figura\(\PageIndex{1}\) d) es equivalente electrónicamente al anión nitrato (NO 2 -) menos un electrón, y como tal es paramagnético con un electrón desapareado. La ubicación del electrón desapareado en un orbital de nitrógeno sp 2, y en consecuencia forma un dímero a través de un enlace N-N (Figura\(\PageIndex{1}\) e). Además, es fácil oxidar el dióxido de nitrógeno al ion nitronio (NO 2 +), (8.4.11).
\[ \rm NO_2 \rightarrow NO_2^+ + e^-\]
El dióxido de nitrógeno se disuelve en agua para formar una mezcla de ácidos nítrico y nitroso, (8.4.12). El dióxido de nitrógeno actúa como agente oxidante con la formación de anión nitrato, (8.4.13).
\[ \rm 2 NO_2 + H_2O \rightarrow NO_3^- + NO_2^- + 2H^+\]
\[ \rm 2 NO_2 + 2 I^- \rightarrow I_2 + 2 NO_2^-\]
La forma estructural más común de N 2 O 4 (Figura\(\PageIndex{1}\) e) es plana con un enlace N-N largo (1.78 Å) que es significativamente más largo que el observado en hidrazina (1.47 Å). La racionalización de este efecto estructural se obtiene a partir de una consideración de los orbitales moleculares, que muestran que los electrones en el enlace σen realidad están deslocalizados sobre toda la molécula. La rotación alrededor del enlace N-N es 9.6 kJ/mol.
Pentóxido de nitrógeno
La deshidratación del ácido nítrico, con P 2 O 5, produce pentóxido de nitrógeno, (8.4.14), el cual es un sólido inestable a temperatura ambiente (Cuadro\(\PageIndex{1}\)). En estado sólido el pentóxido de nitrógeno es en realidad nitrato de nitronio (NO 2 + NO 3 -), sin embargo, en la fase vapor existe como especie molecular (Figura\(\PageIndex{1}\) f) con una unidad N-O-N curvada. El pentóxido de nitrógeno es un agente de nitración y oxidación muy potente.
\[ \rm 2 HNO_3 \rightleftharpoons N_2O_5 + H_2O \]
Óxidos de nitrógeno como precursores de smog y lluvia ácida
Se estima que las emisiones de óxidos de nitrógeno (NO x) están en el rango de 25 a 100 megatonnes de nitrógeno por año. Se piensa que las fuentes naturales constituyen aproximadamente 1/3 del total. Las generaciones de NO x (principalmente una mezcla de NO 2 y NO) son la principal fuente de smog y un aporte significativo a la contaminación atmosférica; sin embargo, el NO x también es responsable de gran parte de la acidez en la lluvia ácida.
Reacciones atmosféricas que conducen a lluvia ácida
En la atmósfera seca, el óxido nítrico que reacciona es oxidado rápidamente a la luz solar por el ozono, (8.4.15). El dióxido de nitrógeno reacciona con el radical hidróxido, formado por la descomposición fotoquímica del ozono, (8.4.16) y (8.4.17), en presencia de una molécula de gas no reactiva como el nitrógeno para formar vapor de ácido nítrico, (8.4.18). La tasa de conversión de NO x a HNO 3 es aproximadamente diez veces más rápida que la reacción equivalente para el dióxido de azufre. Por ejemplo, la conversión es esencialmente completa para un penacho de NO x cuando atraviesa el Mar del Norte desde el Reino Unido a Escandinavia.
\[ \rm NO + O_2 \rightarrow NO_2 + O_2 \]
\[ \rm O_3 + h\nu \rightarrow O* + O_2\]
\[ \rm O* + H_2O \rightarrow 2HO \cdot\]
\[ \rm NO_2 + \cdot OH + N_2 \rightarrow HNO_3 + N_2 \]
Por la noche, la conversión se realiza a través de la formación de un radical nitrato, (8.4.19), que posteriormente fotoquímicamente inestable bajo la luz solar formando pentóxido de nitrógeno, (8.4.20), que reacciona con el agua en la superficie de las partículas de aerosol para formar ácido nítrico, (8.4.21).
\[ \rm NO_2 + O_3 \rightarrow NO_3 + O_2 \]
\[ \rm NO_2 + NO_3 + N_3 \rightarrow N_2O_5 + N_2 \]
\[ \rm N_2O_5 + H_2O \rightarrow 2 HNO_3\]
Tanto el NO como el NO 2 son solo ligeramente solubles en agua y por lo tanto es más probable que el contenido de ácido nítrico de la lluvia sea más probable debido a la disolución del vapor de ácido nítrico en gotas de lluvia, (8.4.22), en lugar de una reacción separada.
\[ \rm N_2O_5 + H_2O_{(l)} \rightarrow 2 HNO_{3(aq)}\]
Oxoácidos de Nitrógeno
Ácido nitroso
En la fase gaseosa, el ácido nitroso se puede preparar mediante la siguiente reacción:
\[ \rm NO + NO_2 + H_2O \rightleftharpoons 2 HNO_2\]
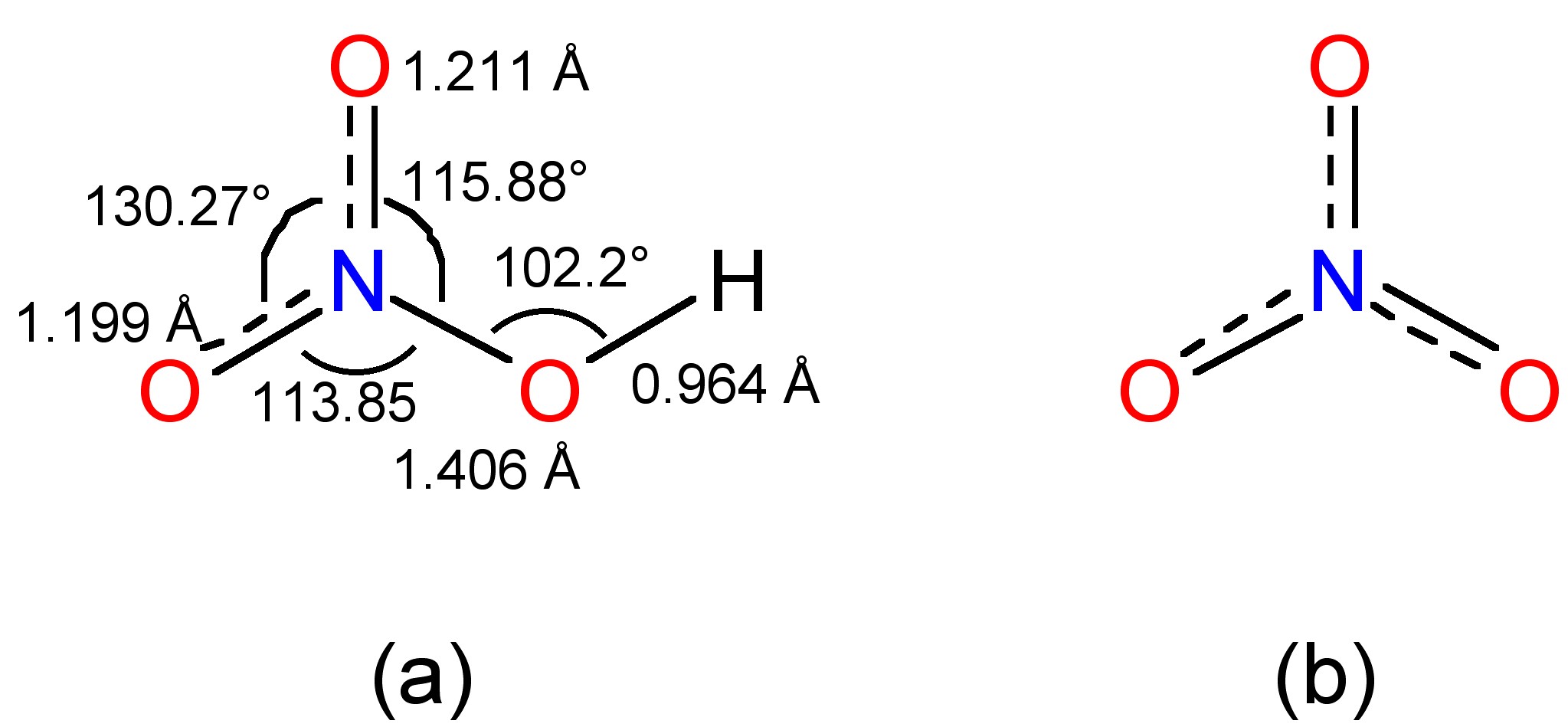
La estructura en fase gaseosa determinada por espectroscopia IR se muestra en la Figura\(\PageIndex{8}\) a, en la que el nitrógeno es plano con hibridación sp 2.
 Figura\(\PageIndex{8}\)
Figura\(\PageIndex{8}\)En solución acuosa básica la misma reacción da como resultado la formación del ion nitrito, (8.4.24), el cual puede precipitarse como la sal Ba 2+. Después de la separación, la adición a ácido sulfúrico produce una solución de ácido nitroso. Sin embargo, no es posible concentrarse por calentamiento ya que se produce la descomposición, (8.4.25).
\[ \rm NO + NO_2 + 2 OH^- \rightleftharpoons 2 NO_2^- + H_2O\]
\[ \rm 3 HNO_2 \rightarrow H_3O^+ + NO_3^- + 2 NO\]
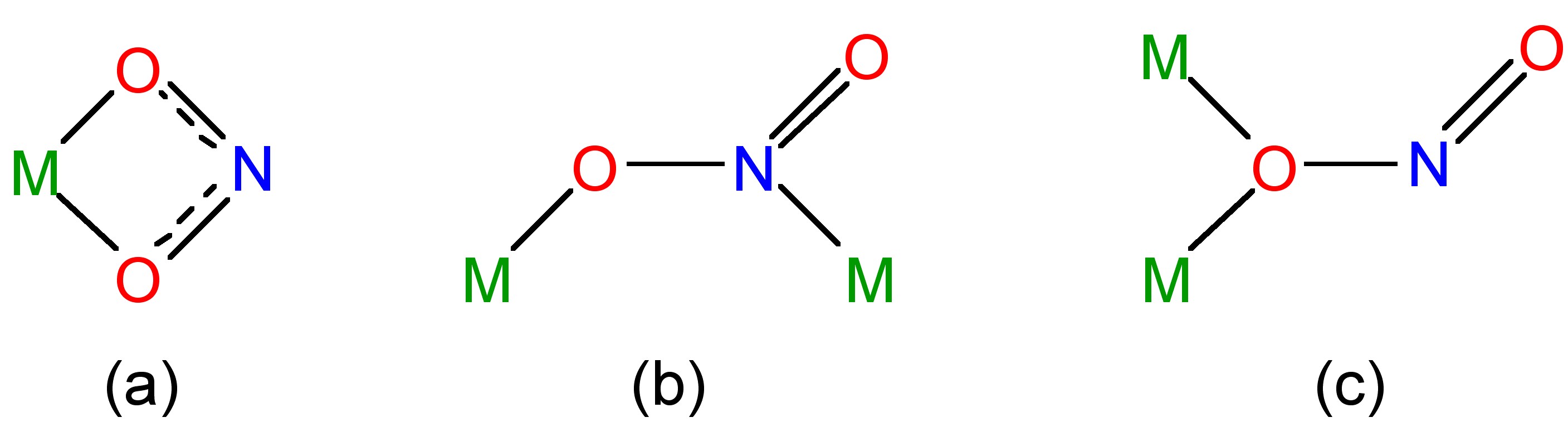
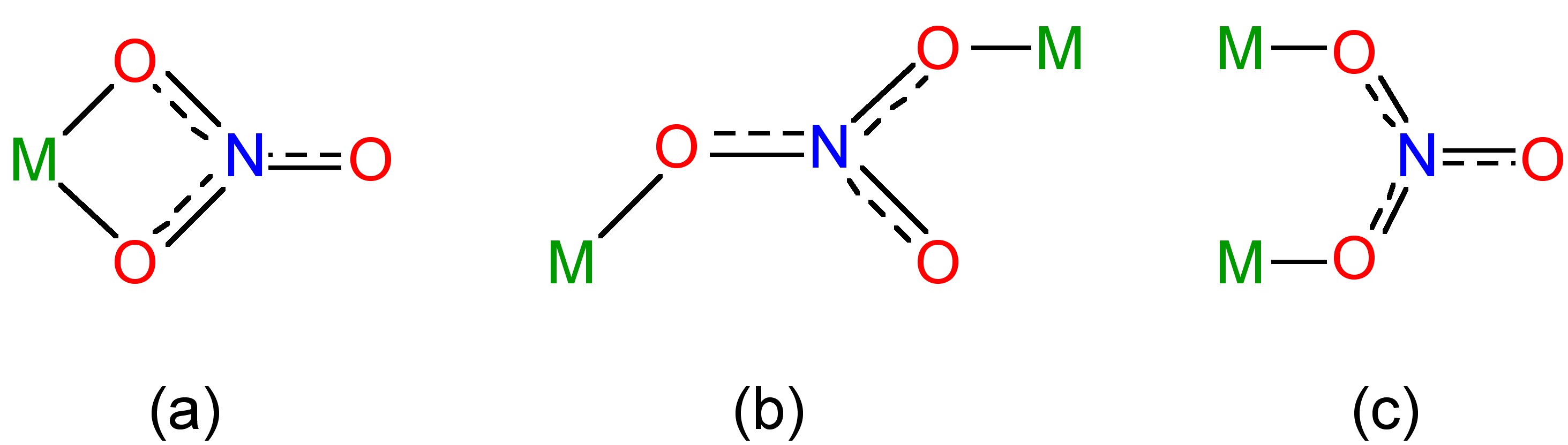
El ácido nitroso es un ácido bastante débil en el agua (pK = 5.22); sin embargo, se conocen muchas sales del ion nitrito, NO 2 - (Figura\(\PageIndex{8}\) b). Los complejos del ion nitrito pueden monodentarse con enlace vía nitrógeno (nitro) o un oxígeno (nitrito). Ambos isómeros pueden aislarse en el caso de un metal inerte, es decir, complejos octaédricos d6 sustitucionalmente inertes (Figura\(\PageIndex{9}\)). Los modos de coordinación bidentado y puente también son conocidos para el anión nitrito (Figura\(\PageIndex{10}\)).


El nitrito puede actuar como agente oxidante, (8.4.26), o como agente reductor, (8.4.27).
\[ \rm NO_2^- + 2H^+ + Fe_{2+} \rightarrow NO + H_2O + Fe^{3+}\]
\[ \rm NO_2^- + H_2O + 2 Ce^{4+} \rightarrow NO_3^- + 2 H^+ + 2 Ce^{3+}\]
El uso más importante del ácido nitroso es en las reacciones de diazotación en las que se genera ácido nitroso acidificando la solución de nitrito.
Ácido nítrico
El ácido nítrico (HNO 3), también conocido como aqua fortis y espíritu de nitre, se obtiene por la disolución del dióxido de nitrógeno en agua, (8.4.28). El ácido nítrico se puede concentrar por destilación a partir de ácido sulfúrico concentrado.
\[ \rm 3 NO_2 + H_2O \rightarrow 2 HNO_3 + NO\]
La estructura del HNO 3 en fase gaseosa es plana en el nitrógeno sp 2 (Figura\(\PageIndex{11}\) a).

El ácido nítrico 100% puro es un líquido muy corrosivo que es fuertemente ácido y protonata y disuelve especies orgánicas. En la fase líquida se disocia ligeramente, (8.4.29). También es un poderoso agente oxidante, convirtiendo elementos no metálicos en óxido u oxoácido. En contraste con los metales forma sales o complejos en los que el metal se encuentra en su estado de oxidación más alto. Es inestable y se descompone al calentarse o fotólisis.
\[ \rm 3 HNO_3 \rightleftharpoons H_3O^+ + NO_2^+ + 2 NO_3^-\]
El ácido puro tiene la autoionización más alta de los ácidos líquidos puros, (8.4.30). Sin embargo, la pérdida de agua resulta, (8.4.31), de tal manera que la reacción global puede ser descrita por (8.4.32).
\[ \rm 2 HNO_3 \rightleftharpoons H_2NO_3^+ + NO_3^+\]
\[ \rm H_2NO_3^+ \rightleftharpoons H_2O + NO_2^+\]
\[ HNO_3 \rightleftharpoons NO_3^+ + NO_2^+ + H_2O\]
La concentración común de ácido nítrico es del 70%. Si bien el ácido puro es incoloro, las muestras suelen tomar un color amarillo debido a la descomposición fotoquímica del ácido nítrico para dar NO 2 marrón.
\[ \rm 4 HNO_3 \xrightarrow{h\nu} 4 NO_2 + 2 H_2O + O_2\]
Nota
El término la “prueba ácida” se deriva de la práctica medieval de degradar las monedas de oro y plata (a menudo por los Reyes que las emitieron) al degradarse con cobre. Con ducados (Milán), libras (Francia), florines (Florencia), maravedias (España) y bezantes (Constantinopla) de uso generalizado, y cada uno con un contenido nominal de oro o plata, era importante que un comerciante pudiera verificar el valor de cualquier moneda en particular. Si se colocaba una gota de ácido nítrico diluido sobre una moneda de plata adulterada con cobre, se volvía verde, debido a la formación de nitrato de cobre (II). Por el contrario, si una moneda de oro reaccionaba de alguna manera con el ácido nítrico no era pura. En ambos casos las monedas fallaron la “prueba de ácido”.
Aqua regia (llamada así porque disuelve el oro) es una mezcla de 70% de ácido nítrico y ácido clorhídrico en una proporción 1:3. Aqua regia es un agente oxidante muy potente (contiene Cl 2) y estabiliza algunos metales como sus complejos de cloro (Tabla\(\PageIndex{2}\)). Si se agrega HF en lugar de HCl, el tántalo puede disolverse con la formación de [TaF 2] -.
| Metal | Sal de cloruro formada |
| Au | [AUCl 4] - |
| Pt | [PtcL 6] 2- |
El ácido nítrico fumante (100% nítrico) es sumamente corrosivo y no debe usarse. En ácido sulfúrico 100%, el ácido nítrico actúa como base y se protonó, (8.4.34) y (8.4.35), y actúa como un potente agente nitrante.
\[ \rm HNO_3 + H_2SO_4 \rightarrow ON(OH)_2^+ + HSO_4^-\]
\[ \rm ON(OH)_2^+ + HSO_4^- + H_2SO_4 \rightarrow H_3O^+ + NO_2^+ + 2 HSO_4^-\]
En agua diluir el ácido nítrico está completamente ionizado, (8.4.36).
\[ \rm HNO_3 + H_2O \rightarrow H_3O^+ + NO_3^-\]
El ion nitrato es plano (Figura\(\PageIndex{11}\) b) y forma muchas sales y complejos. El anión nitrato es más comúnmente un ligando monodentado, pero también puede ser un ligando bidentado (Figura\(\PageIndex{12}\) a) o un ligando puente (Figura\(\PageIndex{12}\) b y 12c).
Óxidos de fósforo
Trióxido de fósforo
La oxidación estequiométrica del fósforo blanco produce trióxido de fósforo, (8.4.37).
\[ \rm P_4 + 3 O_2 \rightarrow 2 P_2O_3\]
Se conocen varias formas estructurales del trióxido de fósforo, pero P 4 O 6 es una estructura molecular estable (Figura\(\PageIndex{13}\)), mientras que el resto son polímeros.

Pentóxido de fósforo
La reacción del fósforo blanco con exceso de oxígeno (o la oxidación del trióxido de fósforo) produce pentóxido de fósforo, (8.4.38).
\[ \rm P_4 + 5 O_2 \rightarrow 2 P_2O_5\]
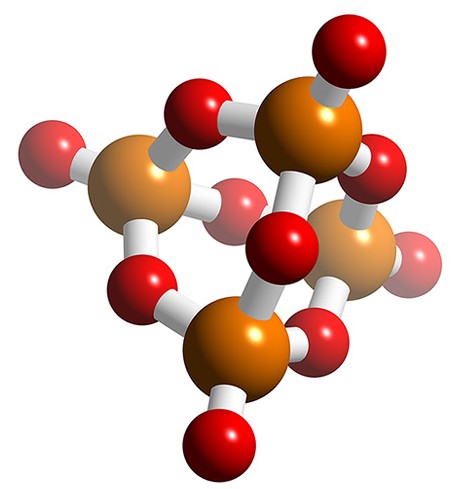
La estructura del pentóxido de fósforo hexagonal es en realidad la de la forma dimérica, P 4 O 10, y se basa en la estructura de P 4 O 6, pero con unidades P=O en lugar de pares solitarios (Figura\(\PageIndex{14}\)). La estructura se mantiene en fase vapor; sin embargo, otras formas cristalinas y vítreas comprenden una estructura tipo lámina (Figura\(\PageIndex{15}\)).


El pentóxido de fósforo es un excelente agente de secado por debajo de 100 °C, reacciona con el agua para formar diversos ácidos fosfóricos, y extraerá agua de otros 'agentes secadores', por ejemplo, (8.4.39) y (8.4.40). El pentóxido de fósforo deshidratará las amidas para dar nitrilos, (8.4.41).
\[ \rm 2 HNO_3 \xrightarrow[-H_2O]{P_4O_{10}}N_2O_5\]
\[ \rm H_2SO_4 \xrightarrow[-H_2O]{P_4O_{10}}SO_3\]
\[ \rm RC(O)NH_2 \xrightarrow[-H_2O]{P_4O_{10}} RC\equiv N\]
Oxoácidos de Fósforo
El pentóxido de fósforo (P 2 O 5) es un excelente agente secante, y su acción es resultado de la formación de una gama de oxoácidos.
Ácido hipofosforoso
El ácido hipofosforoso, H 3 PO 2, se prepara fácilmente puro comprar la reacción de fósforo blanco con base, seguido de acidificación, (8.4.42). El ácido puro es un sólido (Mp = 27 °C) y muy soluble en agua.
\[ \rm P_4 + 4 OH^- + 4 H_2O \rightarrow \underset{\underset{H_3PO_2}{\downarrow \text{ acidify}}}{4 H_2PO_2^-} + 2 H_2\]
La estructura de H 3 PO 2 se determina mediante cristalografía de rayos X como tetraédrica con dos ligandos de hidruro y un hidróxido (Figura\(\PageIndex{16}\) a). La presencia de dos hidruros se confirma mediante espectroscopía de RMN. La resonancia de RMN 1H muestra una línea OH y un doblete del P-H con una gran constante de acoplamiento de un enlace al núcleo 31 P. El espectro de RMN 31 P no desacoplado muestra un triplete (δ = 13 ppm, J P-H = 530 Hz) debido a los dos hidruros.

En el agua el ácido hipofosforoso es un ácido monobásico (pK = 1.2), (8.4.43), y forma una amplia gama de sales. También es un potente agente reductor, pero su cinética de reacción es lenta.
\[ \rm H_2P(O)OH + H_2O \rightleftharpoons H_2P(O)_2^- + H_3O^+\]
Ácido fosforoso
La reacción de P 4 O 6 o PCl 3 con agua produce ácido fosforoso, H 3 PO 3; que al igual que el ácido hipofosforoso es un sólido (Mp = 70.1 °C) y muy soluble en agua. La estructura se muestra mediante cristalografía de rayos X que está compuesta por un fósforo tetraédrico con un hidruro y dos hidróxidos (Figura\(\PageIndex{16}\) b). La espectroscopía de RMN 31 demuestra la presencia de un solo hidruro por la presencia de un doblete como consecuencia de que el centro de fósforo se divide por un solo hidruro (δ = 4 ppm, J P-H = 700 Hz). El espectro de RMN 1H muestra un doblete para el hidruro y una sola resonancia del doble de intensidad para el hidróxido.
Como era de esperar, en el agua el ácido fosforoso es dibásico, (8.4.44). El ácido (y los aniones) son agentes reductores fuertes, dando como resultado ácido fosfórico. En realidad reaccionan muy lentamente, y se piensa que esto puede deberse a que la reacción está en la forma tautomérica, P (OH) 3. Aunque esto no ha sido aislado, los derivados de trialquilo existen en ambas formas, es decir, ésteres de ácidos fosfóricos (Figura\(\PageIndex{17}\) a) y fosfatos de trialquilo (Figura\(\PageIndex{17}\) b).
\[ \rm HP(O)(OH)_2 \xrightleftharpoon[pK_1=1.8] [HP(O)_2OH]^- \xrightleftharpoons[pK_2=6.7] [HP(O)_3]^{2-}\]

Ácido ortofosfórico
El ácido ortofosfórico (H 3 PO 4) es el oxoácido más común del fósforo (Figura c). El término ácido fosfórico se usa comúnmente. Se elabora a partir de la reacción de fosfatos con ácido sulfúrico (H 2 SO 4), o de la hidrólisis de P 4 O 10. El ácido puro es un sólido cristalino incoloro (Mp = 42.35 °C) con enlaces de hidrógeno extensos. El enlace de hidrógeno del ácido interfosfórico se mantiene parcialmente en soluciones acuosas por encima del 50% de soluciones.
El ácido fosfórico es muy estable y no muestra química de oxidación por debajo de 350 °C. Como era de esperar, el ácido fosfórico es tribásico, (8.4.45). Los aniones H 2 PO 4 - y HPO 4 2- tienen nombres particulares, dihidrógeno fosfato y monohidrógeno fosfato, respectivamente.
\[ \rm PO(OH)_3 \xrightleftharpoons[pK_1=2.15] [PO_2(OH)_2]^- \xrightleftharpoons[pK_2=7.1] [PO_3(OH)]^{2-} \xrightleftharpoons[pK_3=12.4] [PO_4]^{3-}\]
Muchas sales de son conocidas para los tres aniones; aquellos con fosfato (PO 4 2-) a menudo son insolubles en agua. Se conocen muchos complejos de coordinación, especialmente con iones M 3+ y M 4+.
Ésteres de fósforo
Los homólogos de alquilo y arilo del ácido fosfórico (es decir, el triéster de fosfato O=P (OR) 3) se preparan mediante la reacción de P 4 O 10 con el alcohol apropiado. Los triésteres son buenos solventes y ligandos básicos de Lewis con coordinación a través del resto óxido. También se pueden elaborar los diésteres y monoésteres, y son importantes en los procesos bioquímicos.
Los triésteres de fosfito, P (OR) 3, pueden elaborarse mediante la reacción de PCl 3 con alcoholes o fenoles en presencia de una base orgánica como aceptor para el HCl formado. Alternativamente, se pueden preparar directamente a partir de fósforo blanco, (8.4.46).
\[ \rm P_4 + 6 OR^- + 6 CCl_4 + 6 ROH \rightarrow 4 P(OR)_3 + 6 CHCl_3 + 6 Cl^-\]
Los triésteres de fosfito se oxidan fácilmente al triéster de fosfato apropiado, (8.4.47). También reaccionan con haluros de alquilo para formar el fosfonato de dialquilo a través de la reacción de Michaelis-Arbusov (8.4.48).
\[ \rm 2 P(OR)_3 + O_2 \rightarrow 2 \text{O=P}(OR)_3 \]
\[ \rm P(OR)_3 + R'X \rightarrow \text{O=P}(OR)_2R' + RX\]
Polifosfatos
Los polifosfatos contienen la unidad PO 4, y el ejemplo más simple (pirofosfato o difosfato, (Figura\(\PageIndex{18}\) a) puede considerarse como productos de condensación del monohidrógeno fosfato, (8.4.49). Se pueden formar cadenas más largas, por ejemplo, el trifosfato P 3 O 10 5- (Figura\(\PageIndex{18}\) b). La formación y la reacción inversa (hidrólisis) son lentas, pero son fácilmente catalizadas, por ejemplo, por enzimas.
\[ \rm 2 HPO_4^{2-} \xrightarrow{\Delta} [O_3P\text{-O-}PO_3]^{4-} + H_2O\]

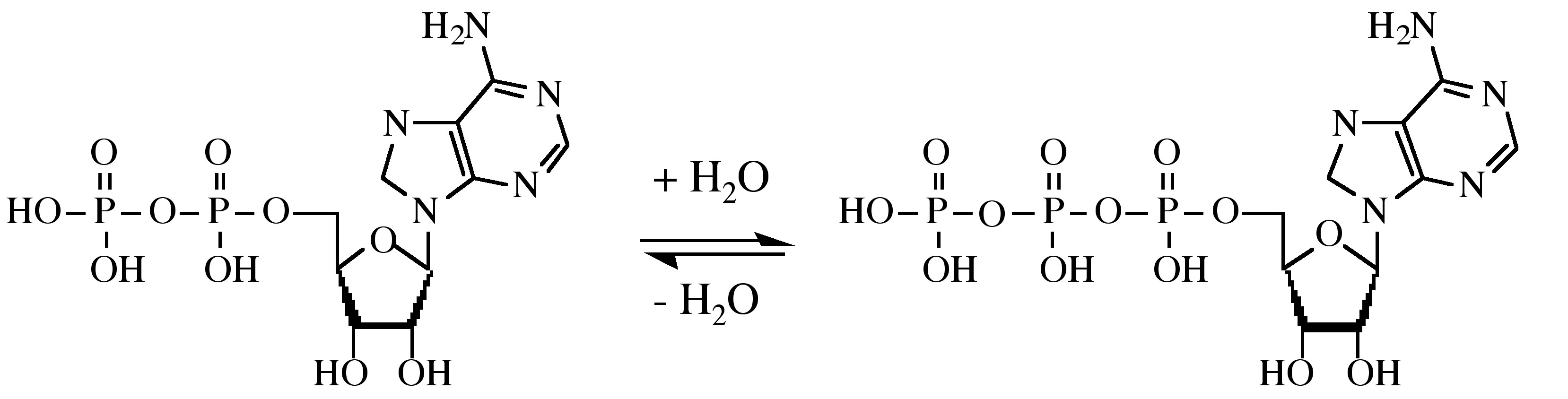
Los monoésteres del difosfato y el trifosfato son muy importantes en los procesos biológicos. En particular, la conversión del trifosfato ATP (trifosfato de adenosina) en el difosfato ADP (adenosina difosfato) por la transferencia de un grupo fosfato es importante en la energía de las reacciones biológicas.
Polifosfatos cíclicos
También conocidos como metafosfatos, los fosfatos cíclicos también están hechos de unidades PO 4 fusionadas. El más simple, P 3 O 9 3-, se muestra en la Figura\(\PageIndex{19}\). La adición lenta de agua a P 4 O 10 da como resultado la formación del polifosfato tetramérico, P 4 O 12 4- (Figura\(\PageIndex{20}\)), el cual se conoce como calgon por su capacidad para complejar Ca 2+ así como otros metales.




