9.2: Ozono
- Page ID
- 69504
El ozono (O 3) es un alótropo de oxígeno que es mucho menos estable que la molécula diatómica (O 2). El ozono a nivel del suelo es un contaminante del aire con efectos nocivos sobre el sistema respiratorio, aunque la capa de ozono en la atmósfera superior filtra potencialmente dañando la luz ultravioleta al llegar a la superficie de la Tierra.
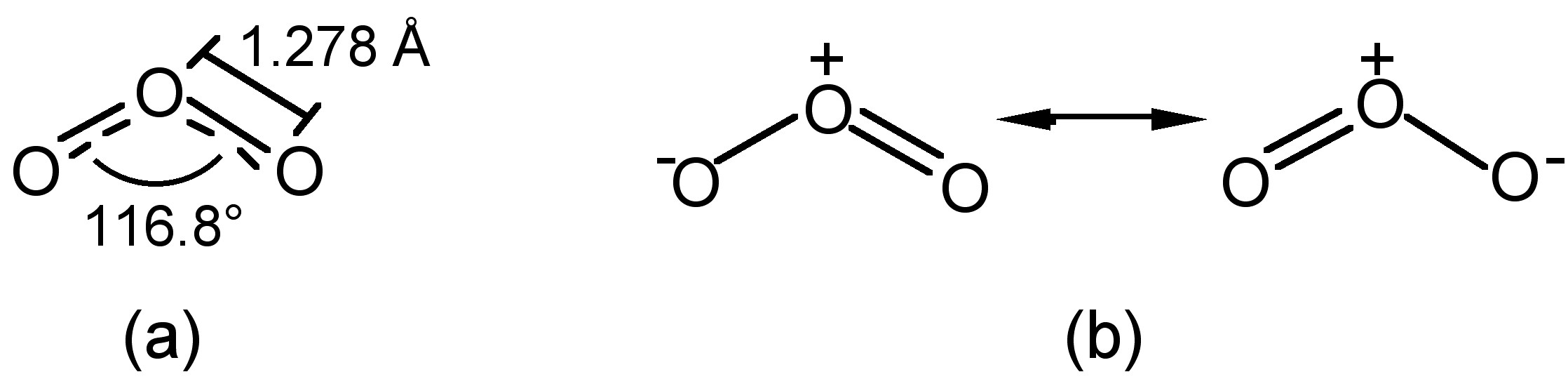
La estructura del ozono es doblada, con simetría C 2v, similar al agua (Figura\(\PageIndex{1}\) a). El oxígeno central tiene hibridación sp 2 con un par solitario. Como consecuencia de la estructura doblada, y la hibridación por resonancia (Figura\(\PageIndex{1}\) b) el ozono es una molécula polar (momento dipolar = 0.5337 D).
El ozono se produce por la exposición de oxígeno (O 2) a una descarga eléctrica. El ozono tiene un olor característico que comúnmente se puede oler después de un rayo; de hecho, el nombre ozono proviene del griego ozeína que significa oler. En el laboratorio, el ozono también se puede producir por electrólisis usando cátodo de varilla de grafito, un ánodo de alambre de platino y electrolito de ácido sulfúrico (3 M). Las reacciones de las medias células son las siguientes:
\[ \rm 3 H_2O \rightarrow O_3 + 6 H^+ + 6e^- \space\space\space\space\space\space\space (\Delta E_o = -1.53V)\]
\[ \rm 6 H^+ + 6 e^- \rightarrow 3 H_2 \space\space\space\space\space\space\space (\Delta E_o = 0 V)\]
\[ \rm 2 H_2O \rightarrow O_2 + 4 H^+ + 4 e^- \space\space\space\space\space\space\space (\Delta E_o = -1.23 V)\]
El ozono también se produce a través de la fotólisis del oxígeno, (Ecuación\ ref {9.2.4} y\ ref {9.2.5}), tanto en el laboratorio como en la atmósfera.
\[ \rm O_2 \xrightarrow{h\nu} 2 O\cdot \label{9.2.4}\]
\[ \rm O\cdot + O_2 \rightarrow O_3 \label{9.2.5}\]
El ozono es un agente oxidante muy fuerte, y oxidará fácilmente una variedad de materiales, por ejemplo, Ecuaciones\ ref {9.2.6} y\ ref {9.2.7}. También oxidará metales (excepto oro, platino e iridio) a su estado de oxidación más alto, por ejemplo, Ecuación\ ref {9.2.8}.
\[ \rm O_3 + CO \rightarrow CO_2 + O_2 \label{9.2.6}\]
\[ \rm O_3 + 2 I^- + H_2O \rightarrow O_2 + 2OH^- + I_2 \label{9.2.7}\]
\[ \rm 2 Cu^+_{(aq)} + 2 H_3O^+_{(aq)} + O_{2(g)} \rightarrow 2 Cu^{2+}_{(aq)} + 3 H_2O_{(l)} + O_{2(g)} \label{9.2.8}\]
Los ozanidos metálicos, que contienen el anión ozónido (O 3 -) son explosivos y deben almacenarse a temperaturas criogénicas. Se conocen ozónidos para todos los metales alcalinos. KO 3, RbO 3 y CSO 3 se pueden preparar a partir de sus respectivos superóxidos.
\[ \rm KO_2 + O_3 \rightarrow KO_3 + O_2\]
El ozono como modulador de la vida en la Tierra
La atmósfera terrestre actúa como fuente de O 2 y depósito de CO 2, pero también actúa como escudo para la vida. Primero, casi todos los meteoritos se queman al entrar debido a las altas temperaturas generadas por la fricción de la atmósfera. Segundo, la atmósfera actúa como un escudo para la radiación UV de alta energía.
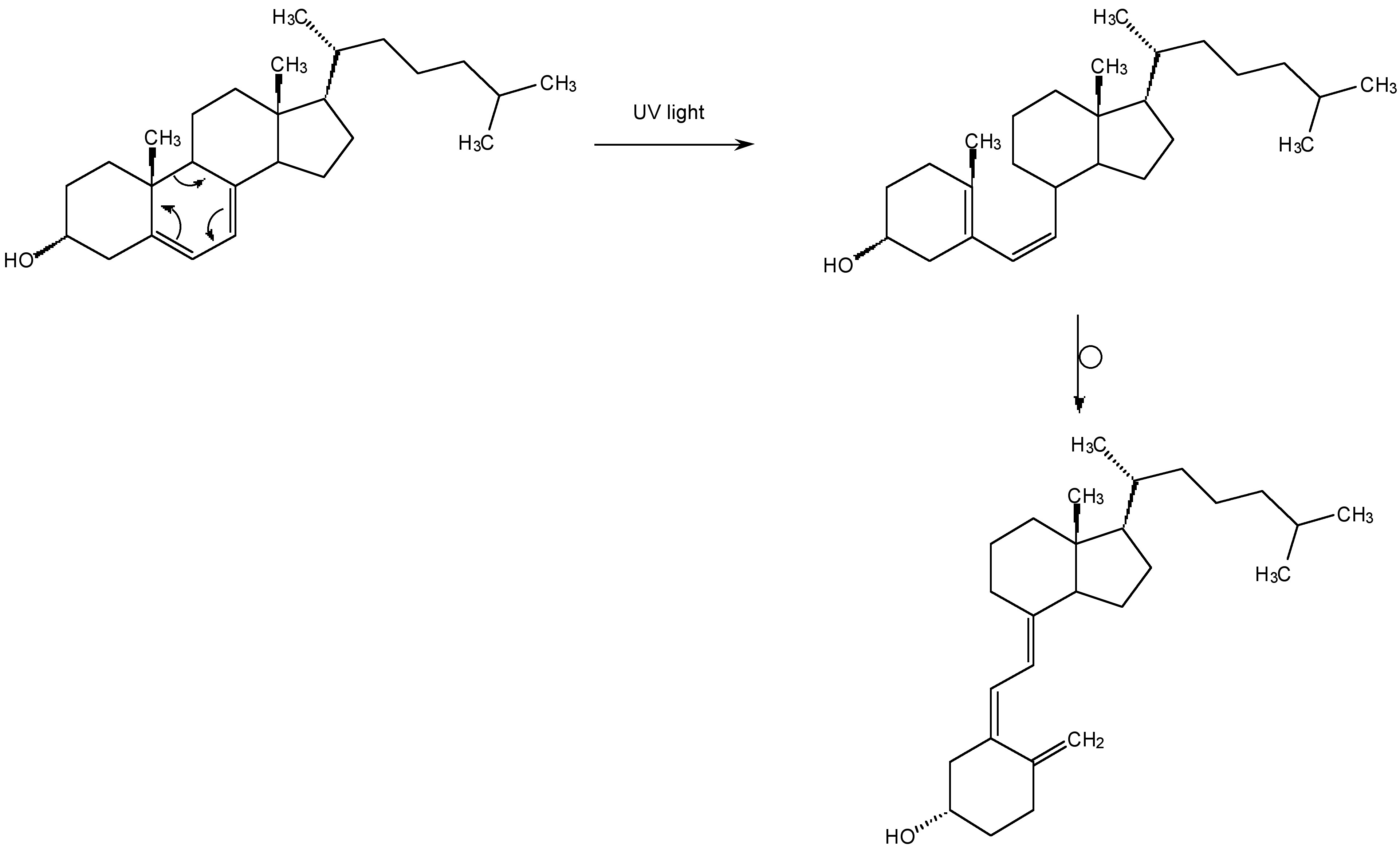
Aunque la radiación UV convierte el 7-deshidrocolesterol en vitamina D3 en la piel (Figura\(\PageIndex{2}\)), y por lo tanto es útil, la radiación UV de alta energía destruye las células vivas. De hecho, el oscurecimiento que llamamos bronceado es en realidad el mecanismo del cuerpo para prevenir más daños UV. Las quemaduras solares y el cáncer de piel son causados por la luz UV relativamente débil que llega a la superficie de la Tierra, sin la atmósfera estaríamos expuestos a UV de alta energía que serían un peligro para toda la vida en la Tierra. La “pantalla solar” de la Tierra es el ozono (O 3). Y sin ozono en la atmósfera superior no habría vida en la Tierra.
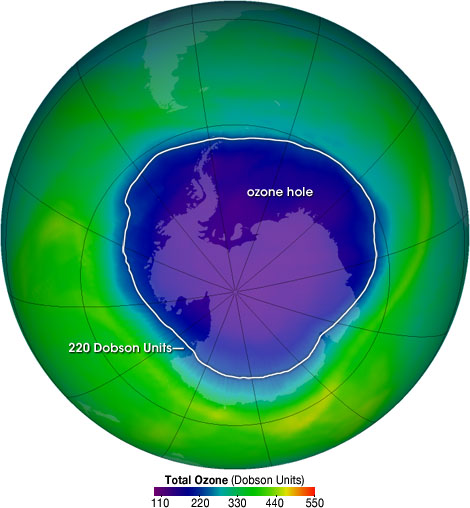
La capa de ozono se ubica en la porción inferior de la estratosfera desde aproximadamente 10 km hasta 50 km sobre la Tierra, aunque el grosor varía estacionalmente y geográficamente. Esta capa contiene más del 91% del ozono en la atmósfera terrestre y absorbe 93-99% de la luz ultravioleta de alta frecuencia del sol. El ozono se descompone fotolíticamente a O 2 y oxígeno molecular, (9.2.10), y es esta reacción la que da cuenta de la protección UV de la atmósfera. El ozono se regenera naturalmente por la reacción exotérmica del oxígeno molecular con O 2, (9.2.11).
\[ \rm O_3 + h\nu \rightarrow O_2 + O\]
\[ \rm O + O_2 \rightarrow O_3\]
El equilibrio entre la formación de ozono y la destrucción es, por lo tanto, un mecanismo importante para la protección de los organismos vivos del planeta. Si bien la capa de ozono había sido relativamente constante en la Tierra durante millones de años, los últimos 70 han visto un cambio dramático incluyendo el aumento en el agujero polar en la capa de ozono. El agujero de ozono se define geográficamente como el área donde la concentración total de ozono es menor a 220 Unidades Dobson.
El agujero de ozono ha crecido constantemente en tamaño y duración de existencia en las últimas dos décadas y media. En la actualidad se estima que el tamaño del agujero de ozono sobre la Antártida es de unos 30 millones de km2 (Figura\(\PageIndex{3}\)).