9.6: Comparación de Azufre con Oxígeno
- Page ID
- 69501
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Tamaño
En la tabla\(\PageIndex{1}\) se resumen los tamaños comparativos de oxígeno y azufre.
| Element | Radio atómico (Å) | Radio covalente (Å) | Radio iónico (Å) | radio de van der Waal (Å) |
| Oxígeno | 0.48 | 0.66 | 1.40 | 1.52 |
| Azufre | 0.88 | 1.05 | 1.84 | 1.80 |
Electronegatividad
El azufre es menos electronegativo que el oxígeno (2.4 y 3.5, respectivamente) y como consecuencia los enlaces al azufre son menos polares que los enlaces correspondientes al oxígeno. Un resultado significativo es que con un enlace S-H menos polar el enlace de hidrógeno posterior es más débil que el observado con los análogos O-H. Otra consecuencia de la menor electronegatividad es que el enlace S-O es polar.
Bonos formados
El azufre forma una variedad de tipos de unión. Al igual que con el oxígeno prevalece el estado de oxidación -2. Por ejemplo, el azufre forma análogos de éteres, es decir, tioéteres R-S-R. Sin embargo, a diferencia del oxígeno, el azufre puede formar más de dos enlaces covalentes (no dativos), es decir, en compuestos como SF 4 y SF 6.
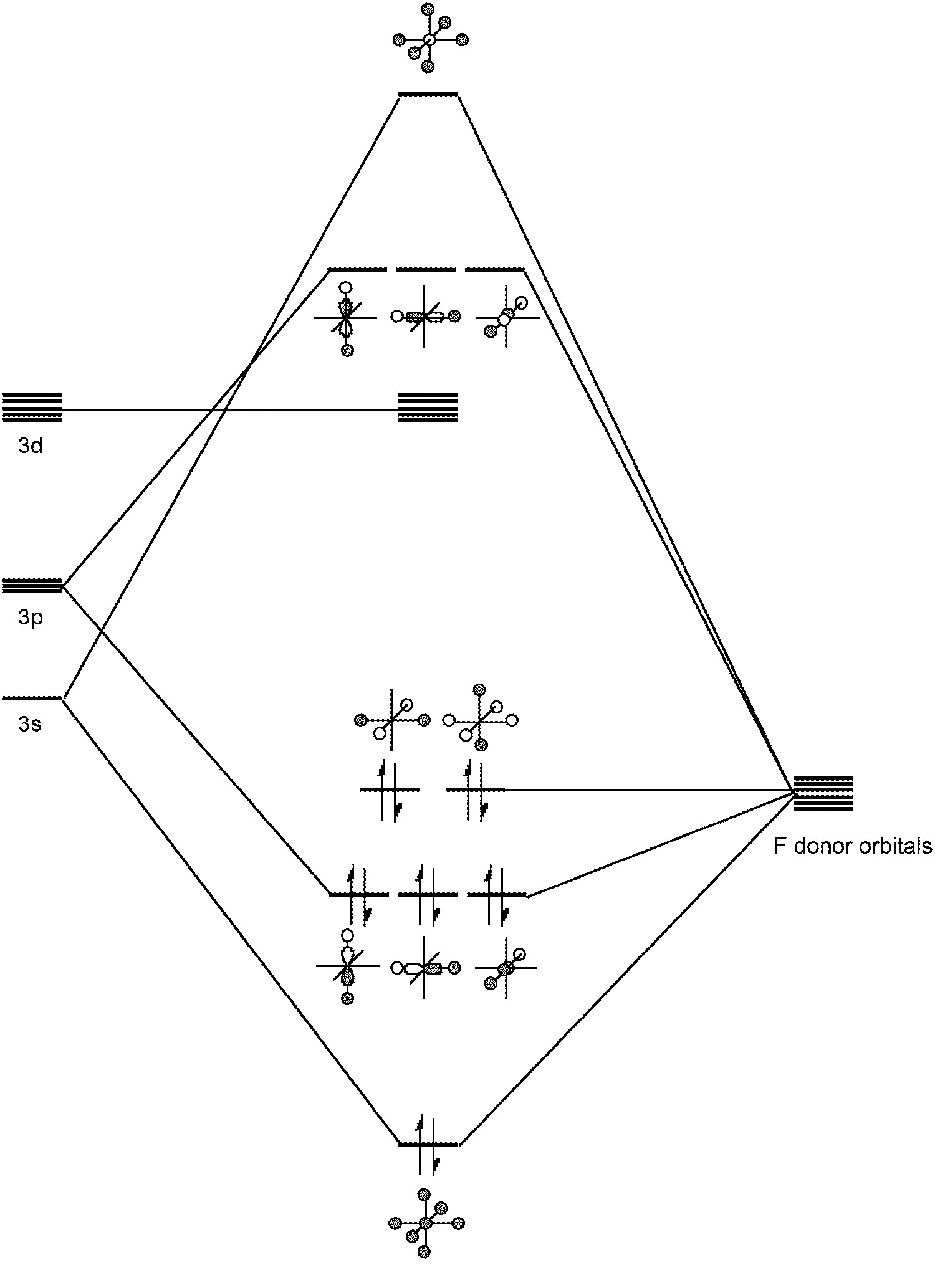
Dichos compuestos hipervalentes originalmente se pensaron que se debían a la inclusión de orbitales d de baja energía en híbridos (p. ej., sp 3 d 2 para SF 6); sin embargo, una mejor imagen implica una combinación de s y p órtbitales en unión (Figura\(\PageIndex{1}\)). Cualquier implicación de los orbitales d se limita a la polarización de los orbitales p más que a la hidradización directa. En este sentido, SF 6 representa la molécula hipervalente arquetípica. Finalmente, el azufre puede formar múltiples enlaces, por ejemplo, Me 2 S=O.
Catenación
La catenación se define como la capacidad de un elemento químico para formar una estructura de cadena larga a través de una serie de enlaces covalentes. La extensión de la catenación del oxígeno se limita al ozono (O 3) y peróxidos (por ejemplo, R-O-O-R). En contraste, la química del azufre es rica en la formación de múltiples enlaces S-S.
Mientras que el azufre elemental existe como una molécula diatómica (es decir, S2) en fase gaseosa a altas temperaturas, el vapor de azufre consiste en una mezcla de oligómeros (S 3 a S 8) como equilibrio dependiente de la temperatura. En estado sólido domina la formación de Sn, y el azufre existe como una gama de polimorfos en los que se produce un enlace S-S extendido en anillos de 6 a 20 átomos (e.g., Figura\(\PageIndex{2}\)) o cadenas (catenasulfur).

El mayor nivel de catenación para azufre se debe a la mayor resistencia de un enlace S-S (226 kJ/mol) en comparación con el enlace O-O (142 kJ/mol). En general se espera que la fuerza de unión homoléptica disminuya bajando un periodo de la Tabla Periódica. La razón de la inesperada debilidad del enlace O-O es que los átomos de oxígeno electronegativos se repelen entre sí y así debilitan el enlace.


