9.8: Óxidos y Oxiácidos de Azufre
- Page ID
- 69497
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Nota
La ortografía alternativa de los ácidos sulfuroso y sulfúrico se basa en la ortografía tradicional del Reino Unido de azufre, es decir, ácido sulfúrico y sulfúrico.
Soluciones de dióxido de azufre y ácido sulfuroso
La combustión de azufre da como resultado la formación de dióxido de azufre gaseoso, (9.8.1).
\[ \rm S + O_2 \rightarrow SO_2\]
La estructura doblada del SO 2 se muestra en la Figura\(\PageIndex{1}\), y como consecuencia de la hibridación sp 2 la molécula es polar.

La modesta temperatura de ebullición de SO 2 (-10 °C) significa que se licua fácilmente y se mantiene fácilmente como líquido a temperatura ambiente bajo una ligera presión. El líquido está asociado por atracciones dipolo-dipolo debido a la naturaleza polar del SO 2. El SO 2 líquido es un buen disolvente debido a la polaridad de la molécula; como consecuencia solubaliza fácilmente compuestos polares y sales. También es conveniente ya que es fácil de eliminar de los productos de reacción por evaporación.
El dióxido de azufre es soluble en soluciones acuosas formadoras de agua donde la mayor parte del SO 2 se mantiene como un hidrato unido a hidrógeno, de manera similar a la observada para soluciones acuosas de dióxido de carbono. En equilibrio en agua neutra (sin base añadida) reacciona una pequeña fracción, para dar una mezcla de bisulfito (HSO 3 -, Figura\(\PageIndex{2}\) a) y sulfito (SO 3 2-, Figura\(\PageIndex{2}\) b), (9.8.2). El ácido libre no existe.
\[ \rm SO_{2(aq)} + H_2O \rightleftharpoons \underset{\underset{H-SO_3^-}{\downarrow}}{HOSO_{2(aq)}^-} \rightleftharpoons SO_{3(aq)}^{2-}\]
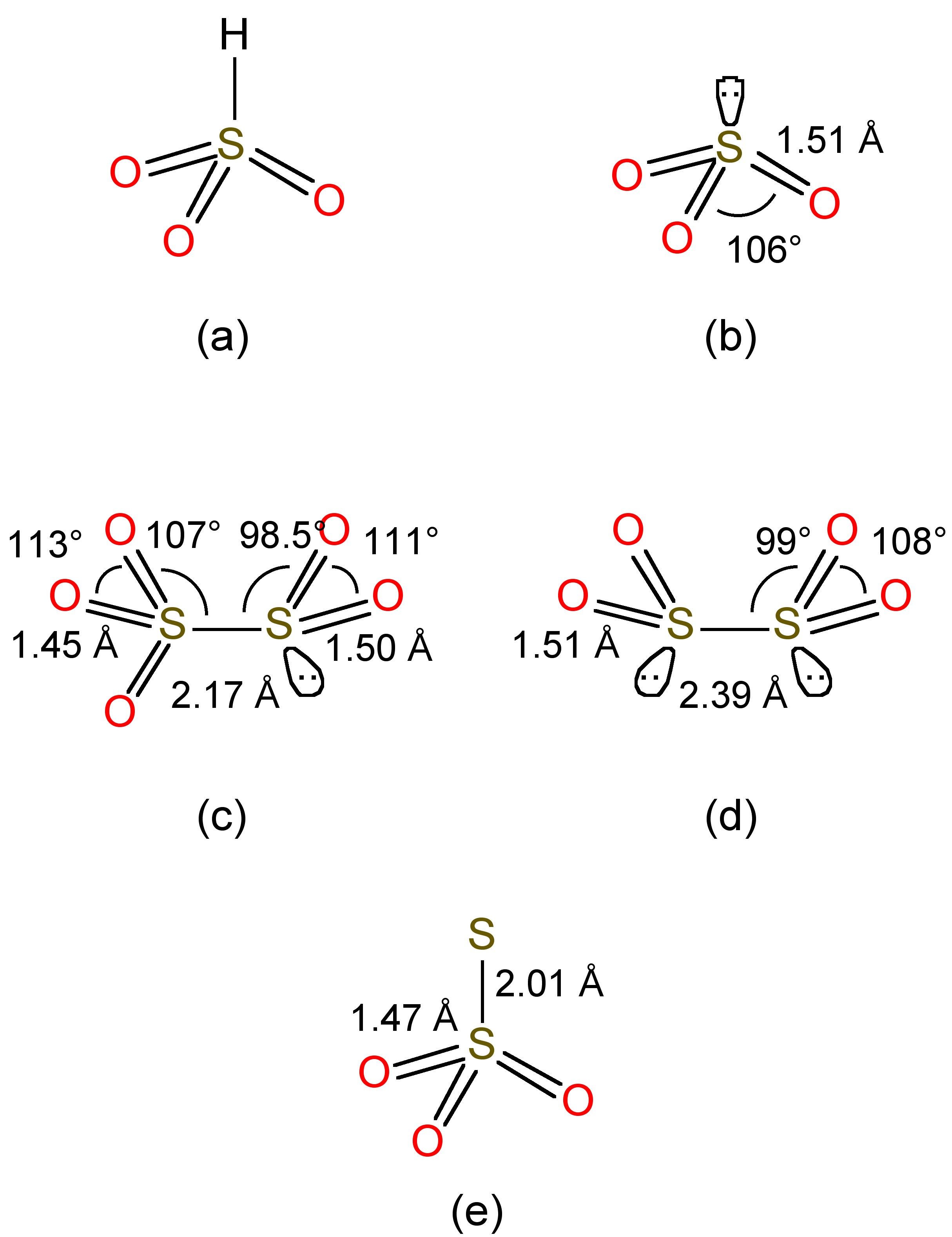
El bisulfito experimenta un equilibrio adicional, (9.8.3), para formar disulfito, cuya estructura se muestra en la Figura\(\PageIndex{2}\) c.
\[ \rm 2 HSO_3^- \rightleftharpoons S_2O_5^{2-} + H_2O \]
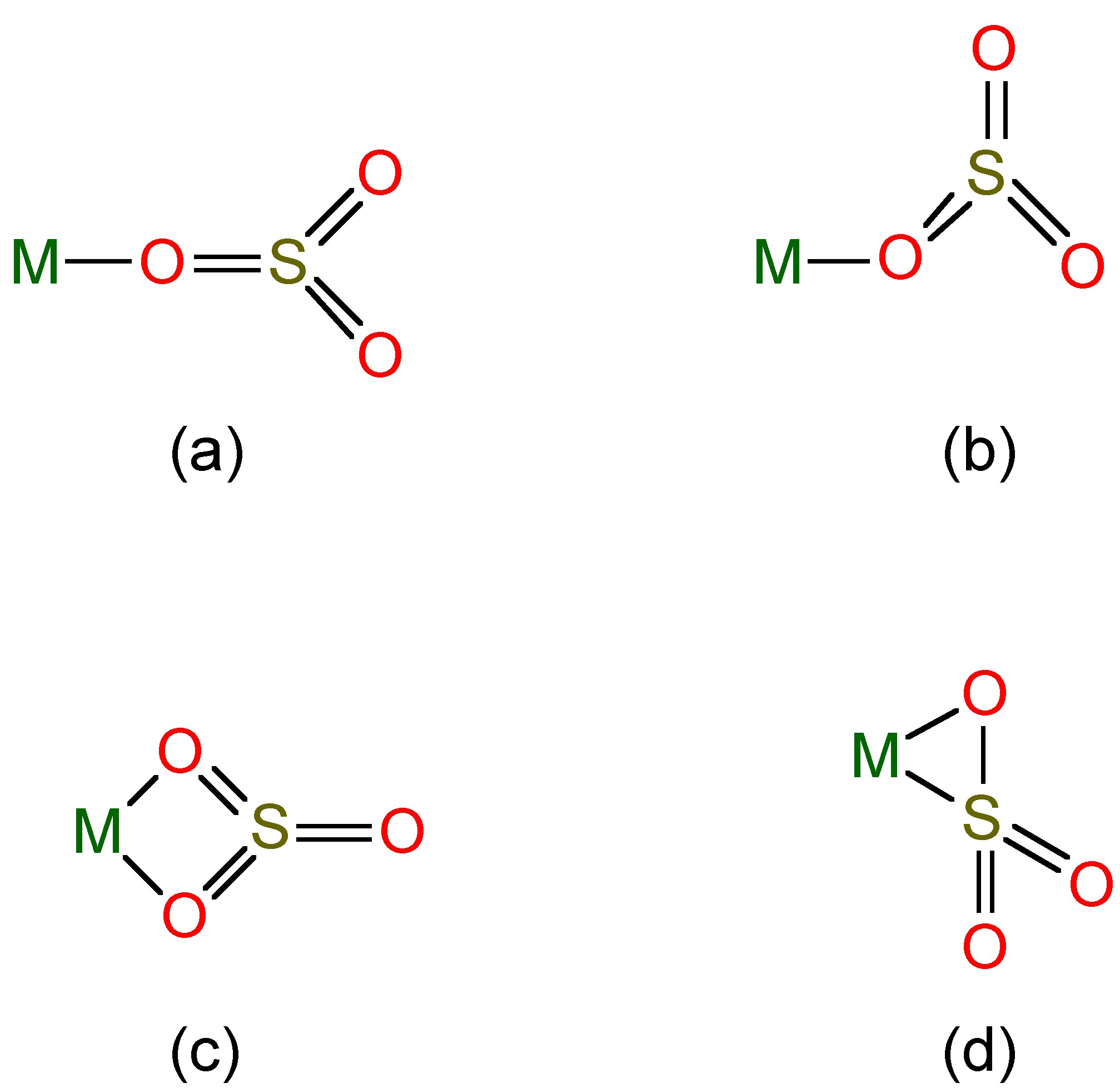
Se conocen sales de estos aniones, y se conocen complejos del ion sulfito (Figura\(\PageIndex{3}\)), mientras que el SO 2 mismo puede actuar como ligando para metales pesados.
El ion bisulfito tiene fuertes propiedades reductoras, por ejemplo, (9.8.4) y (9.8.5).
\[ \rm 2 Fe^{3+} + SO_3^{2-} + 2 OH^- \rightarrow 2 Fe^{2+} + H_2O + SO_4^{2-}\]
\[ \rm 2 MnO_4^+ + 5 SO_3^{2-} + 6 H^+ \rightarrow 2 Mn^{2+} + 3 H_2O + 5 SO_4^{2-}\]
El bisulfito también es reducido por el zinc en presencia de SO 2 adicional, (9.8.6), para formar el anión ditionito altamente reductor (Figura\(\PageIndex{2}\) d). La reacción del bisulfito con azufre elemental produce el anión tiosulfato (Figura\(\PageIndex{2}\) e), (9.8.7) f.
\[ \rm SO_3^{2-} + SO_2 \xrightarrow{Zn} S_2O_4^{2-}\]
\[ \rm SO_3^{2-} + S \rightarrow S_2O_3^{2-}\]
Trióxido de azufre y ácido sulfúrico
La oxidación del dióxido de azufre en presencia de un catalizador (p. ej., platino) produce trióxido de azufre, (9.8.8), que puede condensarse a un líquido a temperatura ambiente (Bp = 45 °C).
\[ \rm 2 SO_2 + O_2 \xrightarrow{Pt} 2 SO_3\]
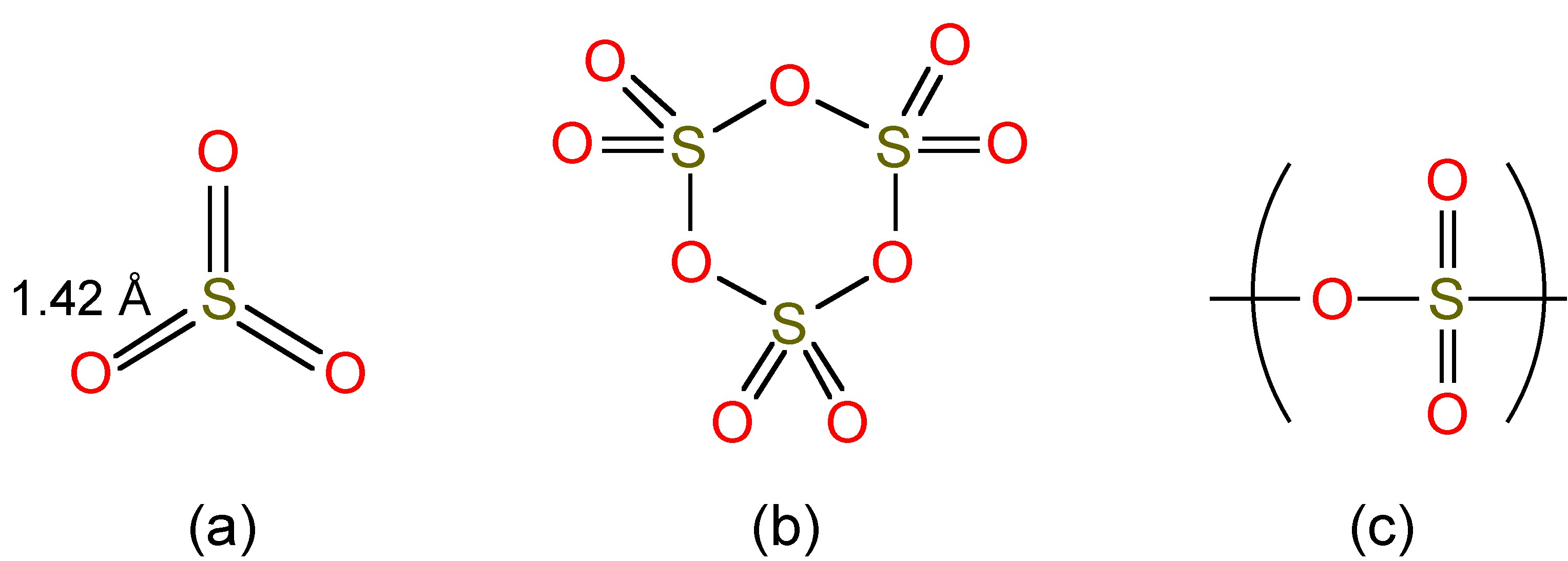
El SO 3 líquido existe como una mezcla de monómero y trímeros (Figura\(\PageIndex{4}\) a y 4b), mientras que como sólido (Mp = 16.9 °C) forma polímeros (Figura\(\PageIndex{4}\) c).
La reacción de SO 3 con agua da como resultado la formación de ácido sulfúrico, H 2 SO 4, como un líquido viscoso con enlaces de hidrógeno. El ácido sulfúrico es un ácido prótico fuerte, que en soluciones diluidas (en agua) reacciona como un ácido dibásico, (9.8.9), formando aniones bisulfato (HSO 4 -) y sulfato (SO 4 2-). Un gran número de sales son conocidas para ambos aniones. Además, se sabe que el sulfato actúa como ligando monodentado o bidentado en complejos de coordinación.
\[ \rm H_2SO_4 \xrightleftharpoons[+ H^+]{- H^+} HSO_4^- \xrightleftharpoons[+ H^+]{- H^+} SO_4^{2-}\]
La disolución de SO 3 en ácido sulfúrico concentrado produce ácido sulfúrico fumiante muy corrosivo, que contiene algo de ácido pirosulfúrico, (9.8.10).
\[ \rm H_2SO_4 + SO_3 \rightleftharpoons H_2S_2O_7\]
ADVERTENCIA
Las propiedades corrosivas del ácido sulfúrico se acentúan por su reacción altamente exotérmica con el agua. Las quemaduras por ácido sulfúrico son potencialmente más graves que las de ácidos fuertes comparables (por ejemplo, ácido clorhídrico), ya que hay daño tisular adicional debido a la deshidratación y particularmente daño térmico secundario debido al calor liberado por la reacción con el agua.
El azufre como fuente de contaminación atmosférica y lluvia ácida
El dióxido de azufre se forma como contaminante durante la combustión de combustibles que contienen azufre, en particular carbón. Si bien la emisión de SO 2 en sí genera preocupaciones, es su conversión a ácido sulfúrico en forma de lluvia ácida lo que ha sido motivo de preocupación desde hace varias décadas. La vía para la formación de ácido sulfúrico en la atmósfera es dependiente de si la reacción ocurre en atmósfera seca o en nubes y lluvia.
Reacciones gaseosas en atmósfera seca
En la atmósfera seca, el dióxido de azufre gaseoso reacciona con el radical hidróxido (formado por la descomposición fotoquímica del ozono, (9.8.11) y (9.8.12), en presencia de una molécula de gas no reactiva como el nitrógeno, (9.8.12). El ácido sulfuroso, así formado reacciona con el oxígeno para generar trióxido de azufre, (9.8.13), que reacciona con el agua para formar ácido sulfúrico, (9.8.14).
\[ \rm O_3 + h\nu \rightarrow O* + O_2\]
\[ \rm O* + H_2O \rightarrow 2 HO\cdot\]
\[ \rm HSO_3 + O_2 \rightarrow HO_2 + SO_3\]
\[ \rm SO_3 + H_2O \rightarrow H_2SO_4\]
Las mediciones indican que la tasa de conversión de SO 2 a H 2 SO 4 es de 4% por hora en un día claro y soleado, pero la tasa es más lenta durante el invierno.
Reacciones de fase líquida en nubes y lluvia
En la fase líquida el SO 2 reacciona directamente con el agua, (9.8.15). El bisulfito (HSO 3 -) es oxidado por peróxido de hidrógeno formando una solución formadora de bisulfato (HSO 4 -), (9.8.16).
\[ \rm 2 SO_2 + 2 H_2O \rightarrow SO_3^{2-} + HSO_3^- + 3 H^+\]
\[ \rm HSO_3^- + H_2O_2 \rightarrow HSO_4^- + H_2O\]
El peróxido de hidrógeno soluble en agua se forma por la oxidación del agua, (9.8.17).
\[ \rm HO_2 + HO_2 \rightarrow H_2O_2 + O_2\]
El radical HO 2 está formado por la fotólisis de compuestos orgánicos carbonílicos, por ejemplo, formaldehído en (9.8.18) y (9.8.19).
\[ \rm H_2\text{C=O} + h\nu \rightarrow H\cdot + HCO\cdot\]
\[ \rm HCO + O_2 \rightarrow HO_2 + CO\]
La tasa de conversión es independiente del pH es muy rápida: casi 100% por hora en verano. Sin embargo, la conversión está limitada por el suministro de peróxido de hidrógeno, que a menudo está presente en niveles mucho más bajos que el SO 2. Por lo tanto, una reducción en las emisiones de dióxido de azufre no siempre se correlaciona con una reducción de la deposición de ácido húmedo.


