10.1: Los Elementos del Grupo 17- Los Halógenos
- Page ID
- 69432
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Los elementos del Grupo 17 tienen un nombre particular: los halógenos que significan nacidos de la sal. Esto se debe a la formación de sales cuando forman compuestos con un metal. En la tabla se\(\PageIndex{1}\) enumera la derivación de los nombres de los halógenos.
| Elemento | Símbolo | Nombre |
|---|---|---|
| Flúor | F | Fluere latino que significa fluir |
| Cloro | Cl | Khlôros griego que significa verde pálido |
| Bromo | Br | Brómos griego que significa hedor |
| Yodo | I | Odas griegas que significan violeta o morado |
| Astatino | En | Griego astatos, que significa inestable |
Descubrimiento
Flúor
El fluorita mineral (también conocido como fluorita) consiste principalmente en fluoruro de calcio y fue descrito en 1530 por Agricola (Figura\(\PageIndex{1}\)) para su uso como fundente. Los fundentes se utilizan para promover la fusión de metales o minerales, y fue a partir de este uso que el flúor derivó su nombre. En 1670 Heinrich Schwanhard descubrió que cuando mezclaba fluorita con un ácido los humos que producían (fluoruro de hidrógeno) grababan las gafas que llevaba puestas. A pesar de que muchos investigadores investigaron la química del fluoruro de hidrógeno (HF) la forma elemental del flúor no se aisló hasta 1886 cuando Henri Moissan (Figura\(\PageIndex{2}\)) estudió la electrólisis de una solución de difluoruro de hidrógeno de potasio (KHF 2) en fluoruro de hidrógeno líquido (HF). La mezcla fue necesaria porque el fluoruro de hidrógeno es un no-conductor. El dispositivo se construyó con electrodos de platino/iridio en un soporte de platino y el aparato se enfrió a -50 °C.


La generación de flúor elemental a partir del ácido fluorhídrico demostró ser excepcionalmente peligrosa, matando o cegando a varios científicos que intentaron experimentos tempranos con este halógeno. A las víctimas se les conoció como mártires de flúor.
Cloro
La evidencia arqueológica ha demostrado que el cloruro de sodio (conocido como sal de mesa) se ha utilizado ya en 3000 aC y salmuera (la solución de agua saturada) ya en 6000 a.C. Se piensa que el ácido clorhídrico probablemente era conocido por el alquimista Jābir ibn Hayyān (Figura\(\PageIndex{3}\)) alrededor del 800 d.C., mientras que el aqua regia (una mezcla de ácido nítrico y ácido clorhídrico) comenzó a usarse para disolver el oro en algún momento antes del 1400 d.C. Al disolver el oro en aqua regia, se libera gas cloro junto con otros gases nauseabundos e irritantes.

El cloro fue preparado y estudiado por primera vez en 1774 por Carl Wilhelm Scheele (Figura\(\PageIndex{4}\)), por lo que se le atribuye su descubrimiento a pesar de que no logró establecer el cloro como elemento, pensando erróneamente que era el óxido obtenido del ácido clorhídrico. Independientemente de lo que él creyera, Scheele sí aisló el cloro al hacer reaccionar MnO 2 (como la pirolusita mineral) con HCl, (10.1.1).
\[ \rm 4 HCl + MnO_2 \rightarrow MnCl_2 + 2 H_2O + Cl_2\]

Bromo
El bromo fue descubierto independientemente por dos químicos Antoine Balard (Figura\(\PageIndex{5}\)) en 1825 y Carl Jacob Löwig (Figura\(\PageIndex{6}\)) en 1826.


Balard encontró sales de bromuro en la ceniza de maleza marina de las marismas de Montpellier. La maleza marina se utilizó para producir yodo, pero también contenía bromo. Balard destiló el bromo de una solución de ceniza de algas saturadas con cloro. Las propiedades de la sustancia resultante se asemejaban a las de un intermedio de cloro y yodo; con esos resultados intentó probar que la sustancia era monocloruro de yodo (ICl), pero después de no hacerlo estaba seguro de que había encontrado un nuevo elemento y lo llamó muride, derivado del Palabra latina muria para salmuera.
En contraste, Löwig aisló bromo de un manantial de agua mineral en Bad Kreuznach. Löwig utilizó una solución de la sal mineral saturada con cloro y extrajo el bromo con Et 2 O. Después de la evaporación quedó un líquido marrón. Desafortunadamente, la publicación de sus resultados se retrasó y Balard publicó primero.
Yodo
El yodo fue descubierto por Bernard Courtois (Figura\(\PageIndex{7}\)) en 1811 cuando estaba destruyendo el material de desecho de la producción de salitre (KNO 3) durante la producción de pólvora. El salitre producido a partir de lechos de nitrógeno franceses requirió carbonato de sodio (Na 2 CO 3), el cual podría aislarse de algas lavadas en las costas de Normandía y Bretaña. Para aislar el carbonato de sodio, se quemaron algas marinas y la ceniza se lavó con agua; los residuos restantes se destruyeron mediante la adición de ácido sulfúrico (H 2 SO 4). Después de agregar demasiado ácido, Courtois observó una nube de vapor púrpura que cristalizó en superficies frías haciendo cristales oscuros. Courtois sospechaba que se trataba de un elemento nuevo pero carecía del dinero para perseguir sus observaciones. Al suministrar muestras a sus amigos, Charles Desormes y Nicolas Clément, esperaba que su investigación continuara. El 29 de noviembre de 1813, Dersormes y Clément hicieron público el descubrimiento de Courtois, describiendo la sustancia a una reunión del Instituto Imperial de Francia.

Astatino
La existencia de eka-yodo había sido predicha por Mendeleev (Figura\(\PageIndex{8}\)), pero el astatine fue sintetizado por primera vez en 1940 por Corson (Figura\(\PageIndex{9}\)), MacKenzie (Figura\(\PageIndex{10}\)) y Segrè (Figura\(\PageIndex{11}\)) en la Universidad de California, Berkeley bombardeando bismuto con alfa partículas.




Abundancia
La abundancia de los halógenos se da en la Tabla\(\PageIndex{2}\).
| Element | Abundancia terrestre (ppm) |
| F | 950 (corteza terrestre), 330 (suelo), 1.3 (agua de mar), 6 x 10 -4 (atmósfera) |
| Cl | 130 (corteza terrestre), 50 — 2000 (suelo), 1.8 x 10 4 (agua de mar) |
| Br | 0.4 (corteza terrestre), 5 — 40 (suelo), 65 (agua de mar) |
| I | 0.14 (corteza terrestre), 3 (suelo), 0.06 (agua de mar), 60 x 10 -3 (atmósfera) |
| En | Traza en algunos minerales |
Isótopos
Los isótopos naturalmente abundantes de los halógenos se listan en la Tabla\(\PageIndex{3}\). Los 33 isótopos de astatina son radiactivos.
| Isótopo | Abundancia natural (%) |
|---|---|
| Fluorín-19 | 100 |
| Cloro-35 | 75.77 |
| Cloro-36 | rastro |
| Cloro-37 | 24.23 |
| Bromo-79 | 50.69 |
| Bromo-81 | 49.31 |
| Yodo-127 | 100% |
Mientras que 19 F es el único isótopo natural abundante de flúor, el isótopo sintético, 18 F, tiene una vida media de aproximadamente 110 minutos, y es comercialmente una fuente importante de positrones para la tomografía por emisión de positrones (PET). La PET es una técnica de imagen de medicina nuclear que produce una imagen tridimensional de los procesos dentro del cuerpo. El sistema detecta pares de rayos γ emitidos indirectamente por un radionúclido emisor de positrones (trazador), que se introduce en el cuerpo sobre una molécula biológicamente activa.
Existen trazas de 36 Cl radiactivo en el ambiente a aproximadamente 7 x 10 -11%. 36 Cl se produce en la atmósfera por la interacción de los rayos cósmicos con 36 Ar. En el suelo se generan 36 Cl a través de captura de neutrones por 35 Cl o captura de muones (una partícula elemental similar a un electrón) por 40 Ca. 36 Cl decae con una vida media de 308,000 años, lo que lo hace adecuado para la datación geológica en el rango de 60.000 a 1 millón de años. Sin embargo, debido a las grandes cantidades de 36 Cl producidas por la irradiación de agua de mar durante las detonaciones atmosféricas de armas nucleares entre 1952 y 1958, también es demandado como marcador de eventos para el agua de los años 50 en el suelo y en las aguas subterráneas.
El yodo tiene 37 isótopos de yodo, pero solo uno, 127 I, es estable. De los isótopos radiactivos, 129 I (vida media 15.7 millones de años) se utiliza para la datación radiométrica de los primeros 85 millones de años de evolución del sistema solar. 129 I también es producto de la fisión de uranio y plutonio, y como consecuencia del reprocesamiento del combustible nuclear y de los ensayos de armas nucleares atmosféricas, la señal natural ha sido inundada. Como consecuencia, ahora puede ser utilizado como trazador de la dispersión de desechos nucleares en el medio ambiente. 129 Me utilizaron en estudios de agua de lluvia para rastrear productos de fisión después del desastre de Chernobyl.
Debido a la captación preferencial de yodo por la tiroides, los isótopos con vidas medias cortas como 131 I pueden ser utilizados para la ablación tiroidea, procedimiento en el que se administra yodo radiactivo por vía intravenosa u oral tras una exploración diagnóstica. Los isótopos de menor energía 123 I y 125 I se utilizan como trazadores para evaluar la función anatómica y fisiológica de la tiroides.
Producción industrial.
La producción industrial de flúor implica la electrólisis de fluoruro de hidrógeno (HF) en presencia de fluoruro de potasio (KF) durante la cual se forma gas flúor en el ánodo y se forma gas hidrógeno en el cátodo (Figura\(\PageIndex{12}\)). El fluoruro de potasio (KF) se convierte en bifluoruro de potasio (KHF 2), (10.1.2), que es el electrolito e intermedio al flúor y al hidrógeno, (10.1.3).
\[ \rm HF + KF \rightarrow KHF_2 \]
\[ \rm 2 KHF_2 \rightarrow 2 KF + 2 F_2 + H_2\]

El HF se forma como un subproducto de la producción de ácido fosfórico, ya que los minerales que contienen fosfato contienen cantidades significativas de fluoruros de calcio, que tras el tratamiento con ácido sulfúrico liberan fluoruro de hidrógeno, (10.1.4).
\[ \rm CaF_2 + H_2SO_4 \rightarrow 2 HF + CaSO_4\]
El cloro se fabrica generalmente por electrólisis de una solución de cloruro de sodio (salmuera). La producción de cloro da como resultado los coproductos soda cáustica (hidróxido de sodio, NaOH) e hidrógeno gaseoso (H 2). El cloro también se puede producir por la electrólisis de una solución de cloruro de potasio, en cuyo caso los coproductos son hidrógeno y potasa cáustica (hidróxido de potasio). Existen tres métodos industriales para la extracción de cloro por electrólisis de soluciones de cloruro, todos procediendo por la misma reacción en el cátodo, (10.1.5), y ánodo, (10.1.6), que conducen a la reacción global, (10.1.7), donde M = Na o K.
\[ \rm 2 H^+_{(aq)} + 2 e^- \rightarrow H_{2(g)}\]
\[ \rm 2 Cl^-_{(aq)} \rightarrow Cl_{2(g)} + 2 e^-\]
\[ \rm 2 MCl + 2 H_2O \rightarrow Cl_2 + H_2 + 2 MOH\]
El bromo existe exclusivamente como sales de bromuro en la corteza terrestre, sin embargo, debido a la lixiviación, las sales de bromuro se han acumulado en el agua de mar, pero a una concentración menor que el cloruro. La mayor parte del bromo se aísla de salmueras ricas en bromo, las cuales son tratadas con gas cloro, enjuagando con aire. En este tratamiento, los aniones bromuro son oxidados a bromo por el gas cloro, (10.1.8).
\[ \rm 2 Br^- + Cl_2 \rightarrow 2 Cl^- + Br_2\]
Dos fuentes principales de yodo se utilizan para la producción comercial: el caliche (un depósito sedimentario endurecido de carbonato de calcio que se encuentra en Chile) y el yodo que contiene salmueras de yacimientos de gas y petróleo en Japón y Estados Unidos. El caliche contiene nitrato de sodio (NaNO 3); en el que se encuentran trazas de yodato de sodio (NaIO 3) y yoduro de sodio (NaI). Durante la producción de nitrato de sodio se extrae el yodato y yoduro de sodio. El yodo procedente de la salmuera implica la acidificación con ácido sulfúrico para formar yoduro de hidrógeno (HI), que luego se oxida a yodo con cloro, (10.1.9). La solución acuosa de yodo se concentra haciendo pasar aire a través de la solución haciendo que el yodo se evapore. La solución de yodo se vuelve a reducir con dióxido de azufre, (10.1.10). El yoduro de hidrógeno seco (HI) se hace reaccionar con cloro para precipitar el yodo, (10.1.11).
\[ \rm 2 HI_{(aq)} + Cl_2 \rightarrow I_{2(aq)} + 2 HCl_{(aq)}\]
\[ \rm I_2 + 2 H_2O + SO_2 \rightarrow 2 HI + H_2SO_4\]
\[ \rm 2 HI + Cl_2 \rightarrow I_2 \downarrow + 2 HCl\]
Propiedades físicas
Las propiedades físicas de los halógenos (Tabla\(\PageIndex{4}\)) abarcan gases (F 2 y Cl 2), un líquido (Br 2), un sólido no metálico (I 2) y un metal metálico (At).
| Elemento | Mp (°C) | Bp (°C) | Densidad (g/cm3) |
|---|---|---|---|
| F | -219.62 | -188.12 | 1.7 x 10 -3 @ 0 °C, 101 kPa |
| Cl | -101.5 | -34.04 | 3.2 x 10 -3 @ 0 °C, 101 kPa |
| Br | -7.2 | 58.8 | 3.1028 (líquido) |
| I | 113.7 | 184.3 | 4.933 |
| En | 302 | 337 | ca. 7 |
Reactividad
Todos los halógenos son altamente reactivos y son como consecuencia de la estabilidad del ion X - son agentes oxidantes fuertes (Tabla\(\PageIndex{5}\)).
| Reducción | Potencial de reducción (V) |
| F 2 + 2 e - → 2 F - | 2.87 |
| Cl 2 + 2 e - → 2 Cl - | 1.36 |
| Br 2 + 2 e - → 2 Br - | 1.07 |
| I 2 + 2 e - → 2 I - | 0.53 |
ADVERTENCIA
El flúor elemental (gas flúor) es un oxidante altamente tóxico y corrosivo, que puede provocar la ignición de material orgánico. El gas flúor tiene un olor acre característico que es detectable en concentraciones tan bajas como 20 ppb. Al ser tan reactivo, todos los materiales de construcción deben ser cuidadosamente seleccionados y las superficies metálicas deben pasivarse. En altas concentraciones, las sales solubles de fluoruro también son tóxicas y el contacto de la piel o los ojos con altas concentraciones de muchas sales de fluoruro es peligroso.
Uso de cloro como arma
El gas cloro, también conocido como bertolita, fue utilizado por primera vez como arma en la Primera Guerra Mundial por Alemania el 22 de abril de 1915 en la Segunda Batalla de Ypres. Alrededor de las 5:00pm del 22 de abril de 1915, el Ejército Alemán liberó ciento sesenta y ocho toneladas de gas cloro sobre un frente de 4 millas contra tropas francesas y coloniales marroquíes y argelinas de las divisiones 45 y 78 francesas (Figura\(\PageIndex{13}\)). El ataque implicó un esfuerzo logístico masivo, ya que tropas alemanas arrastraron 5730 cilindros de gas cloro, con un peso de noventa libras cada uno, al frente con la mano. Los soldados alemanes también abrieron los cilindros a mano, confiando en los vientos predominantes para llevar el gas hacia las líneas enemigas. Debido a este método de dispersión, un gran número de soldados alemanes resultaron heridos o muertos en el proceso de llevar a cabo el ataque. Aproximadamente 6,000 tropas francesas y coloniales murieron en diez minutos en Ypres, principalmente por asfixia y posterior daño tisular en los pulmones. Muchos más quedaron cegados. El gas cloro forma ácido clorhídrico cuando se combina con agua, destruyendo los tejidos húmedos como los pulmones y los ojos. El gas cloro, al ser más denso que el aire, llenó rápidamente las trincheras, obligando a las tropas a subir al fuego enemigo pesado.

Según lo describieron los soldados tenía un olor distintivo a una mezcla entre pimienta y piña. También tenía un sabor metálico y picaba la parte posterior de la garganta y el pecho. El daño que produce el gas cloro se puede prevenir mediante una máscara de gas, u otro método de filtración, haciendo que las muertes por un ataque de gas cloro sean mucho más bajas que las de otras armas químicas. El uso como arma fue pionero por Fritz Haber (Figura\(\PageIndex{14}\)) del Instituto Kaiser Wilhelm de Berlín, en colaboración con el conglomerado químico alemán IG Farben, quien desarrolló métodos para descargar gas cloro contra un enemigo atrincherado. Se alega que el papel de Haber en el uso del cloro como arma mortal llevó a su esposa, Clara Immerwahr, al suicidio. Después de su primer uso, el cloro fue utilizado por ambas partes como arma química (Figura\(\PageIndex{15}\)), pero pronto fue reemplazado por los gases más letales fosgeno y gas mostaza.


Fase de vapor
Todos los halógenos forman X 2 dímeros en fase vapor de manera análoga al hidrógeno. Sin embargo, a diferencia del dihidrógeno, el enlace está asociado con la combinación orbital molecular de los dos orbitales p (Figura\(\PageIndex{16}\)). Las longitudes de enlace y las energías se dan en la Tabla\(\PageIndex{6}\).
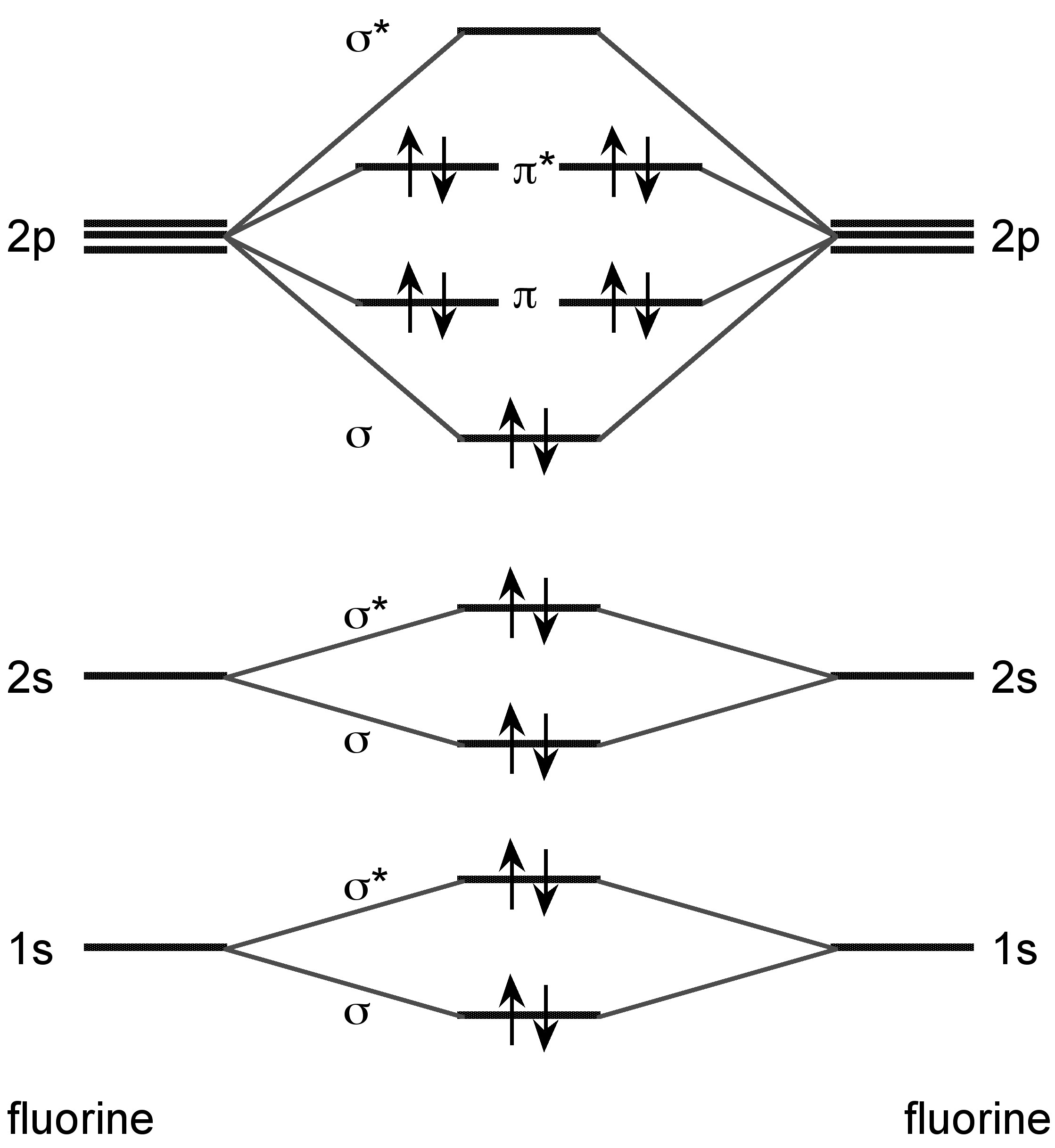
| Element | Longitud de enlace (Å) | Energía (kJ/mol) |
| F 2 | 1.42 | 158 |
| Cl 2 | 1.99 | 243 |
| Br 2 | 2.29 | 193 |
| I 2 | 2.66 | 151 |
Estado sólido
El yodo cristaliza en el grupo espacial ortorrómbico Cmca (Figura\(\PageIndex{17}\)). En estado sólido, las moléculas I 2 aún contienen un enlace I-I corto (2.70 Å).

Compuestos de los halógenos.
La química de los halógenos está dominada por la estabilidad del estado de oxidación -1 y la configuración del gas noble del anión X -.
Estado de oxidación
El uso del estado de oxidación para el flúor es casi sin sentido ya que como el elemento más electronegativo, el flúor existe en el estado de oxidación de -1 en todos sus compuestos, excepto el flúor elemental (F 2) donde el estado de oxidación es cero por definición. A pesar de la aceptación general de que los elementos halógenos forman el anión haluro asociado (X -), los compuestos con estados de oxidación de +1, +3, +4, +5 y +7 son comunes para cloro, bromo y yodo (Cuadro\(\PageIndex{7}\)).
| Element | -1 | +1 | +3 | +4 | +5 | +7 |
|---|---|---|---|---|---|---|
| Cl | HCl | CLF | ClF 3, HClO 2 | ClO 2 | ClF 5, ClO 3 - | HClO 4 |
| Br | HBr | BrCl | BrF 3 | Br 2 O 4 | BrF 5, BrO 3 - | BrO 4 - |
| I | HOLA | iCL | SI 3, iCL 3 | I 2 O 4 | IO 3 - | IO 4 - |
Bibliografía
- G. Agricola, De Re Metallica, Dover Publications, Reino Unido (1950)
- K. Christe, Inorg. Chem. , 1986, 25, 3721.


