1.2: ¿Qué es la química?
- Page ID
- 77236
La química es el estudio de la materia. Más específicamente, la química estudia la composición, las propiedades y las transformaciones de la materia.
Las propiedades de la materia son de dos tipos, propiedades físicas y propiedades químicas, como se ilustra en la Fig. 1.3.1.

Propiedad física y proceso físico
Propiedad física
La propiedad física es la propiedad que, cuando se observa, no cambia la composición elemental de la materia.
Los ejemplos incluyen color, masa, volumen, conductividad eléctrica y conductividades térmicas.
Las propiedades físicas que no dependen de la cantidad de materia se denominan propiedades intensivas, por ejemplo, color, densidad y conductividad térmica.
Las propiedades físicas que dependen de la cantidad de la sustancia, como, masa y volumen, se denominan propiedades extensas.
Proceso físico
Cualquier proceso que cambie la materia de alguna manera pero que no cambie la composición elemental se denomina proceso físico.
Por ejemplo, fundir sólido a líquido o hervir líquido al estado gaseoso son procesos físicos.
Las mezclas se pueden separar mediante procesos físicos basados en las diferencias en las propiedades físicas de los constituyentes. La Fig. 1.3.2 demuestra que un material magnético como el hierro se puede separar de un material no magnético como el azufre usando un imán.
El proceso de filtración puede separar una mezcla heterogénea de líquido y sólido, como arena en agua. El agua pasa a través del papel de filtro dejando atrás las partículas de arena en el filtro.
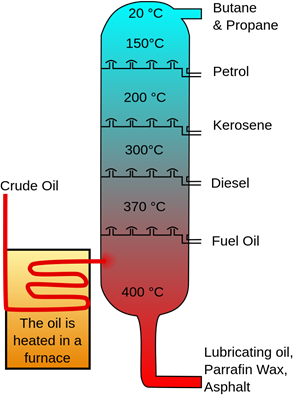
El proceso de destilación puede separar mezclas homogéneas de sólidos en líquidos o líquidos en líquidos en base a la diferencia en los puntos de ebullición de los componentes. Por ejemplo, una mezcla salina homogénea disuelta en agua se separa destilando el agua en su punto de ebullición, dejando atrás la sal sólida. La destilación también puede separar una mezcla de dos o más líquidos si sus puntos de ebullición son diferentes, por ejemplo, una destilación de petróleo crudo separa los componentes en función de sus puntos de ebullición.
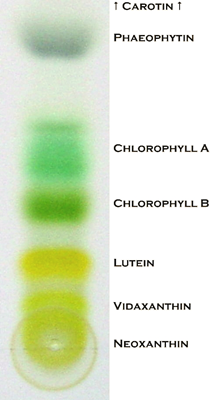
La cromatografía es otra técnica de uso frecuente para separar mezclas. La mezcla, por ejemplo, tinta, se adsorbe sobre una fase estacionaria, por ejemplo, sobre un papel poroso, y la separación tiene lugar fluyendo la fase líquida, por ejemplo, agua que asciende a través de los capilares en el papel. El componente de la mezcla de tinta se separa porque algunos componentes tienen más capacidad de permanecer adsorbidos en la fase sólida y menos capacidad de solubilizarse en la fase líquida que los otros componentes. Fig. 1.3.2 Ilustra los procesos de separación física descritos.

Propiedad química y proceso químico
Proceso químico
Las propiedades químicas se relacionan con el cambio en la composición elemental de la materia.
Por ejemplo, el metano (CH 4) en el gas natural es combustible -esta es una propiedad química. Significa que el metano y el oxígeno cambian su composición elemental para convertirse en dióxido de carbono y agua y liberar calor después de la ignición.
Proceso químico
Un proceso que cambia la composición elemental se denomina proceso químico o reacción química.
Por ejemplo, la fotosíntesis es un proceso químico que convierte el dióxido de carbono y el agua en glucosa utilizando la energía de la luz solar.
Ecuación química
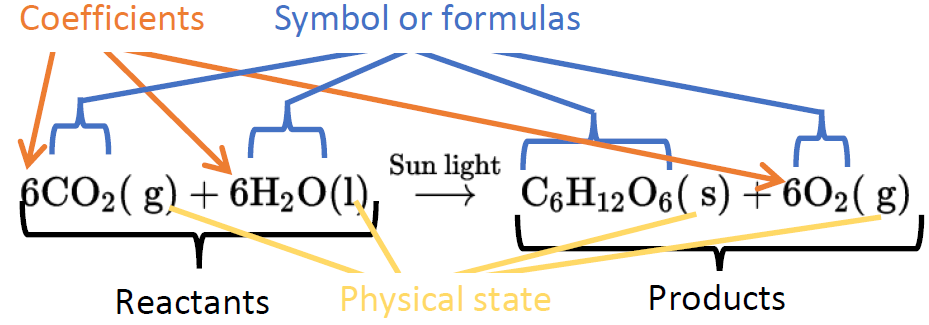
Una ecuación química representa una reacción química en forma de símbolos de elementos y compuestos involucrados.
Las sustancias consumidas en una reacción química son reactivos, y las sustancias formadas son productos. Los reactivos están escritos en el lado izquierdo, separados por un signo más, seguido de una flecha, y los productos están en el lado derecho de la flecha, como se ilustra en la Fig. 1.3.3. Por ejemplo, la siguiente ecuación química representa la combustión de metano.
\ begin {ecuación}
\ mathrm {CH} _ {4} +2\ mathrm {O} _ {2}\ largoderrow\ mathrm {CO} _ {2} +2\ mathrm {H} _ {2}\ mathrm {O}\ nonumber
\ end {ecuación}
Obsérvese que la fórmula química sin ningún número precedente, por ejemplo, O 2 y CO 2, representa una molécula o una cantidad unitaria del producto químico. El número que precede a la fórmula se denomina coeficiente, y representa el número de partículas o el número de unidades involucradas. Por ejemplo, el coeficiente de 2 en 2H 2 O en la ecuación química anterior representa dos moléculas de agua formadas o dos moles de agua formados, donde el mol es la cantidad unitaria. Tenga en cuenta que la composición química ha cambiado en la reacción química. Antes, una sustancia era átomos de carbono e hidrógeno en una proporción de 1:4, y la otra sustancia eran átomos de oxígeno. Después de la reacción, una sustancia es átomos de carbono y oxígeno en una proporción 1:2, y la otra es hidrógeno y oxígeno en una proporción 2:1.
El estado físico de la materia a veces se muestra en una ecuación química mediante los siguientes símbolos: (s) para sólido, (l) para líquido, (g) para gas y (aq) para una sustancia disuelta en agua, como se ilustra en la Fig. 1.3.3.
Método científico: ¿cómo progresa la ciencia?
La química es una rama de la ciencia. El conocimiento de la ciencia se recoge sistemáticamente de generación en generación a través del método científico.
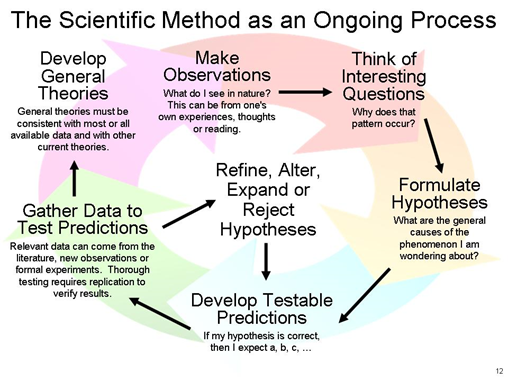
El método científico comienza con hacer observaciones, dar una explicación tentativa, es decir, hipótesis, probar la hipótesis, es decir, experimentar, y deducir una conclusión de la investigación. Una verdad encontrada a través de experimentos repetidos se convierte en una ley, y una explicación completa de los hallazgos relacionados recopilados con el tiempo se convierte en una teoría.
Estos pasos del método científico se ilustran en la Fig. 1.3.4 y se describen a continuación.
Observación
La observación es la adquisición activa de información de una fuente primaria. Por ejemplo, usted llena el aire en una llanta de automóvil y nota que la lectura de presión en el manómetro aumenta a medida que más gasolina llena la llanta. Este es un ejemplo de observación.
Hipótesis
Una hipótesis es una explicación tentativa de la observación o una ley basada en el conocimiento científico disponible. Por ejemplo, John visita a un amigo y comienza a estornudar. El amigo dice que tengo un gato, y podrías ser alérgico a los gatos. Esta explicación tentativa del estornudo de Juan es una hipótesis.
Experimento
Los experimentos prueban la hipótesis. Por ejemplo, John visita a otro amigo que tiene un gato para averiguar si es alérgico a los gatos o no. Si estornuda en este experimento, apoya la hipótesis. Si no estornuda, el experimento desmiente la hipótesis.
Conclusión
Una hipótesis comprobada como verdadera se convierte en una conclusión. La hipótesis es rechazada o revisada si los resultados del experimento no la apoyan. Por ejemplo, científicos de todo el mundo y en diferentes periodos intentaron convertir otros metales en oro y fallaron cada vez. Se concluyó que los elementos no se transforman en la materia más simple por ninguna reacción física o química.
Derecho
Si una observación es universalmente verdadera en experimentos repetidos, se convierte en una ley. Ejemplos de derecho son los siguientes.
- La presión de cualquier gas es directamente proporcional a la cantidad de gas si la temperatura y el volumen se mantienen constantes, es la ley de Avogadro.
- La proporción de átomos de diferentes elementos en un compuesto es siempre la misma, es una ley de proporción constante.
- La masa antes de cualquier reacción química es la misma que después de la reacción química, es decir, la masa se conserva en cualquier reacción o proceso químico, lo cual es una ley de conservación de la masa.
Teoría
Se llama teoría si alguien propone una explicación integral basada en principios científicos para explicar varias leyes y conclusiones sobre un tema relacionado. Por ejemplo, el conocimiento acumulado a lo largo del tiempo sobre las propiedades de la materia llevó a Dalton a presentar la teoría atómica de Dalton.
Los postulados de la teoría atómica de Dalton son:
- los elementos están compuestos por diminutas partículas indivisibles llamadas átomos;
- los átomos de cualquier elemento son idénticos entre sí pero diferentes de los átomos de cualquier otro elemento;
- Los átomos de diferentes elementos reaccionan entre sí en una relación de número entero constante para producir un compuesto;
- los átomos en un compuesto se separan y se recombinan para dar nuevo material. Aún así, los átomos no son creados ni destruidos en la reacción.
Estos postulados explican las propiedades de la materia descritas en los apartados anteriores. Por ejemplo, los elementos no pueden convertirse en sustancias más simples por ningún proceso físico o químico porque están compuestos por un tipo de átomo. Los átomos son indivisibles según el primer postulado. Los compuestos pueden convertirse en elementos por la reacción química porque los átomos en los compuestos pueden separarse y recombinarse de acuerdo con el cuarto postulado.
¿Qué sucede después de que se acepta una teoría?
La teoría pasa por la prueba del tiempo. Si sigue explicando los resultados de futuros experimentos, sigue siendo válido. Si se desacredita o no puede explicar algunas observaciones de experimentos futuros, se rechaza o se revisa. Por ejemplo, “los átomos no son divisibles” ya no se considera válido. Según el conocimiento actual, los átomos pueden dividirse en partículas subatómicas como electrones, protones y neutrones. Sin embargo, las partículas subatómicas ya no representan el elemento.
“Los átomos del mismo elemento son iguales” ha sido revisado porque los isótopos son átomos del mismo elemento que son diferentes en algunos aspectos. La afirmación “los átomos no se crean ni se destruyen” sigue siendo válida para reacciones químicas pero no se sostiene en reacciones nucleares donde los átomos de un elemento pueden convertirse en átomos de otros elementos. De igual manera, la materia puede convertirse en energía y viceversa en las reacciones nucleares, siguiendo la famosa ecuación de Einstein: E = mc 2, donde E es energía, m es masa y c es la velocidad de la luz. Significa que la ley de conservación de la masa y la ley de conservación de la energía no son válidas individualmente en una reacción nuclear. Aún así, la masa y la energía juntas se conservan en reacciones nucleares. Estos son ejemplos de revisiones hechas en teoría a lo largo del tiempo.
La teoría es un conocimiento básico que permite la predicción de nuevas leyes y conduce a nuevas ideas sobre los conceptos relacionados. Por ejemplo, Dalton predijo la ley de proporciones múltiples, también conocida como ley de Dalton, es decir, si los átomos de dos elementos pueden combinarse en una relación de números enteros para dar un compuesto específico, también pueden mezclarse en otra proporción de números enteros para dar otro compuesto.
Cuando los elementos forman compuestos, las proporciones de los elementos en esos compuestos químicos se pueden expresar en pequeñas proporciones de números enteros.
Por ejemplo, los átomos de hidrógeno y oxígeno pueden mezclarse en una proporción 2:1 para proporcionar agua (H 2 O). Aún así, también pueden combinarse en una proporción 2:2 para dar peróxido de hidrógeno (H 2 O 2), un compuesto diferente. De igual manera, el carbono y el hidrógeno se combinan en una relación 1:4 para hacer metano (CH 4); pueden combinarse en una proporción 2:6 para hacer otro compuesto etano (C 2 H 6).


